
4月13日,美国FDA宣布,在两名多发性硬化症(MS)患者出现肝损伤迹象后,已部分暂停默克公司在德国的三期试验,该试验旨在研究BTK抑制剂evobrutinib(M2951)对复发性多发性硬化症(MS)的治疗效果。
目前,全球III期临床开发评估evobrutinib治疗MS项目包括2个关键III期研究,EVOLUTION RMS1(NCT04338022)和EVOLUTION RMS2(NCT04338061)。
多发性硬化症(MS)是一种慢性炎症性中枢神经系统疾病,是年轻人最常见的非创伤性、致残性神经系统疾病。据估计,全世界大约有280万人患有多发性硬化症。虽然症状可能有所不同,但MS最常见的症状包括视力模糊、四肢麻木或刺痛以及力量和协调问题。多发性硬化的复发类型是最常见的。
监管令禁止默克公司将新患者纳入试验,并要求停止对接受evobrutinib治疗不足70天的参与者进行给药。默克公司报告称,目前两名患者均无症状,无需住院治疗。停止evobrutinib治疗后,肝脏酶水平恢复正常化。
因为试验招募了接触研究药物超过70天的参与者,默克公司预计临床暂停不会影响研究的时间表。初步统计定于2023年第四季度进行。
尽管如此,该公司在法兰克福证券交易所的股价还是下跌了7%。默克公司也在与美国食品药品监督管理局合作,确定埃沃布鲁替尼的最佳方案。
01
BTK抑制剂的前景与风险
evobrutinib可以穿透血脑屏障,是一种口服候选药物,属于一类被称为BTK抑制剂的药物。
BTK(Bruton’s tyrosine kinase),即布鲁顿酪氨酸蛋白激酶,是非受体酪氨酸激酶Tec家族的成员,除T细胞和自然杀伤细胞外,在所有造血细胞(如B细胞和髓细胞)中均有表达。BTK是一种连接B细胞受体(BCR)信号、趋化因子受体信号、Toll样受体(TLR)信号的关键分子,在调节B细胞方面发挥关键作用。BTK可直接与5种不同的分子相互作用,可促进细胞增殖、抗体分泌和促炎性细胞因子的产生等,进而调节B细胞粘附、迁移以及肿瘤微环境等。鉴于其广泛而关键的生理作用,BTK成为治疗自身免疫性疾病和B细胞恶性肿瘤中富有吸引力的一个治疗靶点。
全球范围内共有5款BTK抑制剂获批上市,除伊布替尼外,其余四款均为第二代BTK抑制剂,分别是:阿斯利康的阿卡替尼(Acalabrutinib,2017年获批)、百济神州的泽布替尼(Zanubrutinib,2019年获批)、小野制药/吉利德的替拉鲁替尼(tirabrutinib,2020年获批)、诺诚健华的奥布替尼(Orelabrutinib,2020年获批)。
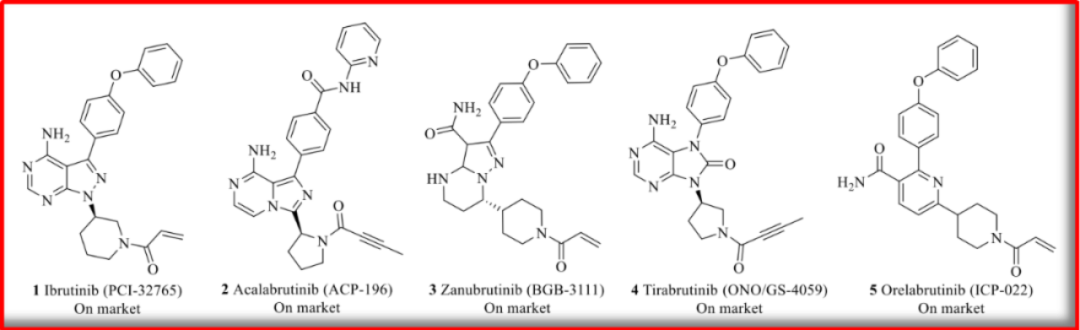
目前BTK抑制剂的总体市场规模已经超过100亿美元。其中2013年上市的伊布替尼在2021年全球销售规模达到97.77亿美元,预测2026年销售额将达到136亿美元,是里程碑式重磅级产品。阿卡替尼在2021年销售规模排第二,销售额为12.38亿美元;2019年11月获批的百济神州的泽布替尼位列第三,替拉鲁替尼(tirabrutinib hydrochloride)和奥布替尼的上市时间较晚,销售贡献在BTK市场中较小。
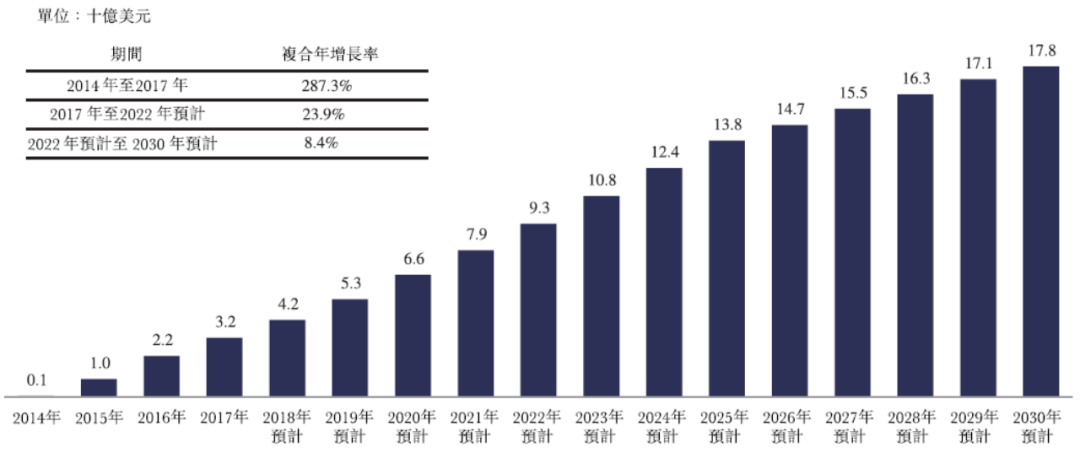
图源:沙利文研究所
多发性硬化症领域,BTK抑制剂频频碰壁
在多发性硬化症中,靶向BTK蛋白可以降低攻击神经保护鞘的自身抗体水平,从而得到更好的疾病结果。BTK抑制剂在MS中的前景吸引了其他生物制药公司,赛诺菲在三年前以3亿美元的价格收购了Principia Biopharma。一年后,Biogen从中国InnoCare Pharma获得了BTK抑制剂的授权。诺华和罗氏也在测试MS类药物。但安全问题导致该领域的成功有限。
上个月,Biogen终止了与InnoCare Pharma的合作关系,并将正在研究的BTK抑制剂orelabrutinib(奥瑞拉鲁替尼)退还给了中国合作者。这两家公司曾经于2021年7月首次签署了许可协议,由Biogen支付1.25亿美元的预付款,并承诺在商业和发展里程碑中再增加8.125亿美元,用于MS和其他免疫性疾病的研究,

2022年12月,InnoCare宣布,由于与药物相关的肝损伤病例,美国食品药品监督管理局已暂停orelabrutinib的部分临床使用。
肝脏毒性同样导致赛诺菲的BTK抑制剂tolebrutinib(托列布替尼)出现问题,2022年6月,美国食品药品监督管理局(FDA)将tolebrutinib(SAR442168)用于多发性硬化症(MS)和重症肌无力(MG)的3期临床研究部分暂停。在美国参加试验少于60天的参与者应暂停研究药物。在试验中完成至少60天的美国参与者应继续治疗。FDA的这一行动是基于在3期研究中发现的少量药物性肝损伤病例。赛诺菲也在研究托列布替尼治疗重症肌无力,但在2月份放弃了这一项目。

[1] FDA, citing safety concerns, places partial hold on Merck KGaA’s MS drug. 2023.4.13
[2] FDA pumps brakes on Sanofi's $3.7B multiple sclerosis bet, imposing partial hold over liver injuries .2022.07.30

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#III期临床试验# #BTK抑制剂# #暂停#
5