【Blood】Menin抑制剂治疗急性白血病的临床价值
2025-01-11 聊聊血液 聊聊血液 发表于陕西省
《Blood》近日发表综述,阐述了menin 抑制剂的临床价值,突出其作用机制、疗效、安全性和转化 AML 治疗的潜力。
急性髓系白血病 (AML) 是一种异质性血液系统恶性肿瘤,以髓系祖细胞的 (oligo) 克隆扩增为特征。尽管治疗取得了进展,但 AML 的治愈仍然具有挑战性,尤其是在特定基因异常的患者中。Menin抑制剂已成为一种有前景的治疗方法,可靶向 AML 的关键遗传驱动因素,如 KMT2A 重排和 NPM1 突变。《Blood》近日发表综述,阐述了menin 抑制剂的临床价值,突出其作用机制、疗效、安全性和转化 AML 治疗的潜力。
表观遗传
基因转录改变导致各种生物学过程紊乱,是癌症的标志,也是髓系恶性肿瘤如急性髓系白血病 (AML) 多步骤发展的基础。异常基因调控可能是染色体异常或基因突变的结果,但也可能是表观遗传学改变的结果(即对 DNA 的化学修饰和在不改变基础 DNA 序列的情况下调控基因表达的相关蛋白)。参与表观遗传调控的基因(例如DNMT3A、TET2、ASXL1、IDH1和IDH2)在 AML 中经常发生突变。表观遗传调控机制包括通过 DNA 甲基转移酶 (DNMTs) 在调控 CpG 岛处向 DNA 添加甲基、组蛋白修饰和非编码RNA。与染色体异常和基因突变相比,表观遗传变化可能是可逆的,从而为癌症治疗提供了有吸引力的靶点。
组蛋白是必需的核蛋白,在组织和压实 DNA 成染色质中起着至关重要的作用。组蛋白作为卷轴,在其周围 DNA 缠绕,形成单位,称为核小体,由8个组蛋白(H2A、H2B、H3和 H4 各2个)的核心组成。这些组蛋白的翻译后修饰影响基因表达和染色质结构。组蛋白转录调控的复杂性通过许多组蛋白修饰来说明,其中包括:i)赖氨酸残基的乙酰化,通常与基因激活相关;ii)赖氨酸或精氨酸残基的甲基化,可以激活或抑制基因表达;iii)组蛋白上丝氨酸、苏氨酸或酪氨酸残基的磷酸化,其通常参与细胞分裂和 DNA 修复过程中染色质结构的调控;iv)赖氨酸残基的泛素化,其可以为组蛋白降解发出信号或改变染色质结构。这些修饰被动态地用于通过被称为“writers”、“readers”和“erasers”的特定酶调节基因转录。已经开发了这些酶的多种抑制剂来影响表观遗传编程和随后的致癌转录程序,例如组蛋白去乙酰化酶抑制剂(HDAC抑制剂)。尽管最初 HDAC 抑制剂被认为是治疗髓系恶性肿瘤的有希望的药物(特别是当与 DNA 去甲基化药物联合使用时),但HDAC抑制剂尚未实现这一希望。
组蛋白在转录激活(转录的启动)和延伸(RNA聚合酶沿着基因移动时的 RNA 合成)中起关键作用。基础转录因子、聚合酶 II 募集和所需的开放染色质结构的错综复杂的相互作用,由适当的组蛋白修饰决定,控制基因表达程序。Menin和trithorax蛋白 KMT2A在这些过程中发挥重要功能。
Menin
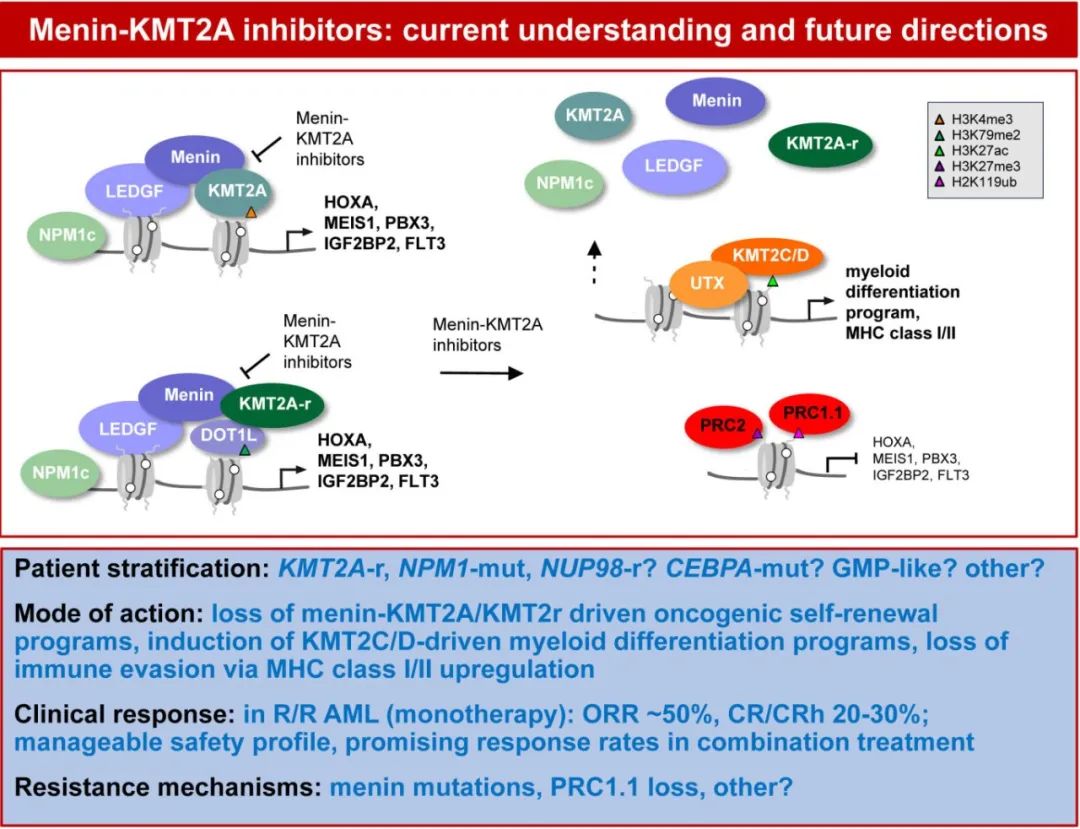
Menin 由 MEN1 基因编码,该基因在多发性内分泌肿瘤1型(MEN1)综合征患者中因其生殖系功能丧失突变而为人所知。Menin由于作为支架蛋白的作用,与各种伴侣相互作用控制基因表达和细胞稳态,对表观遗传调控至关重要。Menin作为H3K4(即组蛋白3蛋白4位的赖氨酸氨基酸 (K))甲基转移酶KMT2A(以前称为MLL[混合谱系白血病1])和LEDGF(晶状体上皮衍生生长因子)之间的衔接蛋白(图1)。Menin还可以与精氨酸甲基转移酶PRMT5、H3K9甲基转移酶 SUV39H1 和几种转录因子相互作用。Menin通过与 KMT2A 复合物与相关染色质修饰因子的相互作用,可以激活致癌转录程序,包括通过上调 HOXA 簇和 MEIS1 介导的转录程序。显然,虽然 menin 在内分泌组织中起抑癌因子的作用,但它在白血病中起着致癌辅因子的作用。
HOXA/MEIS1 表达上调是 NPM1 突变 AML 伴 NPM1 突变的标志性特征,约占所有 AML 的20-30%,与其他 AML 亚型相比,通常具有正常的核型和相对良好的预后,但预后也可能因其他遗传因素和治疗反应而异。在 AML 中,C末端核仁定位信号的 NPM1 突变导致 NPM1 蛋白的异常细胞质定位。最近研究表明,一些突变的 NPM1 蛋白确实存在于细胞核中,与 KMT2A 共同占据特定的染色质靶标,例如 HOXA 位点。HOXA/MEIS1上调也见于 KMT2A 重排白血病,占所有白血病的5-10%。对于 KMT2A 重排白血病,最常见的重排MLLT3::KNMT2A根据 ELN-2022 分类为中危,而其他 KNMT2A 重排与预后不良相关。KMT2A重排白血病最常见于年轻患者,包括婴儿 (70-80%) 和儿童,但也可见于成人(>60岁 AML 患者中<1%)。KMT2A重排白血病定义为KMT2A 基因染色体易位或倒位,导致产生融合蛋白并驱动白血病发生。在小鼠模型中观察到基因敲除 Men1 可预防 KMT2A 重排白血病,表明 MLL 融合蛋白与 menin 的直接相互作用对于白血病发生至关重要。从2005年开始的这一观察结果刺激了小分子 menin 抑制剂的开发,2012年首次发表研究强调了该策略的巨大潜力。重要的是,2016年还描述了 NPM1 突变 AML 细胞依赖于 menin 与野生型 KMT2A 蛋白之间的相互作用,将从而 menin 抑制剂的治疗潜力拓宽到另一种更常见的 AML 亚型。
Menin抑制剂
对 menin 在白血病发生中作用的认识提高,加上药物发现技术的最新进展,使高选择性小分子的开发成为可能。高通量筛选和结构生物学技术通过特异性靶向 menin 表面的疏水口袋,促进了能够有效抑制 menin-KMT2A 相互作用的化合物(即menin抑制剂)的鉴定和优化。
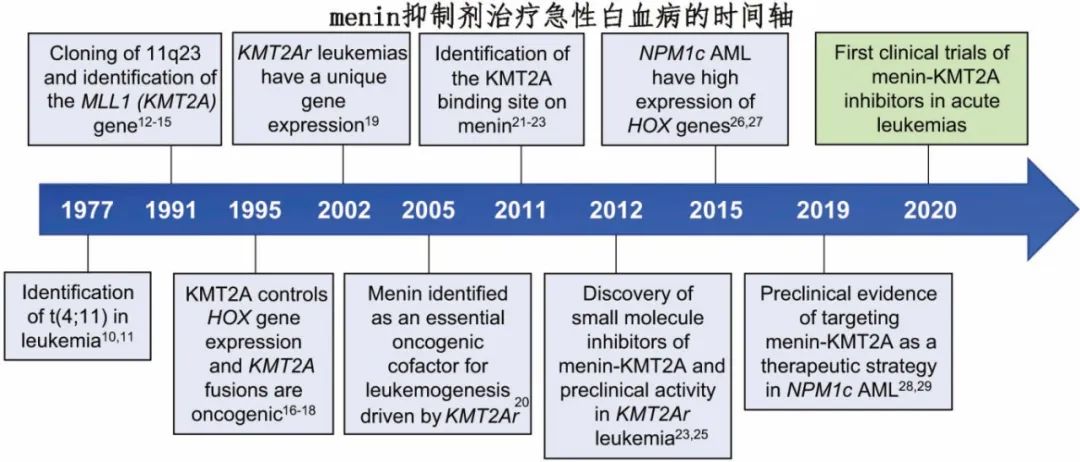
在发现menin-KNMT2A 相互作用可作为MLL 重排白血病的治疗靶点后,开展了新型 menin-KMT2A 相互作用抑制剂的开发,并证明 menin-KMT2A 抑制剂对 NPM1 突变AML 也有效。最近报道了具有改善药物样特性的 menin 抑制剂对两种 AML 亚型的作用。menin 抑制剂 VTP50469 在体内侵袭性患者来源的异种移植模型中可诱导 KMT2A重排和 NPM1 突变 AML 长期缓解。
目前已有1种menin 抑制剂上市,即SNDX-5613(revumenib) ,其他6种 menin 抑制剂也正处于 AML 治疗的不同临床阶段: KO-539(ziftomenib)、JNJ-75276617(bleximenib)、DSP-5336、DS-1594、BN104和BMF-219。表1总结了关于疗效和安全性的主要数据。
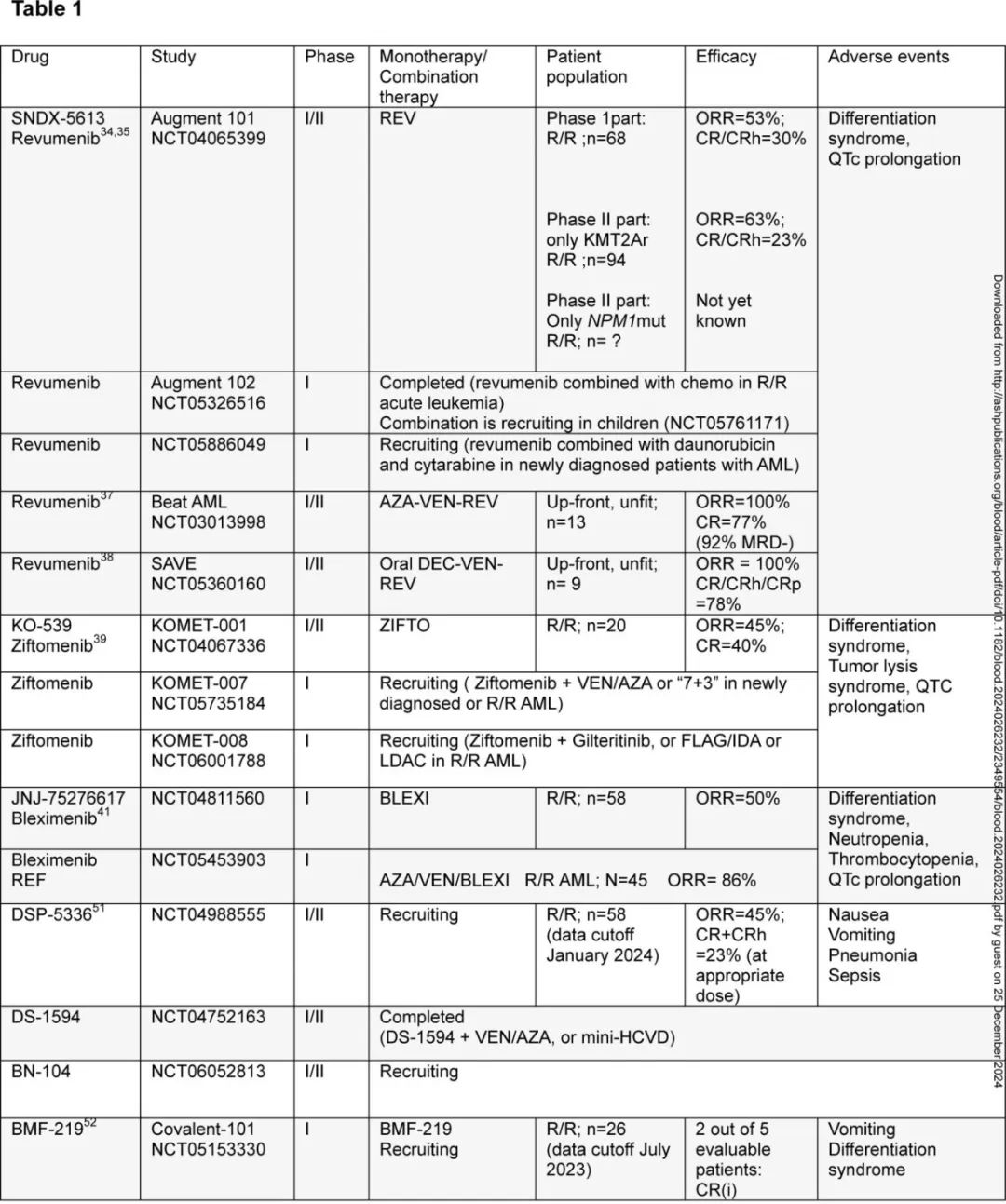
在复发性和难治性 (R/R) 急性白血病患者中使用revumenib的首次人体 I 期部分 (AUGMENT-101) 的结果已有报告 (NCT04065399)。在一个由68例患者(中位年龄42岁,中位既往治疗4线,46%接受过异基因移植)组成的强化预治疗队列中,68%的患者携带 KMT2A 重排,21%的患者携带突变NPM1,确定了 revumenib 的推荐 II 期剂量。≥3级治疗相关不良事件发生率较低,无症状性 QTc 延长是唯一的剂量限制性毒性。口服 revumenib 单药治疗的总缓解率为53%(CR/CRh为30%)。近期JCO报告了纳入94例重排 KMT2A 患者的 AUGMENT-101 试验 II 期部分的结果。≥3级不良事件包括发热性中性粒细胞减少症 (37%)、分化综合征 (16%) 和 QTc 间期延长 (13%)。在57例疗效可评价患者中,CR+CRh率为23%,总缓解率为63%(其中68%为MRD阴性)。NPM1突变患者的 AUGMENT-101 试验的 II 期部分结果值得期待。
revumenib在 R/R 白血病中有前景的安全性和疗效数据以及 menin 抑制剂与维奈克拉联用时有前景的临床前数据推动了研究的启动,以评估 revumenib 联合强化疗治疗fit患者中的价值,或联合去甲基化药物和维奈克拉治疗unfit患者中的价值。Beat AML试验在阿扎胞苷和维奈克拉基础上加用revumenib,SAVE试验在未治疗患者的地西他滨/cedazuridine 和维奈克拉基础上加用revumenib,均报告了非常有前景的结果,尽管患者数量较少(两项研究均显示100%缓解率)。
KOMET-001试验 (n=20) 评估 R/R AML 患者接受 ziftomenib 治疗的疗效,显示出可控的安全性特征和令人鼓舞的疗效,CR率为40%,总缓解率为45%。正在进行的I期 KOMET-008 试验正在研究 ziftomenib 联合吉瑞替尼、FLAG-IDA(氟达拉滨、阿糖胞苷、G-CSF和伊达比星)或低剂量阿糖胞苷治疗 R/R NPM1 突变或 KMT2A 重排 AML 患者。
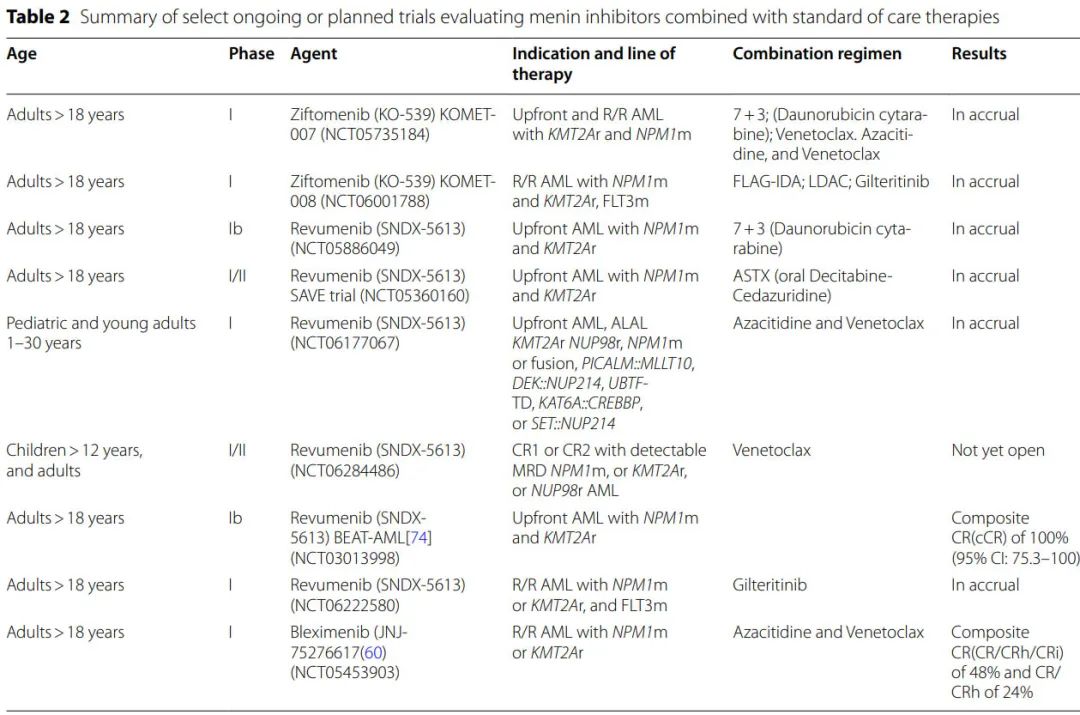
revumenib和 ziftomenib 都获得了美国FDA)的突破性疗法认定。bleximenib的1期研究 (NCT04811560;n=58) 显示,不良事件可控,最高剂量水平的总缓解率为50%。bleximenib与阿扎胞苷和维奈克拉(n=45) 联合治疗 R/R AML 的 1B 期数据显示,50mg bid队列 (n=21) 的 ORR 为86%。
menin 抑制剂的安全性特征通常良好,大多数不良反应是管理和可逆。常见的副作用包括胃肠道症状、血细胞减少、QTc间期延长和分化综合征(revumenib的说明书有分化综合征的黑框警告)。重要的是,menin抑制剂无显著的off-target毒性,使其成为长期治疗的一种有前景的选择。长期安全性数据仍在收集中,但早期结果表明,menin抑制剂可以安全地长期给药。正在进行的研究进一步评价了menin 抑制剂与其他治疗(如化疗和靶向药物)联用的安全性和耐受性。
剩余问题和未来展望
耐药性的出现是癌症治疗中的常见挑战。menin-KMT2A 抑制剂的耐药机制见图1。在 CRISPR 诱变筛选和患者来源的异种移植模型中,以及在 AUGMENT-101 试验的患者 (38%) 中,发现 MEN1 突变可减弱 revumenib-menin 结合,但不影响 menin-KMT2A 相互作用。未来的研究应阐明与 menin 抑制剂联合治疗是否会导致 MEN1 突变比例降低。在某些情况下,在无 MEN1 突变的患者中也观察到耐药性。对 menin-KMT2A 抑制剂的持久敏感性依赖于非经典多梳 (PRC1.1) 介导的靶基因抑制。当 menin-KMT2A 介导的 HOXA 和 MEIS1 靶基因表达缺失时,需要表观遗传抑制机制将这些位点维持在闭合和抑制构象中。因此,抑制性非经典PRC1.1信号的缺失也可能对 menin-KMT2A 抑制剂产生耐药性。menin-KMT2A抑制剂的疗效不仅依赖于抑制自我更新基因表达程序,而且还需要转向 KMT2C/D 介导的髓样分化基因表达程序的诱导。此外,在 menin-KMT2A 抑制后发现 MHC I 类和 II 类分子上调,表明白血病原始细胞免疫逃避的丧失也可能影响menin 抑制剂的疗效。最后,虽然携带 NPM1 突变或 KMT2A 重排AML 患者可获益于 menin 抑制剂,但这些基因亚组中也有患者对 menin-KMT2A 抑制的反应较差,了解这种敏感性变化的潜在机制非常重要。反过来说,可能获益于 menin 抑制剂的 AML 患者可扩展至携带 NUP98 重排、UBTF串联重复白血病和 CEBPA 突变的患者。未来的研究需要优化选择可能从 menin 抑制中获益最大的患者,并开发绕过或预防耐药的策略。
总结
Menin 抑制剂已成为 AML 的一类有前景的新型靶向治疗药物,有望改善 KMT2A 重排和 NPM1 突变 AML 患者的结局。通过破坏 menin 的致癌功能,menin抑制可以有效地靶向白血病发生的潜在驱动因素,并提供持久的缓解。随着临床开发的进展,menin抑制剂有可能改变 AML 的治疗前景,并改善这种具有挑战性疾病患者的预后。未来的研究应集中在优化联合治疗方案中 menin 抑制剂的使用,确定缓解的生物标志物,并探索其在其他 AML 亚型和其他血液恶性肿瘤中的疗效。
参考文献
1.Gerwin A Huls, Carolien M Woolthuis, Jan Jacob Schuringa; Menin inhibitors in the treatment of acute myeloid leukemia. Blood 2024; blood.2024026232. doi: https://doi.org/10.1182/blood.2024026232
2.Menin Inhibitors Trigger Leukemia Remissions. Cancer Discov 2023; https://doi.org/10.1158/2159-8290.CD-ND2023-0019
3.Issa, G.C., Ravandi, F., DiNardo, C.D. et al. Therapeutic implications of menin inhibition in acute leukemias. Leukemia 35, 2482–2495 (2021). https://doi.org/10.1038/s41375-021-01309-y
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#急性髓系白血病# #Menin抑制剂#
7