【协和医学杂志】以抗阻运动为主的运动处方对超重和肥胖成年人群糖脂代谢影响的Meta分析
2025-03-28 协和医学杂志 协和医学杂志 发表于陕西省
本研究旨在通过Meta分析,探讨不同RT模式对超重或肥胖成年人群糖脂代谢的改善效果,从而为临床制订更加个性化的训练方案提供科学依据。
随着人们生活水平和方式的逐渐转变,超重和肥胖在全球人口中的比例逐年增加,与其相关的多种慢性代谢性疾病的发生率也随之上升[1]。肥胖已被世界卫生组织列为加重疾病负担的十大危险因素之一。国内研究指出,超重和肥胖是糖尿病、血脂异常、高血压和代谢综合征的独立危险因素[2]。
一项针对10 000名体检对象的观察性研究结果显示,根据空腹血糖(FBG)检测结果,被诊断为糖尿病前期和糖尿病的患者占比分别为23.3%和7.0%,而该占比在肥胖人群中分别上升至33.3%和11.0%[3]。Bays等[4]研究指出,血脂异常患者群体中,体质量指数(BMI)超过30 kg/m2的患者人数显著增多。
运动减重方式主要包括抗阻运动(RT)和有氧运动(AT),二者均对糖脂代谢具有显著影响[5]。研究指出,RT和RT-AT混合运动(COM)模式的降糖效果更显著,且COM模式有利于改善单一运动带来的单调性[6]。目前,关于不同RT方案对超重或肥胖成年人群糖脂代谢影响的循证医学研究仍不足。本研究旨在通过Meta分析,探讨不同RT模式对超重或肥胖成年人群糖脂代谢的改善效果,从而为临床制订更加个性化的训练方案提供科学依据。
1.资料与方法
1.1 文献检索
采用医学主题词加自由词的方式检索PubMed、Cochrane Library、EmBase、Web of Science、中国知网、万方数据知识服务平台、维普中文科技期刊全文数据库,检索时间为建库至2023年12月31日,并根据检索出文献所引用的参考文献,手动补充未被纳入的相关文献。
中文检索词为“抗阻运动” “成人” “超重” “肥胖” “空腹血糖” “餐后血糖” “血糖” “糖化血红蛋白” “低血糖” “胰岛素抵抗”;英文检索词为“resistance trainin” “resistance program” “strength training” “adult” “overweight” “obesity” “fasting blood glucose” “FBG” “2 hour plasma glucose” “2h PBG” “glucose blood level” “glycosylated hemoglobin” “HbA1c” “hypoglycemia” “HOMA-IR”。
根据数据库具体要求对主要检索词进行扩展检索,如“空腹血糖” “餐后血糖” “血糖” “糖化血红蛋白” “低血糖” “胰岛素抵抗”属于并列关系,用“or”连接;“抗阻运动” “成人” “超重” “肥胖”属于限定关系,用“and”连接。
1.2 纳入与排除标准
按照参与者、干预、比较、结果和研究设计(PICOS)原则制订标准。
纳入标准:(1)研究对象为超重或肥胖成年人群,超重或肥胖的划分基于BMI、体脂率或腹围的相关标准;(2)干预措施如单纯RT或RT结合AT/耐力运动的COM模式,对照组不包含RT,可以是不运动或其他运动形式;涉及运动干预的试验或对照组有详细的RT方案;(3)研究类型为随机对照试验;(4)结局指标包含FBG、餐后2 h血糖、糖化血红蛋白(HbA1c)、稳态模型评估的胰岛素抵抗指数(HOMA-IR)中的至少1种。
排除标准:(1)观察对象处于移植术后、肿瘤放化疗期间,患有自身免疫性疾病;(2)会议摘要、学位论文;(3)涉嫌重复发表、数据缺失、无法获取全文信息的研究。
1.3 文献筛选及信息提取
所有文献均由2名研究员根据纳入与排除标准独立筛选,通过阅读题目、摘要、全文,最终确定符合标准的文献。运用Excel表格对文献数据进行提取。
提取数据包括:
|
1 |
一般资料,包括第一作者姓名、发表时间等; |
|
2 |
基线资料,包括参与者人数、年龄、身体状况等; |
|
3 |
试验组(含RT)和对照组(不含RT)运动方案,包括干预周期、运动方式、运动频率、运动时间等; |
|
4 |
结局指标,包括糖代谢指标(FBG、餐后2 h血糖、HbA1c、HOMA-IR)和脂代谢指标[低密度脂蛋白胆固醇(LDL-C)等]。 |
1.4 纳入研究的偏倚风险评价
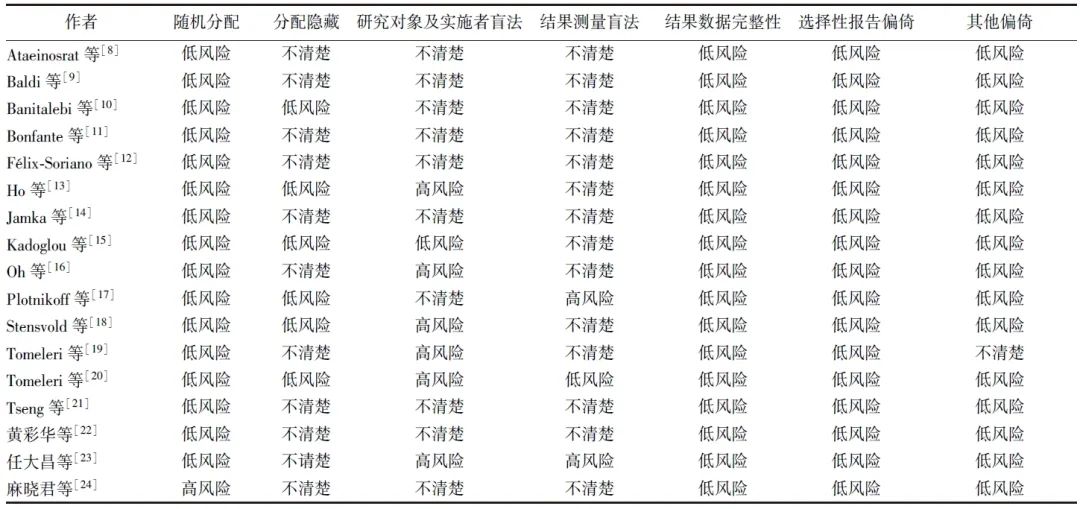
由2名研究员独立运用Cochrane系统评价手册偏倚风险评估工具[7]对纳入研究的偏倚风险进行评估。评估指标包括随机分配、分配隐藏、研究对象与实施者盲法、结果测量盲法、结果数据完整性、选择性报告、其他偏倚。由于运动干预很难实现参与者盲法,因此除对参与者盲法有详细说明的研究外,未进行明确说明的研究,均被划分为“研究对象、实施者盲法”高风险范畴。
1.5 统计学方法
采用RevMan 5.3软件进行数据分析。连续性变量以标准化均数差(SMD)作为效应指标,各效应量使用95%置信区间(95% CI)表示。纳入研究的异质性采用χ2检验,根据I2定量判断异质性情况。若各研究间无异质性或异质性较小(I2≤50%,P≥0.1),则采用固定效应模型合并分析;对于异质性较大的研究,采用敏感性分析探讨异质性来源,有针对性地进行亚组分析。依据青年(18~40岁)、中年(41~59岁)、老年(≥60岁)将患者划分为不同年龄亚组,排除年龄段划分不清的研究。发表偏倚情况采用漏斗法进行分析。以P≤0.05为差异具有统计学意义。
2.结果
2.1 文献检索结果
共检索到1014篇文献,其中中文数据库文献51篇,英文数据库文献963篇。根据纳入和排除标准筛选后最终纳入文献17篇[8-24],包括英文文献14篇,中文文献3篇。文章筛选流程见图1。
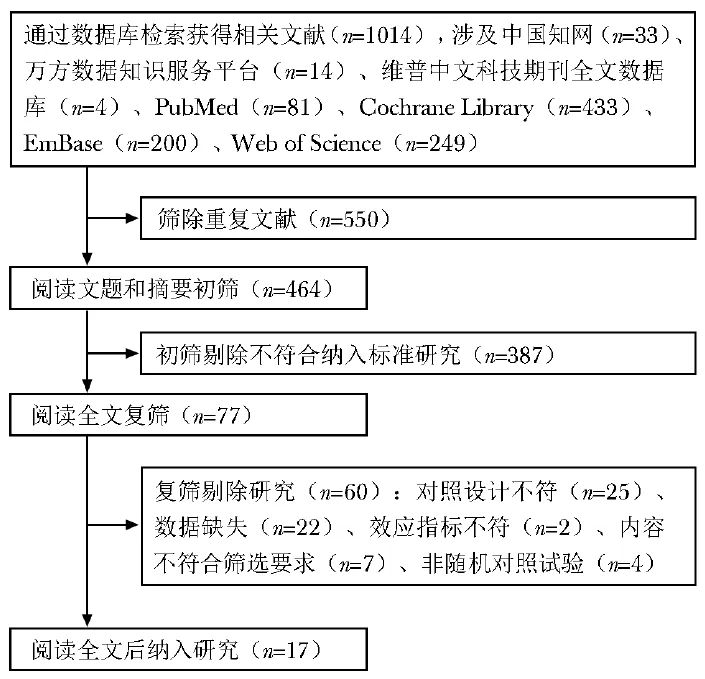
图1 文献筛选流程
2.2 纳入文献基本特征
纳入的17项研究共包含700例研究对象,其中含RT的试验组351例,不含RT的对照组349例。
纳入文献的试验设计分为3种:
|
1 |
试验组仅进行RT,对照组不进行任何形式体育运动(记为Con),2组运动形式记为RT vs. Con; |
|
2 |
试验组采用RT和AT的COM模式(记为COM)进行干预,对照组不进行任何形式的体育运动(记为Con),2组运动形式记为COM vs. Con; |
|
3 |
试验组采用COM进行干预,对照组仅进行AT,2组运动形式记为COM vs. AT。 |
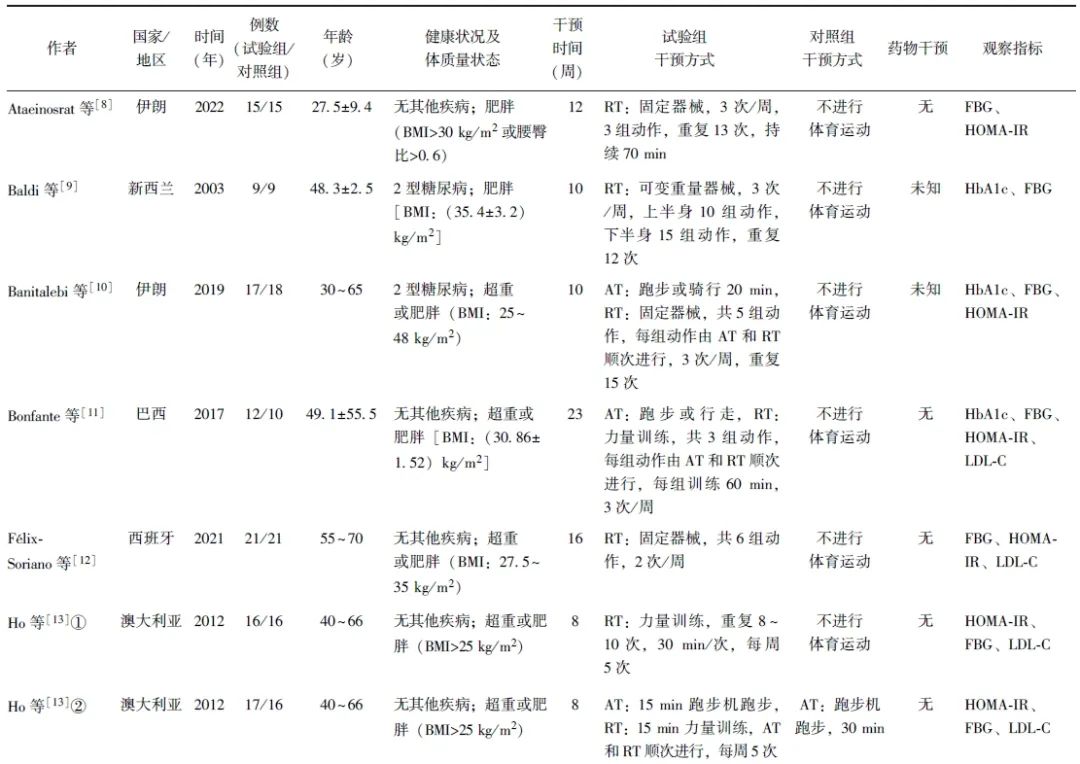
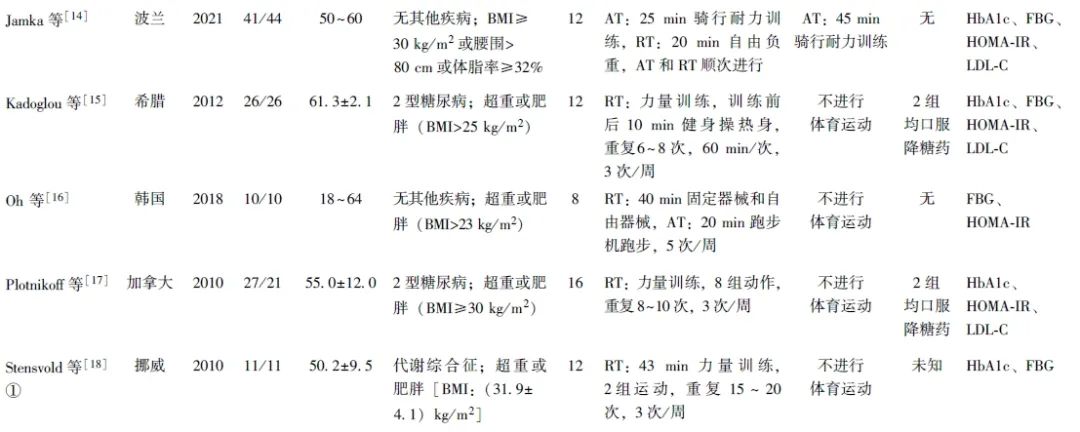
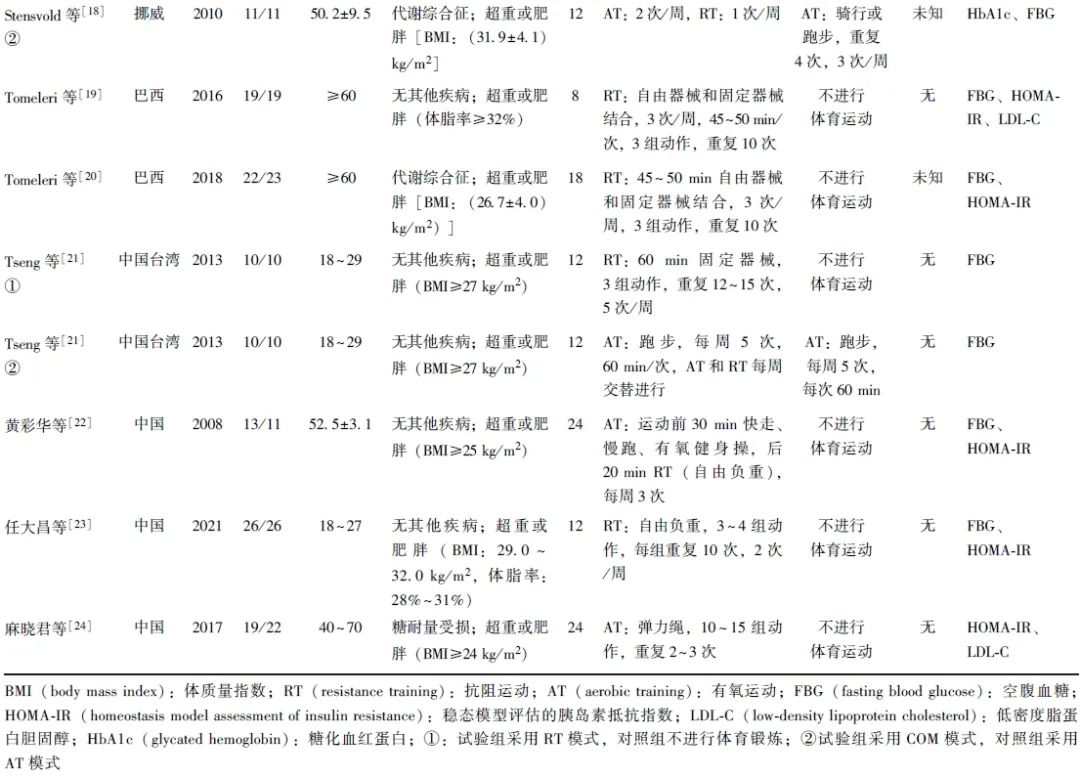
同一篇文献中2组不同运动方案,采用①和②标注。RT以自由负重和固定器械为主,AT以跑步、健身操为主。运动干预周期为8~24周,训练频率为2~5次/周,每次持续30~70 min。纳入文献基本特征见表1。
表1 纳入文献中RT对超重或肥胖成年人群糖脂代谢影响的基本特征分析
2.3 文献质量评价
采用随机分组对纳入的17项研究进行文献质量评价,所有研究均未发现其他偏倚,所有纳入研究的选择性偏倚均为低风险,其中6项研究[10,13,15,17-19]报告了分配隐藏,一项研究[15]对研究对象和实施者进行了盲法,一项研究[20]对结果测量者进行了盲法(图2、表2)。
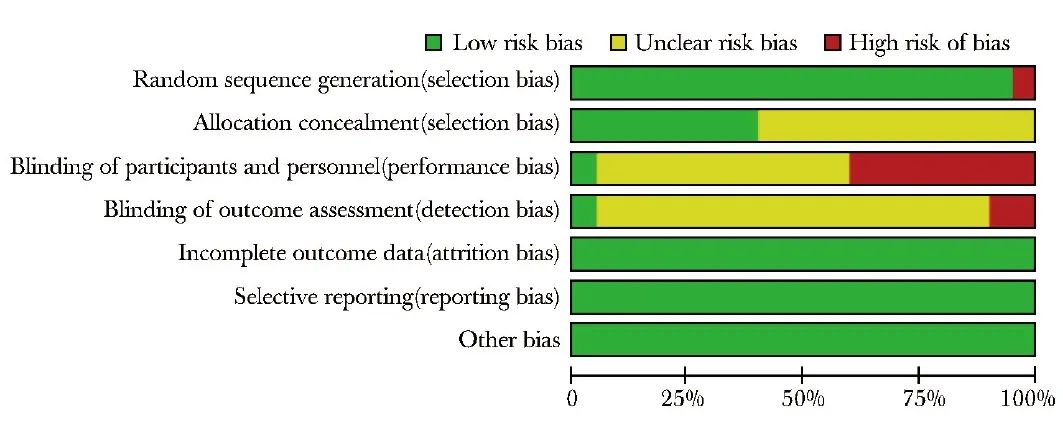
图2 纳入文献偏倚风险情况
表2 纳入文献的偏倚风险情况
2.4 文献的Meta分析结果
2.4.1 运动处方对于减重的效果分析
共纳入11项关于运动处方对于减重效果分析的文献,包含421例观察对象,其中试验组214例,对照组207例。异质性检验结果显示异质性较大(I2=59%,P=0.003),故采用随机效应模型进行数据合并。Meta分析结果显示,与对照组比较,试验组超重和肥胖人群的BMI显著降低[SMD(95% CI)=-0.36(-0.56~-0.16),P<0.001](图3)。

图3 试验组与对照组BMI比较的森林图
BMI、①、②:同表1
根据试验设计、运动周期、人群特征进行亚组分析。RT vs. Con亚组相较于对照组,RT运动可显著降低BMI[SMD(95% CI)= -0.42(-0.81, -0.04), P=0.030],且异质性降低。不同年龄段分组中,中年人群的试验组BMI较对照组显著下降[SMD(95% CI)= -0.41(-0.82, 0),P=0.050]。在亚洲人种中,试验组BMI 水平异质性显著降低(I2=21%,P=0.270),但较对照组的差异无统计学意义[SMD(95% CI)= -0.33(-0.68, 0.02), P=0.060]。
2.4.2 运动处方对代谢指标的影响分析
(1)运动处方对HbA1c水平的影响
共纳入7项研究[9-11,14-15,17-18],304例观察对象,其中试验组154例,对照组150例。异质性检验结果显示异质性较小(I2=40%,P=0.110),故采用固定效应模型进行数据合并。Meta分析结果显示,与对照组比较,试验组超重和肥胖人群的HbA1c水平显著降低[SMD(95% CI)=-0.30(-0.53~-0.07),P=0.010](图4)。
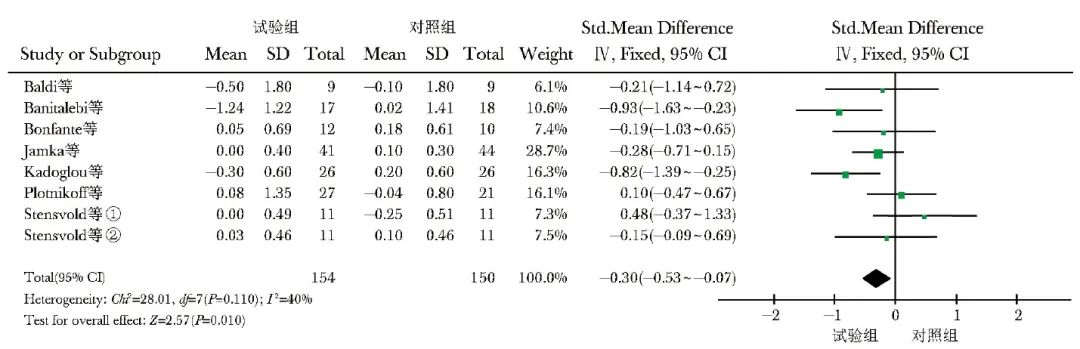
图4 试验组与对照组HbA1c水平比较的森林图
HbAlc、①、②:同表1
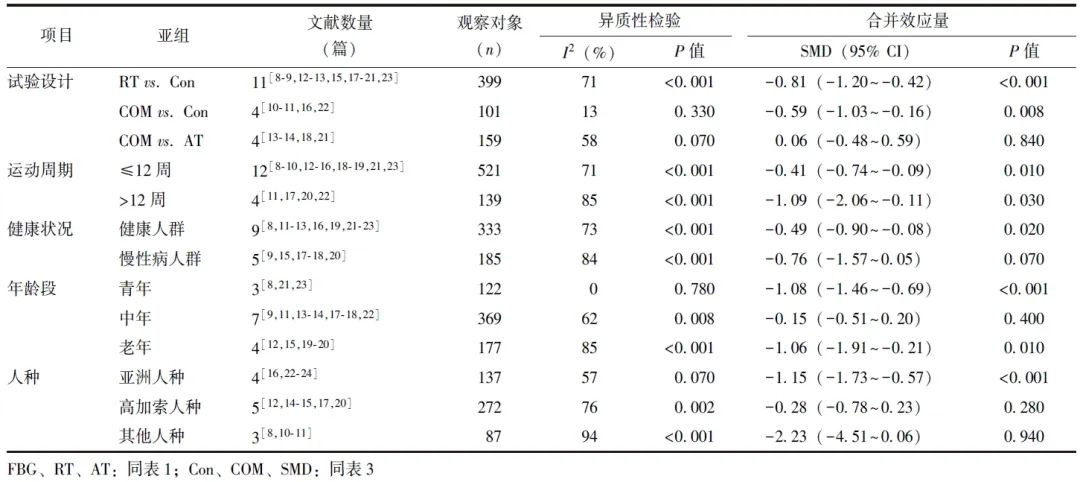
根据试验设计、运动周期、人群特征进行亚组分析。RT vs. Con亚组和COM vs. AT亚组分析结果显示,试验组与对照组HbA1c水平比较,差异无统计学意义(P>0.05);COM vs. Con亚组分析结果显示,试验组HbA1c水平低于对照组。运动周期≤12周时,试验组HbA1c水平低于对照组,差异有统计学意义[SMD(95% CI)=-0.40(-0.66~-0.14),P=0.003];运动周期>12周时,2组HbA1c水平差异无统计学意义(P>0.05)。
试验组与对照组中的健康人群和慢性病人群的HbA1c水平差异均无统计学意义(P>0.05)(表3)。由于研究人数较少,故不针对人种和年龄进行亚组分析。
表3 试验组和对照组HbA1c水平的亚组分析
(2)运动处方对FBG水平的影响
共纳入16项研究[8-23],660例观察对象,其中试验组333例,对照组327例。异质性检验显示有较大异质性(I2=74%,P<0.001),故选用随机效应模型进行数据合并,结果显示,与不含RT的对照组比较,试验组中超重和肥胖人群的FBG水平显著降低[SMD(95% CI)=-0.58(-0.90~-0.26),P<0.001],见图5。
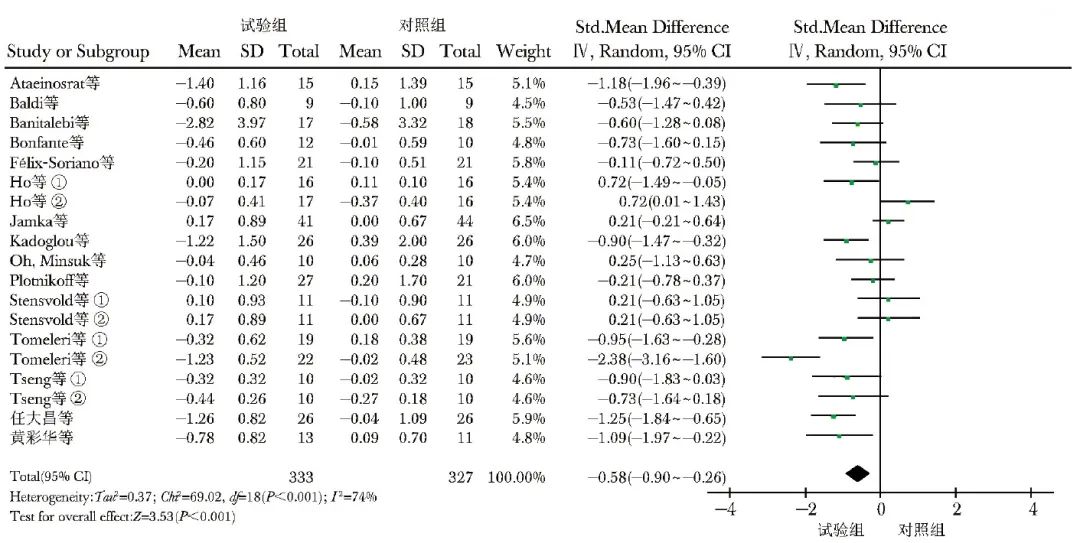
图5 试验组与对照组FBG水平比较的森林图
FBG、①、②:同表1
COM vs. AT亚组分析结果显示,含COM的试验组与含AT的对照组在FBG水平方面差异无统计学意义[SMD(95% CI)=0.06(-0.48~0.59),P=0.840];而采用COM模式和单纯RT的试验组与对照组FBG水平比较,差异均有统计学意义[SMD(95% CI)=-0.59(-1.03~-0.16),P=0.008;SMD(95%)=-0.81(-1.20~-0.42),P<0.001]。
在亚洲人种中,试验组FBG水平低于对照组,差异有统计学意义[SMD(95% CI)=-0.83(-1.29~-0.38),P<0.001];而在高加索人种中,试验组FBG水平与对照组差异无统计学意义(P>0.05)。运动周期≤12周时,试验组的FBG水平低于对照组,差异有统计学意义[SMD(95% CI)=-0.41(-0.74~-0.09),P=0.010];运动周期>12周时,2组FBG水平差异有统计学意义[SMD(95% CI)=-1.09(-2.06~-0.11),P=0.020]。
在健康人群中,试验组FBG水平低于对照组,差异有统计学意意义[SMD(95% CI)=-0.49 (-0.90~-0.08),P=0.020];在慢性病人群中,2组FBG水平差异无统计学意义(P>0.05)。试验组青年人群的FBG水平显著下降 [SMD(95%)=-1.08(-1.46~-0.69),P<0.001],老年患者FBG水平也显著下降[SMD(95%)=-1.06(-1.91~-0.21),P=0.010],中年患者下降程度不显著(表4)。
表4 试验组和对照组FBG水平的亚组分析
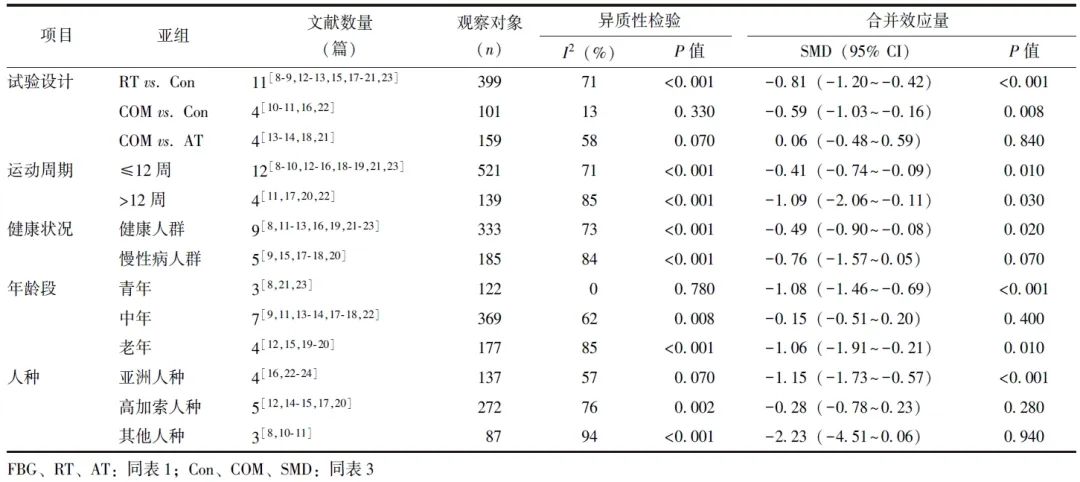
(3)运动处方对HOMA-IR水平的影响
共纳入12项研究[8,10-12,14-17,20,22-24],495例观察对象,其中试验组249例,对照组246例。异质性检验显示有较大异质性(I2=86%,P<0.001),选用随机效应模型进行数据合并,结果显示,与对照组比较,RT可显著降低超重和肥胖人群的HOMA-IR水平[SMD(95% CI)=-0.90(-1.42~-0.38),P<0.001],见图6。
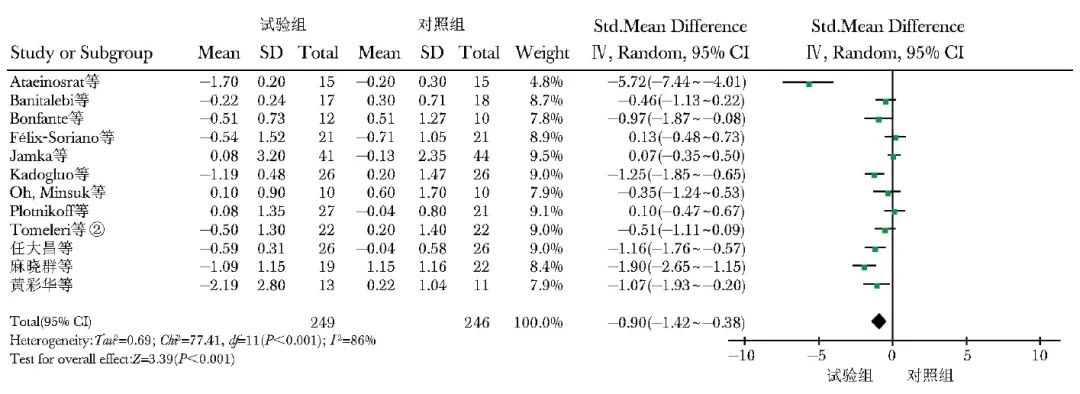
图6 试验组与对照组HOMA-IR水平比较的森林图
HOMA-IR、②:同表1
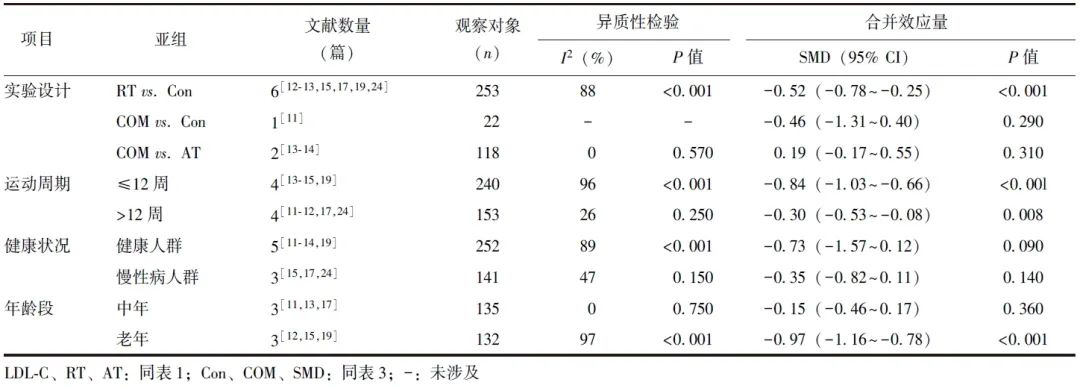
RT vs. Con和COM vs. Con亚组分析结果显示,试验组HOMA-IR水平均显著低于对照组,差异有统计学意义[SMD(95% CI)=-1.24(-2.07~-0.47),P=0.003;SMD(95% CI)=-0.67(-1.08~-0.27),P=0.001]。与对照组比较,试验组亚洲人种HOMA-IR显著降低,差异有统计学意义[SMD(95% CI)=-1.15(-1.73~-0.57),P<0.001]。健康人群和慢性病人群中,试验组HOMA-IR水平显著低于对照组,差异有统计学意义[SMD(95% CI)=-1.06(-1.89~-0.22),P=0.010;SMD(95% CI)=-0.78(-1.44~-0.12),P=0.020]。运动周期≤12周和>12周时,试验组HOMA-IR水平均显著低于对照组,差异具有统计学意义[SMD(95% CI)=-0.98(-1.89~-0.08),P=0.030;SMD(95% CI)=-0.89(-1.47~-0.31),P=0.002]。试验组与对照组不同年龄段患者HOMA-IR水平差异无统计学意义(P>0.05)(表5)。
表5 试验组和对照组HOMA-IR水平的亚组分析
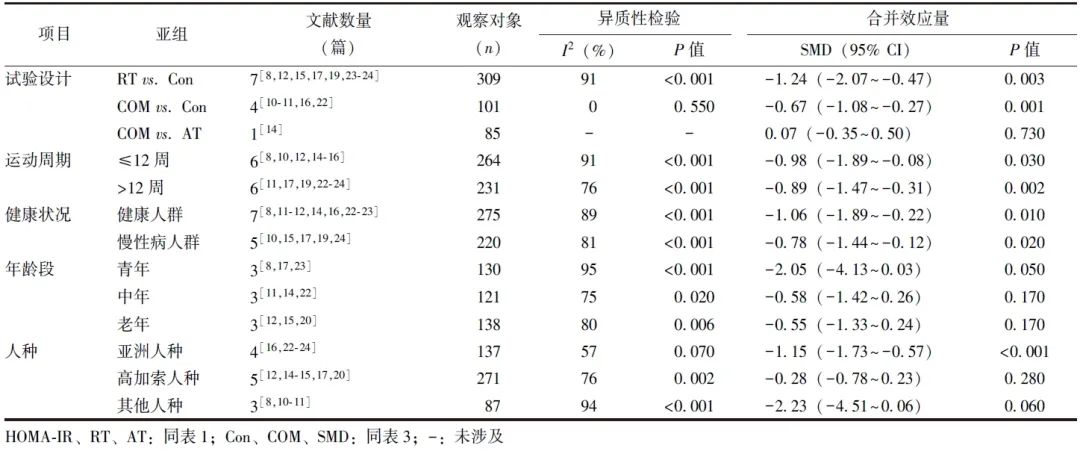
(4)运动处方对LDL-C水平的影响
共纳入8项研究[11-15,17,19,24],393例观察对象,其中试验组198例,对照组195例。异质性检验显示各研究间异质性较大(I2=84%,P<0.001),选用随机效应模型进行数据合并,结果显示,与不含RT的对照组比较,含RT的试验组超重和肥胖人群的LDL-C水平显著降低[SMD(95% CI)=-0.56(-1.10~-0.03),P<0.001]。敏感性分析剔除2项研究[14,19]后(I2=0,P=0.520),2组随机效应模型合并效应量差异有统计学意义[SMD(95% CI)=-0.28(-0.53~-0.04),P=0.020],结果具有稳健性(图7)。
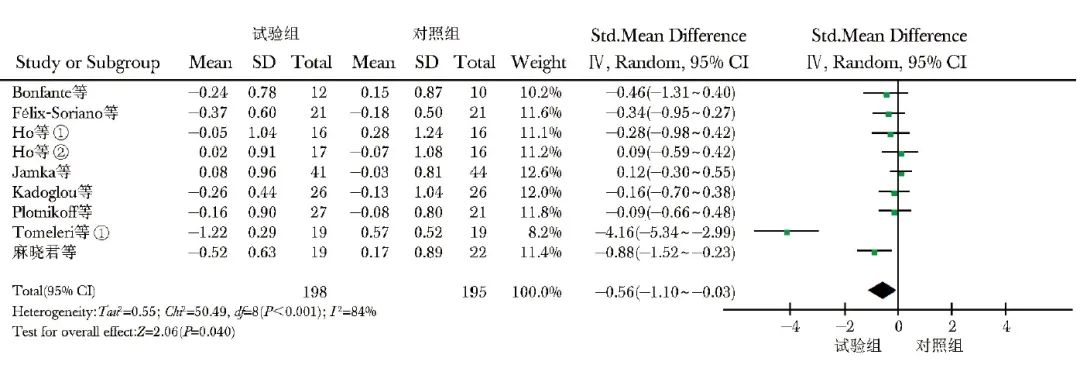
图7 试验组与对照组LDL-C水平比较的森林图
LDL-C、①、②:同表1
追溯原文未找到异质性来源,进一步进行亚组分析。在亚组分析中,RT vs. Con亚组共253例,显示出较大的异质性(I2=88%,P<0.001);敏感性分析去掉1例[19]后I2=0,固定效应模型合并效应量,差异有统计学意义[SMD(95% CI)=-0.28(-0.53~-0.04),P=0.020],说明结果具有稳健性。
运动周期>12周时,试验组LDL-C水平显著低于对照组,差异有统计学意义[SMD(95% CI)=-0.30(-0.53~-0.08),P=0.008];运动周期≤12周时,亚组分析的异质性较大(I2=90%,P<0.001)。敏感性分析剔除1例[19]后,差异仍无统计学意义[I2=0,P=0.71;SMD(95% CI)=-0.02(-0.27~0.23),P=0.900]。试验组与对照组的健康人群和慢性病人群、中年人群LDL-C水平比较,差异无统计学意义(P>0.05)(表6)。剔除1例[19]后同样差异无统计学意义(P>0.05)。
表6 试验组和对照组LDL-C水平的亚组分析
2.4.3 发表偏倚
观察HbA1c、FBG、HOMA-IR、LDL-C的合并结果漏斗图发现,包含以上指标的研究较均匀地分布于竖直虚线两侧,个别研究在两侧虚线外侧(图8),提示研究有较大异质性,需要通过敏感性分析、亚组分析对潜在异质性进行进一步探讨。
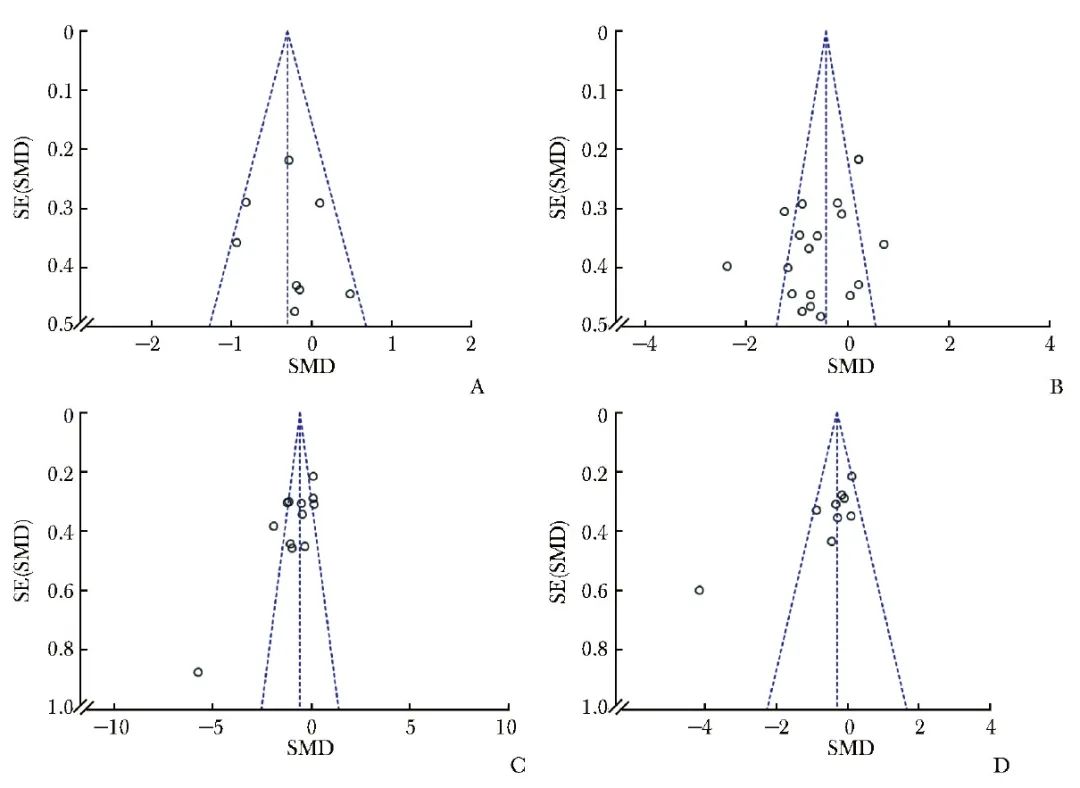
图8 糖脂代谢效应的合并结果漏斗图
A.HbAlc; B.FBG; C.HOMA-IR; D.LDL-C
HbA1c、FBG、HOMA-IR、LDL-C:同表1;SMD:同表3
2.4.4 不良反应
全部研究干预期间均未发生不良事件,包括运动相关肌肉损伤、后背疼痛、关节炎,以及糖脂代谢相关的低血糖、血脂紊乱等。总体上,RT相关运动处方较为安全。
3.讨论
肥胖指体内脂肪聚集过多,内脏脂肪增多是导致肥胖相关代谢性疾病的主要原因,与糖耐量受损、高血糖、高脂血症、代谢综合征等代谢性疾病和心血管疾病高度相关[23]。对于肥胖的治疗,临床上多以控制饮食和增加运动为主要方案[25]。规律运动可改善骨骼肌细胞代谢,显著降低血糖,且运动的降血糖作用与改变脂肪代谢是相互独立的机制[26]。运动引起的肌肉伸缩可促进葡萄糖从细胞内转运至细胞膜,并增加胰岛素受体总量,从而增加骨骼肌细胞对葡萄糖的摄取量,提高葡萄糖储存率、利用率和消耗率[27-28]。此外,运动可促进骨骼肌细胞分泌白细胞介素-6,从而增强骨骼肌细胞和脂肪细胞对胰岛素的敏感性[29]。
本研究结果显示,RT对超重或肥胖成年人群的HbA1c、FBG和HOMA-IR等糖脂代谢指标水平有改善作用,与其他研究一致[30-31]。亚组分析结果发现,3种实验设计中,与对照组比较,包含COM模式的试验组HbA1c、FBG、HOMA-IR水平均显著降低,说明COM模式控制血糖的效果更佳。目前已有研究提出,AT与RT结合的方式最适合改善代谢综合征[32],但本研究含单纯RT的试验组与对照组比较,也表现出较好的降糖效果,原因可能在于RT能在肌肉收缩的同时诱发肌细胞内部形成低氧环境,而AT不能促进细胞内形成低氧环境,因此RT在改善血糖方面效果更显著[28]。
本研究结果显示,8~12周的运动干预能显著降低超重或肥胖成年人群的HbA1c水平。Eriksson等[33]研究结果显示,为期3个月的RT可显著降低HbA1c水平。但本研究中运动周期>12周的试验组与对照组HbA1c水平比较未显著下降,可能与亚组分析中样本量不足、存在人群特征和药物干预等异质性因素有关。
在健康人群和慢性病人群中,3个糖代谢指标差异不显著,但与健康人群比较,进行RT的慢性病人群获益更多[4],可能原因:有慢性病的肥胖患者在无药物控制的情况下,仅通过运动调节的能力较无基础疾病的人群差。在不同年龄段人群中,青年人的FBG水平降低程度最为显著;在不同人种中,抗阻动动对亚裔人种的血糖调节效果异质性最低。
此外,研究指出,RT比AT能更显著地提升基础代谢率,改善胰岛素抵抗,进而更有效地控制机体血糖,并有效增加骨密度和肌肉容积,而AT在降低血脂和血压等方面更有优势[34-35]。本研究纳入的17篇文献中,Bonfante等[11]统计了试验组和对照组运动前后静息代谢率(RMR),2组运动后分别提高了14.1%和7.6%,而其余研究均未统计RMR。
血脂方面,本研究表明,进行长期RT的群体和老年群体在LDL-C水平降低方面较显著。以上结果结合既往研究可知,较短周期的COM模式或单纯RT有利于显著调节糖代谢指标,而较长周期的RT和/或AT对于脂代谢的调节可能更有利。
本研究也存在不足之处:(1)运动干预很难实现对参与者的盲法,可能造成结果偏倚;(2)运动强度与时间难以统一量化;(3)符合标准的研究数量仍显不足,亚组分析时部分亚组研究例数较少,需纳入更多高质量、多中心、大样本研究来进一步验证结果。
综上,本研究通过Meta分析,结果显示,RT可改善超重/肥胖人群的糖脂代谢,为临床制订运动干预方案提供了参考和依据。
参考文献
[1]曾强.预防超重科学减肥[J].中华健康管理学杂志,2013,7(1):2-3.
[2]张雷,崔红月,刘爱萍,等.高血压、糖尿病、血脂异常及代谢综合征与超重和肥胖关系[J].中国慢性病预防与控制,2009,17(6):561-563.
[3]邢燕,叶山东,陈燕,等.超重和肥胖与糖代谢异常关系的临床研究[J].中华健康管理学杂志,2014,8(2):135-136.
[4]Bays H E,Chapman R H,Grandy S,et al.The relationship of body mass index to diabetes mellitus,hypertension and dyslipidaemia:comparison of data from two national surveys[J].Int J Clin Pract,2007,61(5):737-747.
[5]Codella R,Ialacqua M,Terruzzi I,et al.May the force be with you:why resistance training is essential for subjects with type 2 diabetes mellitus without complications[J].Endocrine,2018,62(1):14-25.
[6]Sigal R J,Kenny G P,Boulé N G,et al.Effects of aerobic training,resistance training,or both on glycemic control in type 2 diabetes:a randomized trial[J].Ann Intern Med,2007,147(6):357-369.
[7]Higgins J P T,Altman D G,Gtzsche P C,et al.The cochrane collaboration's tool for assessing risk of bias in randomised trials[J].BMJ,2011,343:d5928.
[8]Ataeinosrat A,Saeidi A,Abednatanzi H,et al.Intensity dependent effects of interval resistance training on myokines and cardiovascular risk factors in males with obesity[J].Front Endocrinol (Lausanne),2022,13:895512.
[9]Baldi J C,Snowling N.Resistance training improves glycaemic control in obese type 2 diabetic men[J].Int J Sports Med,2003,24(6):419-423.
[10]Banitalebi E,Kazemi A,Faramarzi M,et al.Effects of sprint interval or combined aerobic and resistance training on myokines in overweight women with type 2 diabetes:a randomized controlled trial[J].Life Sci,2019,217:101-109.
[11]Bonfante I L P,Chacon-Mikahil M P T,Brunelli D T,et al.Combined training,FNDC5/irisin levels and metabolic markers in obese men:a randomised controlled trial[J].Eur J Sport Sci,2017,17(5):629-637.
[12]Félix-Soriano E,Martínez-Gayo A,Cobo M J,et al.Effects of DHA-rich n-3 fatty acid supplementation and/or resistance training on body composition and cardiometabolic biomarkers in overweight and obese Post-Menopausal women[J].Nutrients,2021,13(7):2465.
[13]Ho S S,Dhaliwal S S,Hills A P,et al.The effect of 12 weeks of aerobic,resistance or combination exercise training on cardiovascular risk factors in the overweight and obese in a randomized trial[J].BMC Public Health,2012,12:704.
[14]Jamka M,Mdry E,Krzyz·anowska-Jankowska P,et al.The effect of endurance and endurance-strength training on body composition and cardiometabolic markers in abdo-minally obese women:a randomised trial[J].Sci Rep,2021,11(1):12339.
[15]Kadoglou N P E,Fotiadis G,Athanasiadou Z,et al.The effects of resistance training on ApoB/ApoA-I ratio,Lp(a) and inflammatory markers in patients with type 2 diabetes[J].Endocrine,2012,42(3):561-569.
[16]Oh M,Kim S,An K Y,et al.Effects of alternate day calorie restriction and exercise on cardio-metabolic risk factors in overweight and obese adults:an exploratory randomized controlled study[J].BMC Public Health,2018,18(1):1124.
[17]Plotnikoff R C,Eves N,Jung M,et al.Multicomponent,home-based resistance training for obese adults with type 2 diabetes:a randomized controlled trial[J].Int J Obes (Lond),2010,34(12):1733-1741.
[18]Stensvold D,Tjønna A E,Skaug E A,et al.Strength training versus aerobic interval training to modify risk factors of metabolic syndrome[J].J Appl Physiol (1985),2010,108(4):804-810.
[19]Tomeleri C M,Ribeiro A S,Souza M F,et al.Resistance training improves inflammatory level,lipid and glycemic profiles in obese older women:a randomized controlled trial[J].Exp Gerontol,2016,84:80-87.
[20]Tomeleri C M,Souza M F,Burini R C,et al.Resistance training reduces metabolic syndrome and inflammatory markers in older women:a randomized controlled trial[J].J Diabetes,2018,10(4):328-337.
[21]Tseng M L,Ho C C,Chen S C,et al.A simple method for increasing levels of high-density lipoprotein cholesterol:a pilot study of combination aerobic- and resistance-exercise training[J].Int J Sport Nutr Exerc Metab,2013,23(3):271-281.
[22]黄彩华,林建新,高松龄,等.24周运动后肥胖绝经妇女血清脂联素水平及胰岛素抵抗的变化[J].中国运动医学杂志,2008,27(1):48-51.
[23]任大昌,李爱萍,夏淑静,等.低负荷抗阻训练中运动肌血流限制对肥胖者的身体成分及胰岛素敏感度的影响[J].中国医药科学,2021,11(4):151-154.
[24]麻晓君,戴霞,陆丽荣,等.中等强度有氧和抗阻运动对超重及肥胖的糖调节受损患者血脂及胰岛素抵抗的影响[J].广西医科大学学报,2017,34(4):534-537.
[25]虎子颖,张会峰,秦灵芝,等.有氧运动对2型糖尿病患者认知功能及其相关危险因素的影响[J].中华物理医学与康复杂志,2019,41(1):64-67.
[26]Stanford K I,Goodyear L J.Exercise and type 2 diabetes:molecular mechanisms regulating glucose uptake in skeletal muscle[J].Adv Physiol Educ,2014,38(4):308-314.
[27]Richter E A,Hargreaves M.Exercise,GLUT4,and skeletal muscle glucose uptake[J].Physiol Rev,2013,93(3):993-1017.
[28]汪亚群,楼青青,嵇加佳,等.抗阻运动对糖尿病前期患者糖脂代谢的影响[J].中华物理医学与康复杂志,2015,37(4):294-297.
[29]Nielsen A R,Pedersen B K.The biological roles of exercise-induced cytokines:IL-6,IL-8,and IL-15[J].Appl Physiol Nutr Metab,2007,32(5):833-839.
[30]Strasser B,Siebert U,Schobersberger W.Resistance training in the treatment of the metabolic syndrome:a systematic review and meta-analysis of the effect of resistance training on metabolic clustering in patients with abnormal glucose metabolism[J].Sports Med,2010,40(5):397-415.
[31]Zheng H P,Qiao X N,Zhang Q,et al.The impact on glycemic control through progressive resistance training with bioDensityTM in Chinese elderly patients with type 2 diabetes:the PReTTy2 (Progressive Resistance Training in Type 2 Diabetes) trial[J].Diabetes Res Clin Pract,2019,150:64-71.
[32]林乐涛,董爱梅.代谢综合征最适运动处方及其机制的研究进展[J].中国全科医学,2016,19(28):3509-3512.
[33]Eriksson J,Taimela S,Eriksson K,et al.Resistance training in the treatment of non-insulin-dependent diabetes mellitus[J].Int J Sports Med,1997,18(4):242-246.
[34]Yang Z Y,Scott C A,Mao C,et al.Resistance exercise versus aerobic exercise for type 2 diabetes:a systematic review and meta-analysis[J].Sports Med,2014,44(4):487-499.
[35]Roberts C K,Hevener A L,Barnard R J.Metabolic syndrome and insulin resistance:underlying causes and modification by exercise training[J].Compr Physiol,2013,3(1):1-58.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#糖脂代谢# #抗阻运动#
5