PD-1等多线治疗失败的晚期MSI-H胃癌,卡度尼利单抗+阿帕替尼四线治疗PFS超20个月
2025-04-12 苏州绘真医学 苏州绘真医学 发表于重庆
研究结果为未来临床试验提供了有价值的参考依据,为MSI-H胃癌的后线治疗策略提供了新视角,突显了双特异性抗体与抗血管治疗联合应用的潜力。
微卫星高度不稳定(MSI-H)胃癌(GC)被认为是胃癌的一种独特亚型。虽然晚期MSI-H胃癌患者在一线治疗中可能对免疫检查点抑制剂联合化疗方案产生良好应答,但目前针对后续治疗的最佳方案尚无明确建议。卡度尼利单抗(一种PD-1和CTLA-4双特异性抗体)在晚期胃癌一线治疗中已显示出令人鼓舞的疗效和安全性,但其在MSI-H胃癌亚型经多线治疗后的应用价值仍不明确。本病例报告描述了一例接受多种治疗方案后仍进展的晚期MSI-H胃腺癌患者,通过卡度尼利单抗联合阿帕替尼治疗获得显著疗效。通过分析当前MSI-H胃癌的治疗格局,本研究探讨了PD-1/CTLA-4双免疫联合抗血管治疗作为该亚型胃癌挽救性治疗的潜力。研究结果为未来临床试验提供了有价值的参考依据,为MSI-H胃癌的后线治疗策略提供了新视角,突显了双特异性抗体与抗血管治疗联合应用的潜力。
背 景
胃癌(GC)是消化系统常见的恶性肿瘤,其中微卫星高度不稳定(MSI-H)胃癌因其对免疫治疗的显著敏感性被视为独特亚型。根据KEYNOTE-062研究,晚期MSI-H胃癌的一线推荐治疗包括单药免疫治疗或免疫联合化疗。对于既往未接受过免疫治疗的晚期患者,PD-1/PD-L1单抗仍是二线治疗的标准选择。但若一线已使用免疫检查点抑制剂,后续治疗则需根据HER2状态选择抗血管生成药物联合抗体药物偶联物(ADCs)或其他免疫检查点抑制剂。由于MSI-H胃癌的罕见性,目前缺乏高质量大规模证据指导其后线治疗策略,尤其在HER2阴性MSI-H胃癌中,针对PD-1/PD-L1抑制剂耐药后的治疗方案尚无明确推荐。
卡度尼利单抗(一种同时靶向PD-1和CTLA-4的双特异性抗体)在GEJCIb临床研究中显示出对晚期胃癌一线治疗的强大疗效,目前正在进行的临床试验探索其在MSI-H肿瘤二线治疗中的作用(NCT04556253)。抗血管生成药物阿帕替尼在中国获批用于晚期胃腺癌三线及以上治疗,其作用机制包括抑制肿瘤血管生成、增加肿瘤内T细胞浸润及改善抑制性肿瘤微环境,从而促进更多T细胞穿透至肿瘤组织。与PD-1/CTLA-4双特异性抗体联用时,阿帕替尼可增强浸润T细胞的抗肿瘤活性并提升肿瘤细胞对免疫治疗的敏感性。尽管前景广阔,但卡度尼利单抗联合抗血管生成药物治疗晚期MSI-H肿瘤的疗效仍需更大规模临床试验验证。本研究报道一例对PD-1单抗治疗耐药的晚期MSI-H胃癌患者,经卡度尼利单抗联合阿帕替尼治疗后实现部分缓解(PR)且无进展生存期(PFS)超过 20 个月。本研究旨在评估当前MSI-H胃癌治疗格局,并探讨卡度尼利单抗联合阿帕替尼在该亚型挽救性治疗中的潜在应用价值。
病 例
患者男,59 岁,有吸烟及饮酒史,因非特异性上腹痛 5 个月伴黑便 1 月就诊。胃镜检查发现胃窦部病变,病理证实为中分化癌。患者ECOG体能状态评分为 0,全身状况良好。增强CT显示存在腹部及腹膜后淋巴结、双肺、肝脏、左肾上腺转移(图1A、B)。因无手术指征,患者开始接受 2 个周期SOX方案化疗(奥沙利铂 130 mg/m² d1+替吉奥 40 mg/m² bid d1-14,每 3 周一次)。对病理样本行二代测序(NGS),检出ERBB2、KRAS2、PIK3CA、POLE、POLD1及BRCA2基因突变,肿瘤突变负荷(TMB)为 62.1 muts/Mb,微卫星高度不稳定(MSI-H),PD-L1表达水平TPS为 10%、CPS为11。基于ERBB2突变,自第二周期化疗起在SOX方案基础上联合赫赛汀(曲妥珠单抗,负荷剂量 8 mg/kg,维持剂量 6 mg/kg,每 3 周一次)。
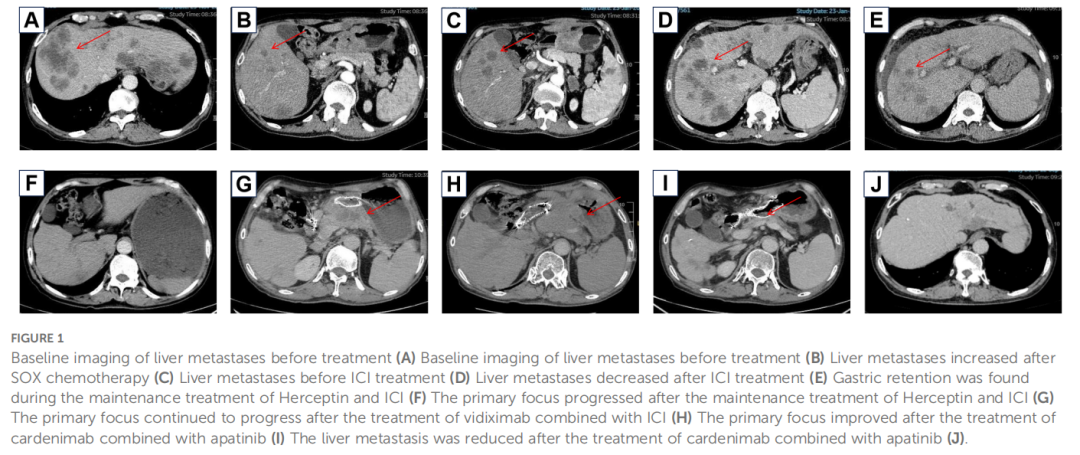
▲图1 影像学结果
患者每 2 个周期化疗后接受复查,疗效评估采用RECIST标准,不良事件按CTCAE v5.0标准记录。完成 2 个周期后患者未出现明显副作用,但影像显示左肾上腺转移灶增大,提示疾病进展(图1C)。遂调整治疗方案为白蛋白结合型紫杉醇联合卡培他滨(白蛋白紫杉醇 125 mg d1、d8+卡培他滨 1000 mg/m² bid d1-14,每 3 周一次)共 4 个周期,期间持续曲妥珠单抗治疗。结合患者MSI-H状态,加用纳武利尤单抗免疫治疗(360 mg,每 3 周一次,图1D)。此阶段肾上腺转移灶明显缩小,肝转移灶轻度退缩,总体疗效评估为部分缓解(PR)。患者诉上腹痛改善,但出现食欲减退、脱发及II级白细胞减少。后续继续维持曲妥珠单抗联合纳武利尤单抗治疗,每 6 个月随访复查(图1E)。维持治疗 7 个月后,患者主诉明显腹胀伴进食差。腹部增强CT显示胃原发灶轻度进展伴胃潴留(图1F),其余转移灶未见明显变化,综合评估疾病稳定。针对胃潴留问题,介入医学科行胃窦支架置入术,继续维持曲妥珠单抗联合纳武利尤单抗治疗。支架置入后患者腹胀显著缓解,食欲改善。
5 个月后复查发现胃窦原发灶、腹膜后淋巴结及肝转移灶进展(图1G)。因出现赫赛汀耐药,启动三线治疗,采用抗HER2 ADC药物维迪西妥单抗(2.5 mg/kg,每 2 周一次)联合纳武利尤单抗(3 mg/kg,每 2 周一次)。此期间患者食欲差,持续上腹隐痛。3 个月后复查示胃窦原发灶持续进展(图1H)。随着疾病进一步恶化,考虑纳武利尤单抗耐药,转为四线治疗,采用抗PD-1/CTLA-4双特异性抗体卡度尼利单抗(6 mg/kg,每 3 周一次)。卡度尼利单抗单药治疗 3 个月后,原发灶、肝转移灶及淋巴结均见轻度增大,总体评估为疾病稳定(SD,增大)。遂在治疗方案中加用阿帕替尼(850 mg,每日一次)。卡度尼利单抗联合阿帕替尼治疗 6 个月后,原发灶及肝转移灶显著改善,疗效评估为部分缓解(PR,图1I、J)。但CT显示右肝新发囊性低密度灶(108×96 mm,图2A),增强扫描可见囊壁及分隔轻度强化。同时患者出现 38.7℃ 发热伴右上腹不适,结合CT表现诊断为肝脓肿。经超声引导下经肝穿刺肝脓肿引流术联合抗生素治疗,引流出约 300 ml脓性液体,细菌培养为肺炎克雷伯菌,术后恢复良好(图2B)。联合治疗 20 个月后,患者自诉症状明显改善,CT显示原发灶较前无显著变化,肝转移灶显著缩小,腹膜后淋巴结及肾上腺转移灶完全消失,目前继续随访中。患者肿瘤标志物及病灶变化详见表1,诊疗总结见图3。
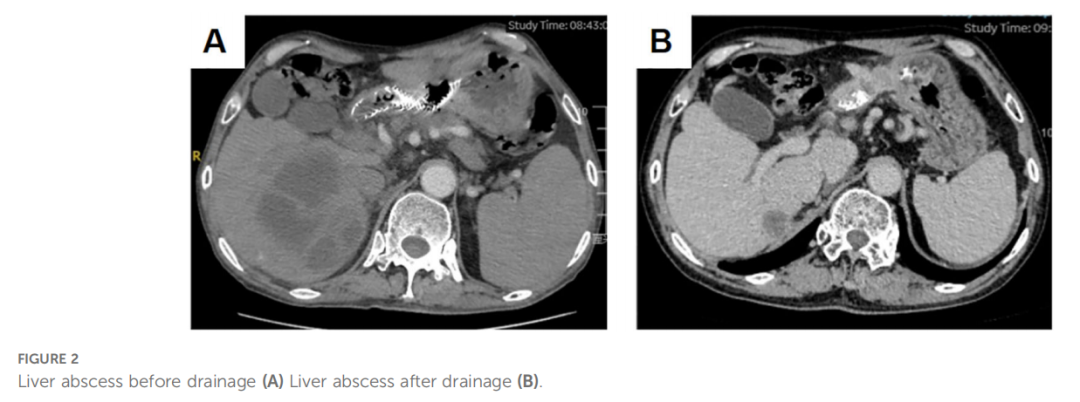
▲图2 肝脓肿引流前(A)肝脓肿引流后(B)
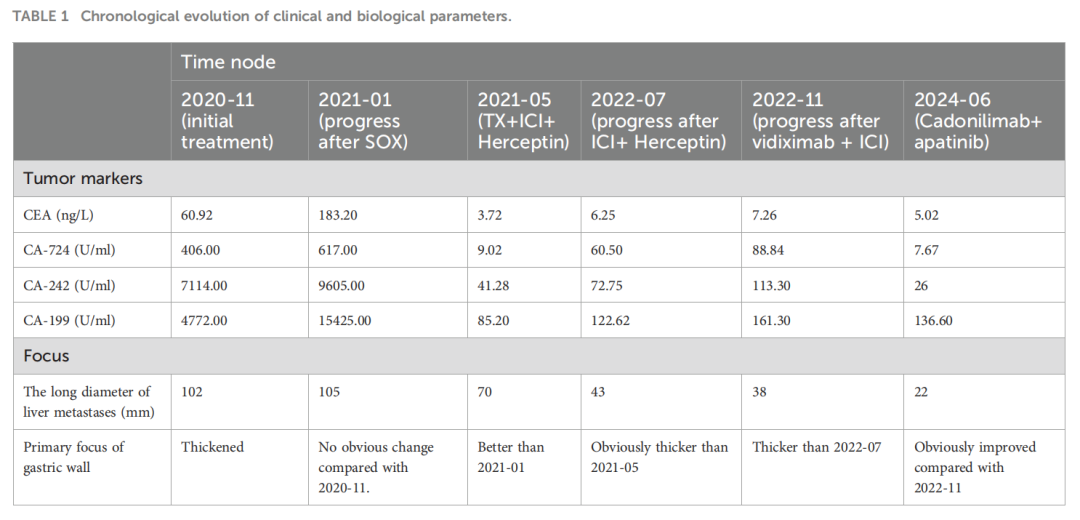
▲表1 临床和生物学参数的时间演变
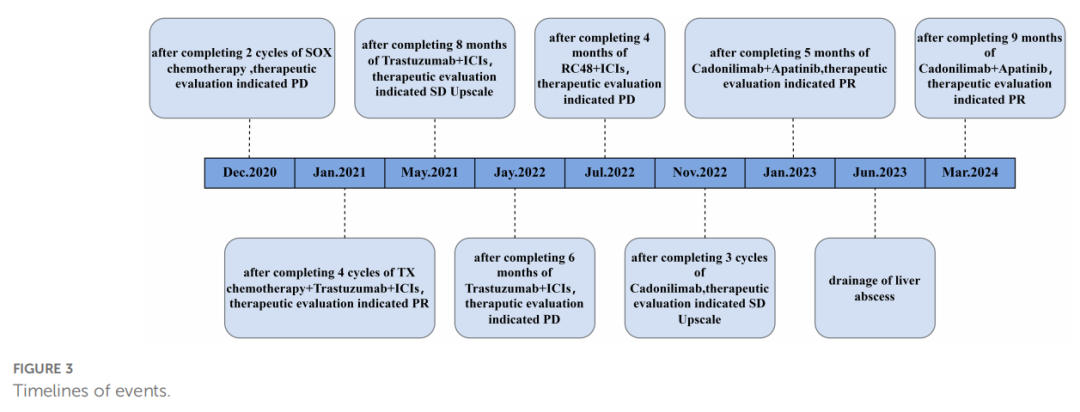
▲图3 事件时间线
讨 论
胃癌是消化系统常见的恶性肿瘤,其死亡率在癌症相关死亡中位居第四位。胃癌具有显著的异质性,根据癌症基因组图谱可分为四种亚型:EB病毒阳性型、微卫星不稳定(MSI)型、基因组稳定型及染色体不稳定型。其中,MSI型肿瘤对免疫治疗具有显著敏感性。微卫星(MS)是基因组中短串联重复的DNA序列,在基因复制及表达中起关键作用。错配修复(MMR)系统可维持MS的稳定性并确保DNA复制的准确性,当该系统发生缺陷(dMMR)时会导致MSI-H表型,表现为基因组不稳定性及高肿瘤突变负荷。此外,MS区域富含可产生大量移码突变的位点,这些突变能够生成大量新抗原,与免疫细胞浸润增加密切相关。由于MSI-H胃癌具有高突变负荷及独特的免疫微环境特征,免疫检查点抑制剂(ICIs)能够对该类肿瘤产生有效且持久的免疫应答。本病例患者通过胃镜及病理学检查明确胃腺癌诊断,经NGS检测证实存在微卫星不稳定性,最终诊断为MSI-H亚型晚期胃腺癌。
MSI-H胃癌的化疗
本例患者接受奥沙利铂联合卡培他滨方案一线化疗2周期后疾病快速进展。现有研究表明,MSI-H患者常伴随胸苷酸合成酶(thymidylate synthase)表达升高,可能导致对5-氟尿嘧啶(5-FU)类药物的耐药。这可能是氟尿嘧啶单药对MSI-H胃癌患者获益有限的原因。此外,MSI-H胃癌的肿瘤微环境呈免疫抑制状态,化疗可能加重免疫抑制,或与本例患者一线化疗期间疾病快速进展相关。
尽管存在上述局限性,化疗仍是进展期胃癌治疗的重要组成。对于MSI-H/dMMR胃癌,单药免疫治疗与免疫联合化疗的疗效对比仍不明确。化疗可诱导肿瘤细胞发生免疫原性细胞死亡,激活树突状细胞及CD8+ T细胞。因此,免疫联合化疗可能克服MSI-H胃癌对免疫治疗的初始耐药。KEYNOTE-062试验中MSI-H肿瘤亚组分析显示,帕博利珠单抗联合化疗组的客观缓解率(ORR)和无进展生存期(PFS)均高于帕博利珠单抗单药组,但单药组总生存期(OS)趋势更优,而联合治疗组生存获益略逊。尽管该试验未直接对比免疫单药与免疫联合化疗的疗效,但提示化疗联合免疫可能为MSI-H/dMMR患者提供初始治疗优势。化疗联合免疫的长期获益仍不明确,需未来临床试验进一步探索。
基因突变与分子靶向治疗
本例患者通过NGS检测发现ERBB2基因突变,诊断为HER2阳性晚期胃癌。基于此,患者在一线及二线治疗中接受了抗HER2靶向治疗(曲妥珠单抗)。C008研究数据显示,维迪西妥单抗的ORR为 24.8%,中位无进展生存期(mPFS)为 4.1 个月,中位总生存期(mOS)为 7.9 个月,且对HER2低表达患者亦显示疗效。基于此,三线治疗采用抗HER2 ADC药物维迪西妥单抗,但患者疾病仍快速进展。HER2阳性的诊断标准通常需通过免疫组化检测HER2蛋白表达水平(3+或2+联合FISH确认基因扩增)。本例患者未进行HER2免疫组化检测,NGS结果显示ERBB2基因第 17 号外显子存在突变(第 678 位精氨酸被谷氨酰胺取代),提示HER2基因突变而非基因扩增或蛋白高表达。抗HER2 ADC药物在本例患者中的有限疗效可能与ERBB2基因无扩增相关。
研究表明,ERBB2基因扩增与MSI-H在胃癌中具有互斥性。癌症基因组图谱(TCGA)数据显示,MSI-H亚型胃癌呈现高突变率特征,但缺乏ERBB2等基因扩增。亚洲癌症研究组(ACRG)数据同样显示,61 例MSI-H胃癌中均未发现ERBB2基因扩增。尽管MSI-H胃癌缺乏ERBB2基因扩增,但研究提示该亚型中ERBB2基因突变频发。例如,在HER2突变型非小细胞肺癌中,HER2抗体药物偶联物德曲妥珠单抗(T-DXd)已显示持久抗肿瘤活性。探索T-DXd在HER2突变型晚期胃癌中的疗效可能提供有潜力的治疗选择。这一方向或为患者后续治疗提供新思路。
对于HER2阴性患者,由于缺乏可靶向治疗的靶点,可能从PD-1和CTLA-4双特异性抗体中获益。抗血管治疗可改善肿瘤微环境缺氧并减少免疫抑制细胞的募集,从而逆转免疫抑制性肿瘤微环境。对于HER2阴性胃癌患者,抗血管药物联合卡度尼利单抗或可成为ICI耐药后的新选择。
多项研究报道,KRAS突变在MSI-H/dMMR胃癌中发生频率较高,且KRAS依赖性通路的激活在MSI-H/dMMR胃癌的肿瘤发生中起重要作用。尽管KRAS突变通常与不良预后相关,但MSI-H状态似乎能够抵消这一影响,在KRAS突变存在时作为有利的预后因素。与微卫星稳定(MSS)型胃癌相比,PI3K/PTEN/Akt通路在MSI-H胃癌中的失调更为常见。PIK3CA、PIK3R1及PTEN等基因突变可导致该信号通路激活,这一过程对MSI-H肿瘤的发病机制至关重要。值得注意的是,携带PI3K通路突变的MSI-H/dMMR胃癌被报道对PI3K通路抑制剂具有治疗应答。结合本例患者的KRAS及PIK3CA突变情况,针对KRAS的靶向治疗及PI3K通路抑制剂或可作为现有治疗耐药后的潜在治疗选择。
PD-1/CTLA-4双特异性抗体在晚期胃癌中的应用
卡度尼利单抗(一种同时靶向PD-1和CTLA-4的双特异性抗体)是晚期胃癌的潜在治疗选择。CTLA-4仅表达于T细胞,通过与抗原呈递细胞上的CD28共刺激分子CD80/CD86竞争性结合,抑制T细胞活化。PD-1/PD-L1通路则在后期阶段抑制抗肿瘤T细胞应答,双通路阻断可能通过互补机制协同增强抗肿瘤免疫。本例患者在PD-1单抗治疗耐药后使用卡度尼利单抗作为后续治疗,尽管原发灶、肝转移灶及淋巴结均见轻度增大,但仍处于稳定范围,加用抗血管治疗后患者获得疗效改善。
卡度尼利单抗在晚期胃癌一线治疗中显示出卓越疗效。GEJC临床研究显示,卡度尼利单抗联合化疗用于晚期胃腺癌一线治疗的中位OS达 17.41 个月,中位PFS为 9.2 个月,12 个月OS率为 61.4%,ORR为 68.2%,疾病控制率(DCR)为 92%。相比之下,PD-1单抗联合化疗在该患者群体一线治疗的中位OS通常为 10-12 个月。但卡度尼利单抗在晚期MSI-H胃癌挽救治疗中的疗效尚未明确。目前一项临床试验(NCT04547101)正在探索卡度尼利单抗用于MSI-H/dMMR晚期肿瘤二线及以上治疗,结果值得期待。
本例患者卡度尼利单抗联合抗血管治疗期间出现肝脓肿。CT显示肝脓肿大小为 108×96 mm,伴发热及上腹不适,遂行经皮管引流术联合抗生素治疗。治疗后肝脓肿显著缩小,患者症状明显改善且恢复良好。治疗期间发生肝脓肿的可能原因包括:免疫治疗可能削弱机体对细菌的防御机制,增加细菌侵入及肝内脓肿形成的风险;肿瘤溶解综合征引起的局部炎症可能为细菌或微生物侵入创造条件,导致脓肿形成;肿瘤溶解还可能增加血管通透性,促进细菌进入肝组织。鉴于免疫治疗具有长期持续的免疫记忆效应,肝脓肿处理(包括引流及抗生素使用)期间卡度尼利单抗共暂停 4 周,3 个月后随访CT显示转移灶及原发灶较前稳定。
抗血管治疗
血管内皮生长因子(VEGF)及其受体(VEGFR)是调控肿瘤血管生成的关键分子,可促进血管内皮细胞增殖与迁移。抗血管生成药物通过靶向VEGFR,有效抑制肿瘤新生血管形成并降低肿瘤微血管密度。Li等研究显示,在二线及以上标准化疗失败的晚期胃癌患者中,阿帕替尼组的总生存期(OS)和无进展生存期(PFS)均显著优于安慰剂组,且毒性可控。基于此,阿帕替尼在中国获批用于晚期胃癌三线及以上治疗。
本例患者经卡度尼利单抗联合阿帕替尼挽救治疗后无进展生存期超过 20 个月。多项临床研究表明,抗血管治疗可增强免疫治疗疗效。目前,抗血管联合免疫检查点抑制剂治疗晚期胃癌的临床试验正在广泛开展(表2)。阿帕替尼通过抑制肿瘤血管生成、促进T细胞向肿瘤内浸润以及改善MSI-H肿瘤的抑制性微环境,使更多T细胞穿透至肿瘤组织。当与PD-1/CTLA-4双特异性抗体联用时,阿帕替尼可进一步增强浸润T细胞的抗肿瘤活性并提升肿瘤细胞对免疫治疗的敏感性。此外,抗血管治疗介导的血管正常化可改善免疫细胞通透性,进而放大免疫治疗效应。
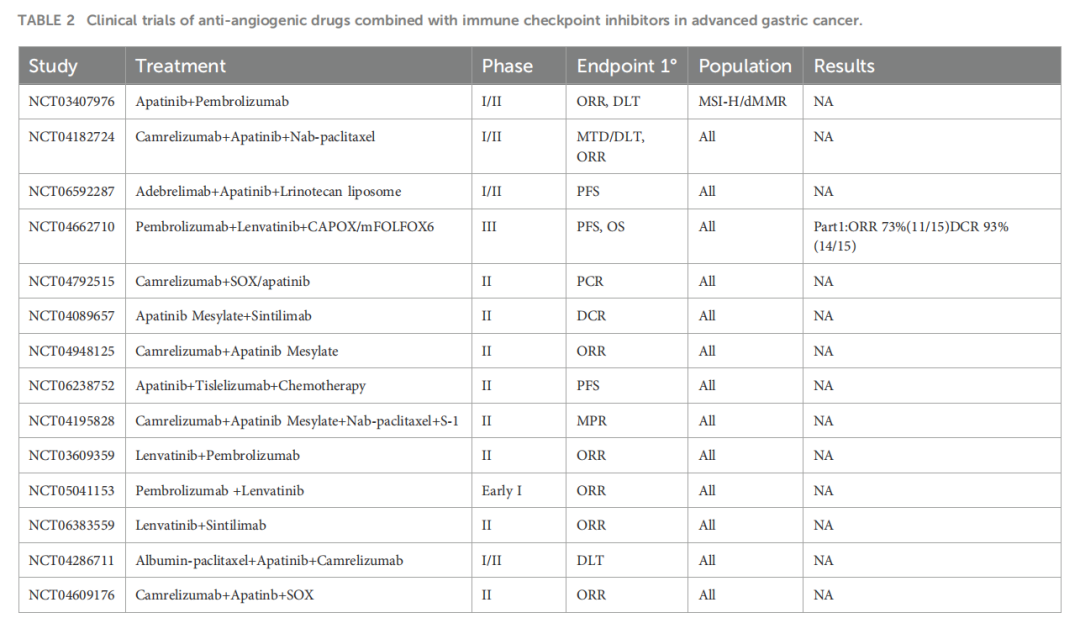
▲表2 抗血管生成药物联合免疫检查点抑制剂在晚期胃癌治疗中的临床试验
MSI-H胃癌的挽救治疗
由于MSI-H胃癌发病率低,针对该亚型患者的高质量大规模循证研究有限,目前尚无针对三线及以上治疗方案的明确推荐。KEYNOTE-059研究评估了帕博利珠单抗单药用于晚期胃癌三线及以上治疗的疗效与安全性,结果显示MSI-H亚组客观缓解率(ORR)为 47%,显著高于非MSI-H胃癌组(9%)。CheckMate-032研究探索了纳武利尤单抗单药及其联合抗CTLA-4抗体伊匹木单抗在胃癌三线及以上治疗中的疗效,其中MSI-H亚组接受联合治疗组的ORR及 18 个月无进展生存(PFS)率均达 50%,但 3/4 级不良事件发生率显著升高。TAS-102在晚期胃癌三线及以上治疗中显示潜力,TAGS研究证实TAS-102较安慰剂显著改善转移性胃癌患者的中位OS(5.7 个月 vs. 3.6 个月)。阿帕替尼同样在晚期胃癌三线及以上治疗中取得积极结果,III期研究显示阿帕替尼组OS较安慰剂组显著延长(6.5 个月 vs. 4.7 个月)。目前,抗血管联合免疫检查点抑制剂用于晚期MSI-H胃癌三线及以上治疗的临床试验(NCT03407976、NCT04662710)正在进行中,相关数据值得期待。
局限性
该患者未在检测到ERBB2基因突变后进行进一步的免疫组化检测以确认HER2蛋白表达状态。此外,由于经济原因,患者接受卡度尼利单抗治疗的剂量为 6 mg/kg每三周一次(q3w),而标准剂量为 6 mg/kg每两周一次(q2w)。
结 论
免疫检查点抑制剂(ICIs)对微卫星高度不稳定(MSI-H)胃癌患者展现出显著治疗获益,然而如何有效管理对ICIs产生耐药的MSI-H肿瘤仍是一项重大挑战。本病例中,患者对长期PD-1单药治疗产生耐药,但随后通过PD-1/CTLA-4双特异性抗体联合阿帕替尼治疗获得显著疗效。这一结果表明,抗血管治疗与PD-1/CTLA-4双特异性抗体联合应用或可作为ICI耐药后MSI-H肿瘤的可行治疗选择,需进一步探索该联合方案在MSI-H肿瘤中的应用价值。
参考文献:
Zhao J, Li X, Sun X, Xiao R, Xue J, Sui K and Liu Z (2025) Combination of cadonilimab (PD-1/CTLA-4 bispecific antibody) and apatinib as salvage therapy achieves partial response in MSI-H advanced gastric cancer: a case report. Front. Immunol. 16:1533700. doi: 10.3389/fimmu.2025.1533700


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#胃癌# #卡度尼利单抗#
7