长春应化所陈学思院士/宋万通研究员团队Nano Letters:普适性高分子疫苗载体提升多肽抗原免疫效力
2024-08-30 BioMed科技 BioMed科技 发表于上海
本研究开发了一种能够普适性键合多种特异性抗原肽的疫苗载体PMMEBOx-B-IMDQ。该载体能够显著增强了多肽的淋巴结驻留能力,同时大幅提升抗原肽的系统性免疫响应。
基于新一代生物信息检测技术所发现的肿瘤特异性抗原疫苗因其高度的特异性成为肿瘤免疫治疗的热点,但筛选出的特异性抗原肽的可利用效率仍较低,并且许多肿瘤属于低突变类型,这使得特异性抗原肽的获取更为困难。
特异性抗原肽的低使用率及弱免疫效率主要由两方面原因所致。一方面是由于游离抗原肽在体内易酶解,从而无法有效回流至淋巴结并发挥免疫效应;另一方面是抗原肽的理化性质各异,这导致一部分抗原肽无法被树突状细胞摄取并递呈。如何有效提升特异性抗原肽的免疫响应率至关重要。
多肽纳米载体能够保护抗原肽不被酶降解的同时,利用纳米粒子的特性使抗原肽高效回流至淋巴结,从而增强特异性抗原肽的免疫响应率。然而,特异性抗原肽的理化性质各异,难以用一种纳米载体同时担载多种特异性抗原肽。如何制备一种普适性的高效负载多种抗原肽的纳米载体是特异性多肽疫苗的关键。
针对此问题,中国科学院长春应用化学研究所的陈学思院士/宋万通研究员团队在Nano Letters上发表题为“Uniform polymeric nanovaccine platform for improving the availability and efficacy of neoantigen peptides”的研究结果。该研究合成了一种键合有TLR7/8佐剂的聚噁唑啉疫苗载体(PMMEBOx-IMDQ)。利用双键噁唑啉链段与抗原肽巯基的点击化学反应,该载体能够高效地键合上多种修饰有组织蛋白酶B敏感链段(CGFLG)的特异性抗原肽(PMMEBOx-IMDQ-peptide)(图1)。这种普适性键合多肽的疫苗载体,不仅显著增强了抗原肽的淋巴结驻留,还大幅提升了提高了特异性抗原肽的在外周血及脾脏中的效应CD8+ T细胞的水平,并且在B16-OVA和MC38肿瘤模型上显示出了优良的肿瘤抑制效果。
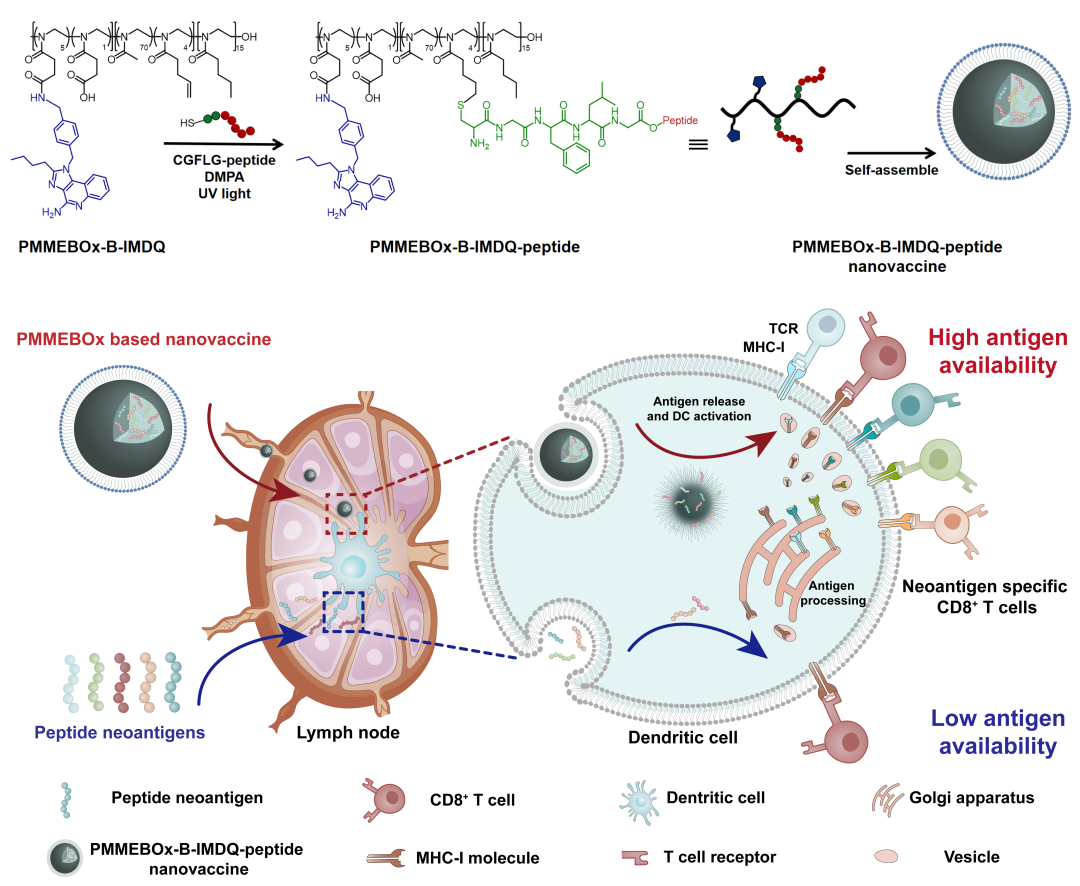
图1 PMMEBOx-IMDQ-peptide的制备流程及体内免疫机制示意图
研究者通过改变羧基噁唑啉单体的投料顺序,制备了两种PMMEBOx-R/B-IMDQ疫苗载体,用于调控IMDQ佐剂位于聚合物的位置。相较于游离OVA肽,PMMEBOx-R/B-IMDQ载体显著提升了OVA肽的淋巴结富集水平,并且使OVA肽驻留于淋巴结中长达6天。此外,该疫苗还能够有效渗透进淋巴结副皮质区,并在淋巴结内提升DC活化和抗原交叉递能力(图2)。
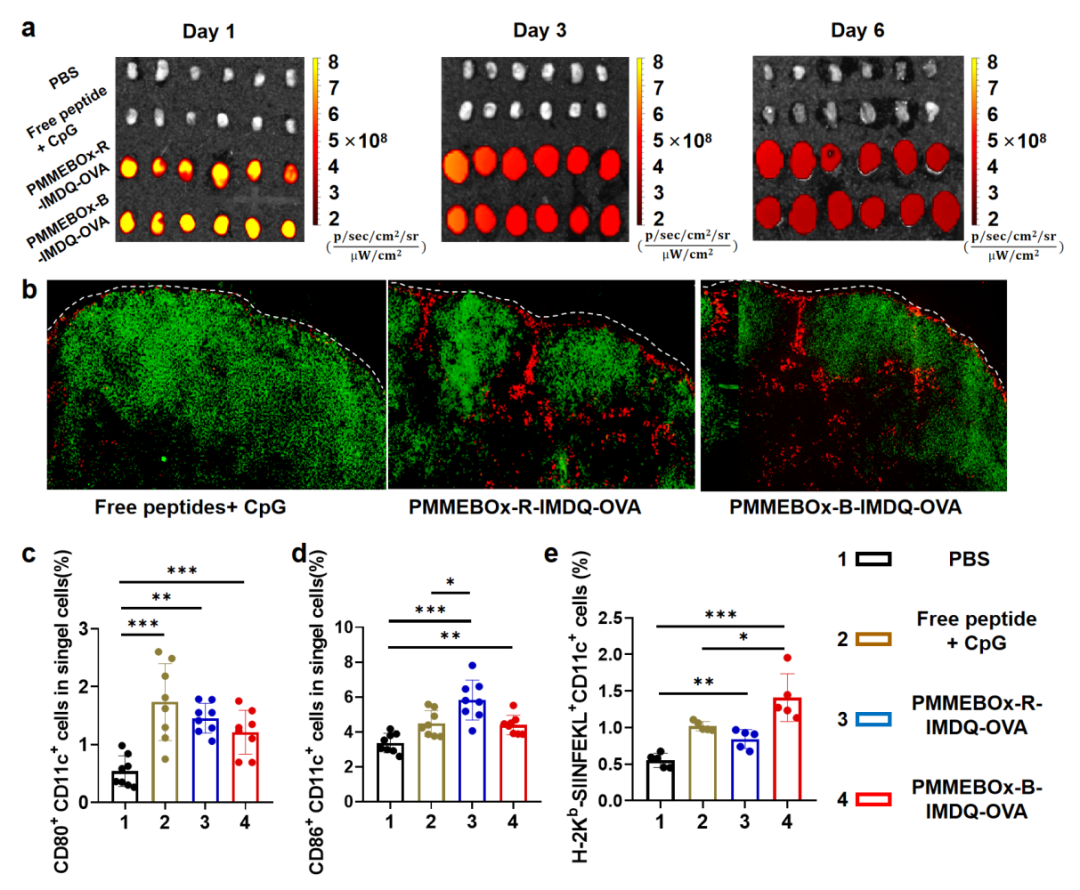
图2 PMMEBOx-R/B-IMDQ-OVA两种疫苗显著提升了OVA肽的淋巴结驻留及渗透
随后,将PMMEBOx-R/B-IMDQ-OVA纳米疫苗用于B16-OVA肿瘤模型的治疗。研究发现,PMMEBOx-R/B-IMDQ-OVA显著抑制了肿瘤的生长,并在脾脏中产生了大量的OVA特异性杀伤T细胞。此外,PMMEBOx-R/B-IMDQ-OVA纳米疫苗相较于游离OVA肽,还分别使小鼠脾脏重量提升了2.5和2.3倍、使小鼠腹股沟淋巴结重量提升了6.4倍和5.0倍,大幅提升了抗原肽系统性免疫响应水平(图3)。
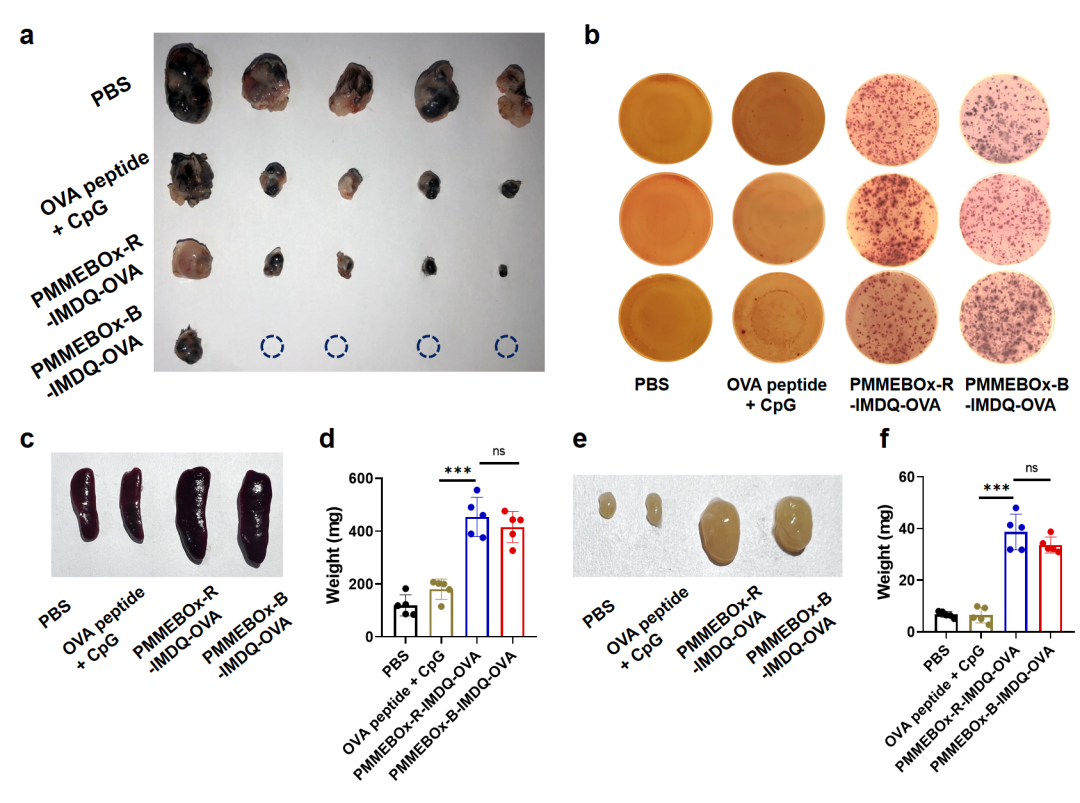
图3 PMMEBOx-R/B-IMDQ-OVA疫苗在B16-OVA肿瘤模型上可有效抑制肿瘤生长并产生OVA特异性杀伤T细胞
再次,将筛选得到的MC38疏水特异性抗原肽Adpgk、Dgapt1、Resp1修饰上组织蛋白酶B敏感链段后,键合在PMMEBOx-B-IMDQ疫苗载体上,制备了三种MC38特异性多肽疫苗PMMEBOx-B-IMDQ-Adpgk/Dgapt/Resp1。将疫苗皮下注射到MC38荷瘤小鼠体内,PMMEBOx-B-IMDQ-Adpgk/Dgapt/Resp1显著抑制了MC38肿瘤的生长,显著提升了小鼠外周血中杀伤性CD8+ 和CD4+ T细胞的数目,类似的结果在小鼠脾脏的ELISPOT检测结果中也有体现(图4)。以上研究结果表明,PMMEBOx-B-IMDQ疫苗载体能够大幅提升多种肿瘤新抗原肽的系统性免疫响应。
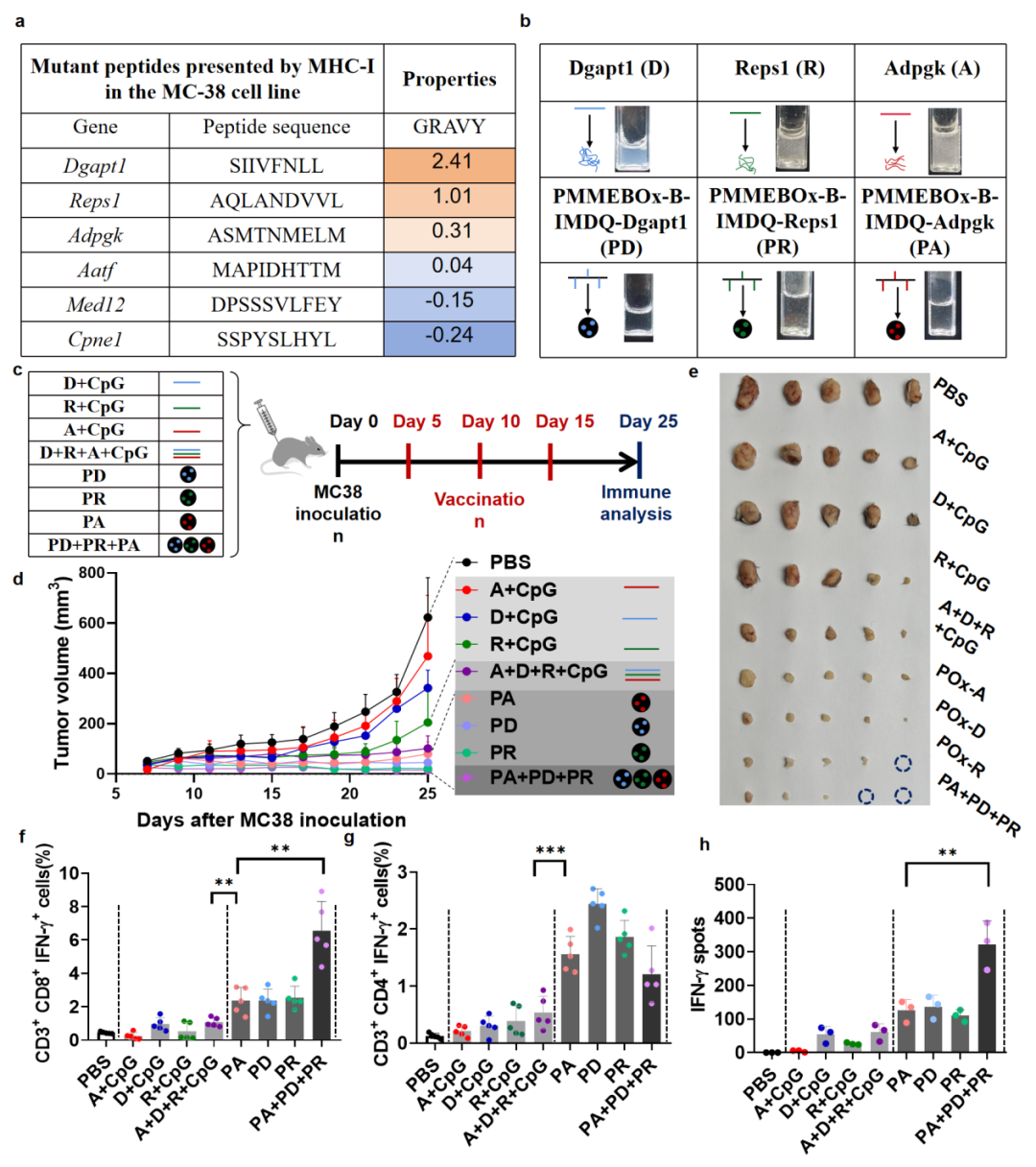
图4 PMMEBOx-B-IMDQ-Adpgk/Dgapt/Resp1可有效抑制MC38肿瘤生长并产生系统性免疫响应
综上所述,本研究开发了一种能够普适性键合多种特异性抗原肽的疫苗载体PMMEBOx-B-IMDQ。该载体能够显著增强了多肽的淋巴结驻留能力,同时大幅提升抗原肽的系统性免疫响应。通过这种方式,PMMEBOx-B-IMDQ疫苗载体极大地提升了特异性抗原的利用效率,为特异性多肽疫苗的开发提供了新思路。
中科院长春应化所陈学思院士及宋万通研究员为该文章的通讯作者,博士研究生陈宏宇为该文章的第一作者。该研究得到了国家自然科学基金,中国科学院国际合作基金,吉林省科技发展计划基金等目的支持。
原文链接:
https://pubs.acs.org/doi/10.1021/acs.nanolett.4c02196
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#肿瘤特异性抗原疫苗# #多肽纳米载体# #聚噁唑啉疫苗载体#
77