Genome Med:87.5%患者3年无复发!新抗原DNA疫苗在三阴性乳腺癌治疗中显成效
2024-11-26 测序中国 测序中国 发表于陕西省
美国华盛顿大学团队开发新抗原 DNA 疫苗平台并完成其在 TNBC 患者的 Ⅰ 期临床试验,报告了疫苗安全性、免疫原性及临床影响,包括新抗原识别、免疫反应诱导、TCR 扩增及临床结果评价等,前景可期。
肿瘤新抗原是肿瘤中表达的可被免疫系统识别的突变蛋白/氨基酸序列。2012年,Nature发表了首个应用免疫基因组学方法进行新抗原鉴定的临床前研究成果,证明了癌症新抗原是癌症免疫编辑的重要靶点。2023年Trends in Cancer发表的首次临床试验结果证实,新抗原疫苗是安全的,能够诱导或增强新抗原特异性和抗肿瘤免疫,同时减少自身免疫风险。
目前,针对传染病病原体和癌症的DNA疫苗已进入临床试验阶段。三阴性乳腺癌(TNBC)是侵袭性较高的癌症类型,目前尚无靶向治疗方法。已有研究表明,TNBC是新抗原疫苗治疗的一个有吸引力的候选者,但迄今为止还没有关于TNBC新抗原DNA疫苗研究的报道。
为改善TNBC患者的临床预后,美国华盛顿大学研究团队开发了一种新抗原DNA疫苗平台,能够有效呈现HLA-I和HLA-II类表位,并完成了首个新抗原DNA疫苗在TNBC患者中的Ⅰ期临床试验(NCT02348320),这些患者在新辅助化疗后手术病理检查显示仍存在TNBC,是一种高复发风险人群。研究团队在Genome Medicine发表的最新文章“Neoantigen DNA vaccines are safe, feasible, and induce neoantigen-specific immune responses in triple-negative breast cancer patients”中,报告了新抗原DNA疫苗在TNBC治疗中的安全性、免疫原性和潜在临床影响。

1.新抗原识别和DNA疫苗设计
该研究参与者为接受新辅助化疗后仍有TNBC的患者,排除了转移性乳腺癌或自身免疫疾病的患者。研究团队采集了参与者外周血和肿瘤DNA样本,并进行肿瘤/正常外显子组测序,以识别导致蛋白质/氨基酸序列改变的体细胞突变(图1A)。最终有18名TNBC患者符合试验条件。在辅助治疗完成后,参与者每隔一个月接种3剂新抗原DNA疫苗,接种前、后均抽取外周血进行测序(图1B)。肿瘤RNA测序用于评估体细胞突变的表达。
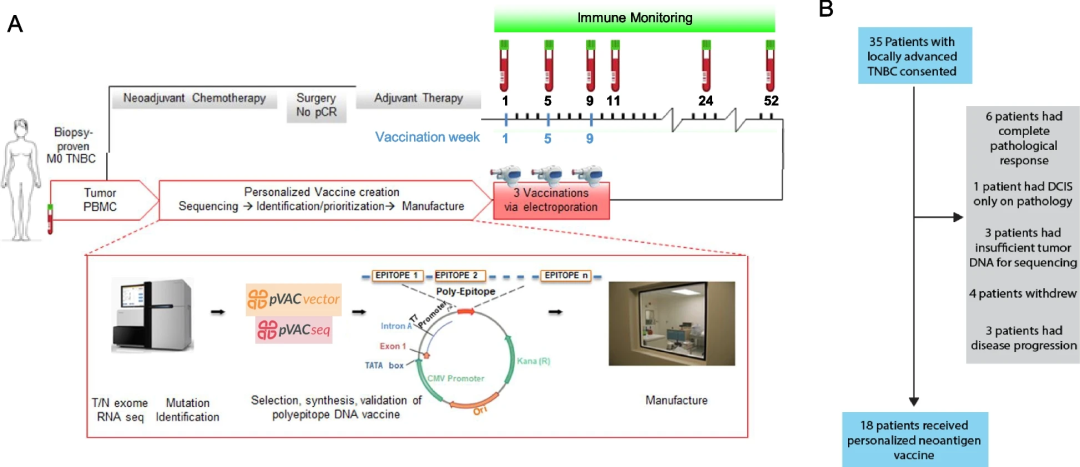
图1. 为TNBC患者设计、制造和施用新抗原DNA疫苗。
肿瘤RNA测序显示,每个TNBC患者样本中平均有21.5个突变导致蛋白质/氨基酸序列表达改变。其中,8个中位数突变产生了预测结合评分<500nM的候选新抗原。最终纳入新抗原DNA疫苗的新抗原中位数为10个(范围4-20个,表1),其中97%的候选新抗原是错义突变导致,其余的新抗原是插入/删除或移码突变导致。TP53突变很常见,与TP53突变相关的候选新抗原存在于14/18的参与者中(78%)。TNBC中常见的其他基因突变(例如SOX17、KMT2D和PIK3R1)的发生率要低得多(≤17%)。只有一位患者BRC58在BRCA1/2中观察到致病性移码缺失突变。
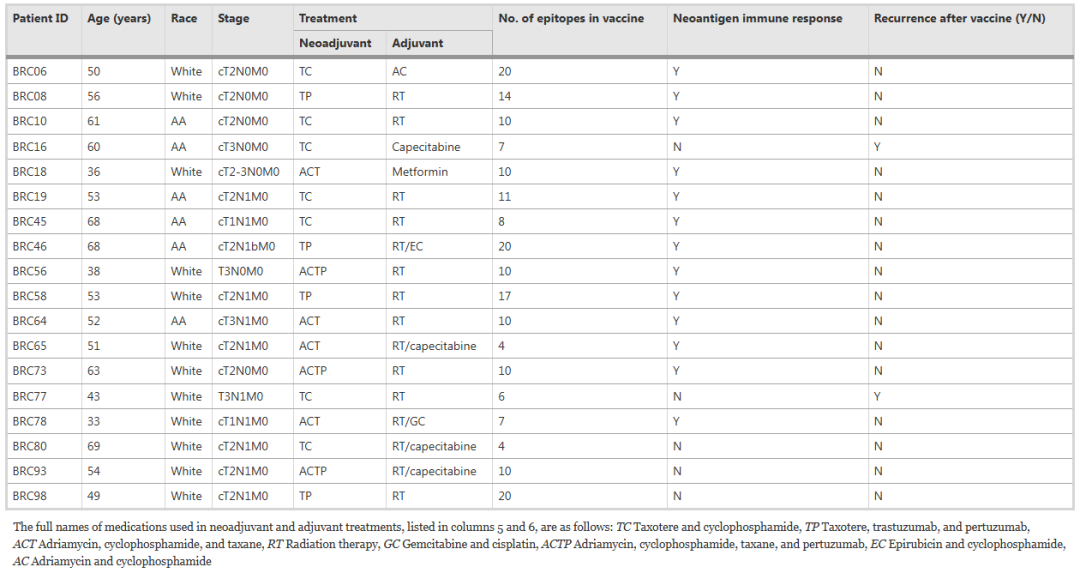
表1.TNBC患者基线特征以及对新抗原DNA疫苗接种的免疫和临床反应
2.新抗原DNA疫苗诱导新抗原特异性免疫反应
接种疫苗的患者使用在基线和接种后收集的外周血单核细胞(PBMC)进行免疫监测,并评估新抗原特异性反应(图2A)。结果显示,在疫苗接种后PBMC中诱导初始ELISpot应答的47种新抗原中,45种新抗原在重复ELISpot中被证实具有免疫原性(图2B)。对至少一种新抗原有应答的患者被认为是应答者。
总的来说,18名患者中有14名对至少一种新抗原有反应(图2C-D),来自所有18名患者的198种新抗原中有45种(23%)具有免疫原性。在10/14的患者中,接种前SFC的累积数量少于250个(7/14的患者SFC = 0),但接种后,每百万T细胞的累积spot数从250到超过20,000不等(图2E)。按单个新抗原分解,在接种疫苗后,对单个新抗原的反应幅度变化很大(图2F)。
虽然在体外致敏后,接种前的T细胞几乎没有免疫反应性,但接种后的T细胞对重叠肽(OP)表现出明显的差异活性。通过流式细胞术分析新抗原刺激后细胞内IFN-γ表达,CD4和CD8T细胞均有特异性反应。结果显示,45个验证的新抗原中有14个阳性(接种前和接种后ICS阳性细胞的百分比至少增加2倍,并且接种后样本中ICS阳性细胞的百分比至少≥1%,则认为ICS检测中的新抗原为阳性)。
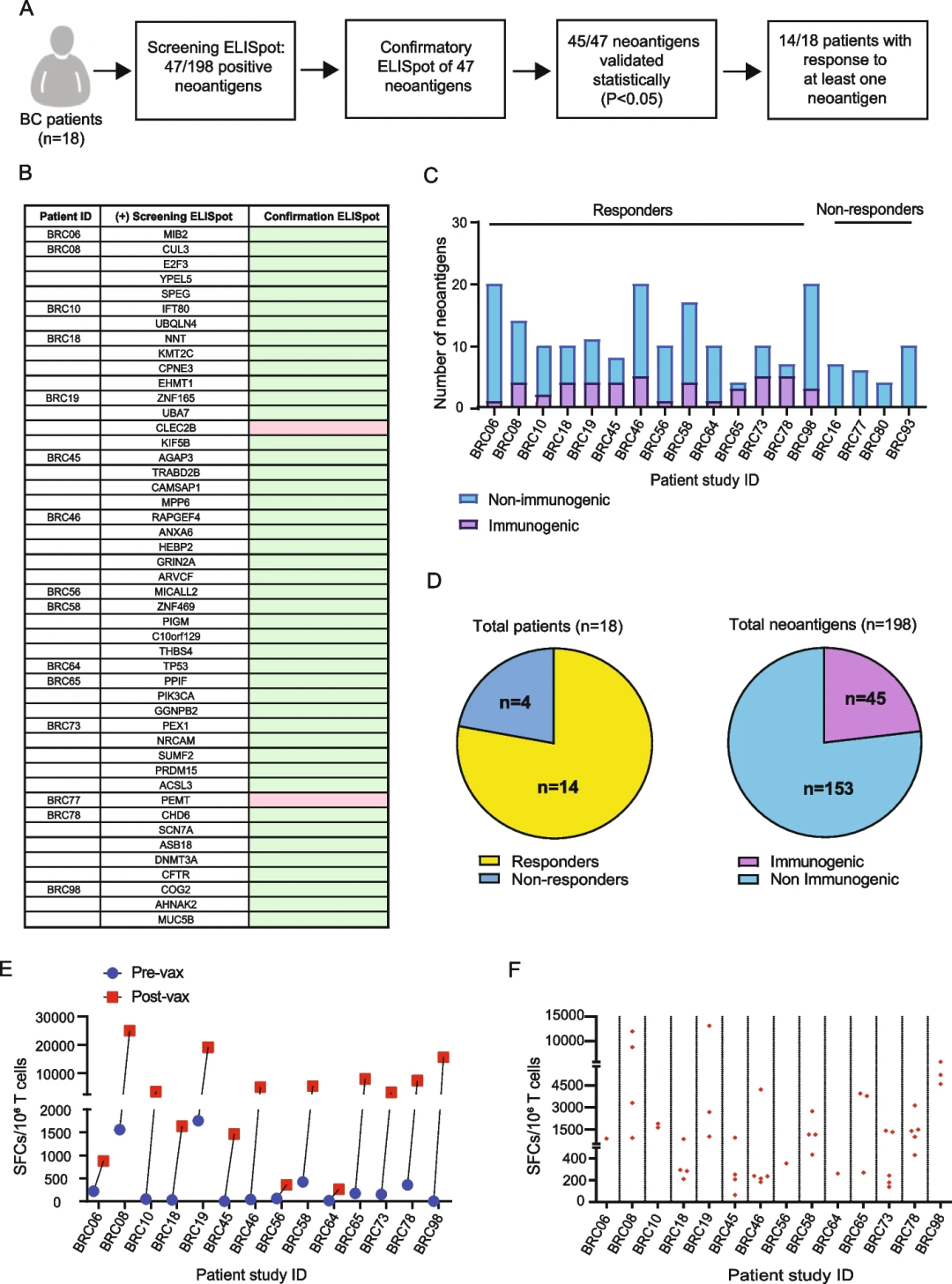
图2.新抗原DNA疫苗诱导新抗原特异性免疫反应
3.接种疫苗后新抗原特异性TCR扩增
为了确定接种新抗原DNA疫苗是否会导致新抗原特异性T细胞受体扩增,研究团队对3例患者(用新抗原CHD6或CFTR刺激的BRC78的T细胞;用新抗原PIGM刺激的BRC58的T细胞)进行了配对单细胞TCR-seq(scTCR-seq)和批量TCR-seq(图3)。研究观察到单一的优势克隆,并证实了scTCR-seq鉴定的TCR对PIGM肽具有特异性。
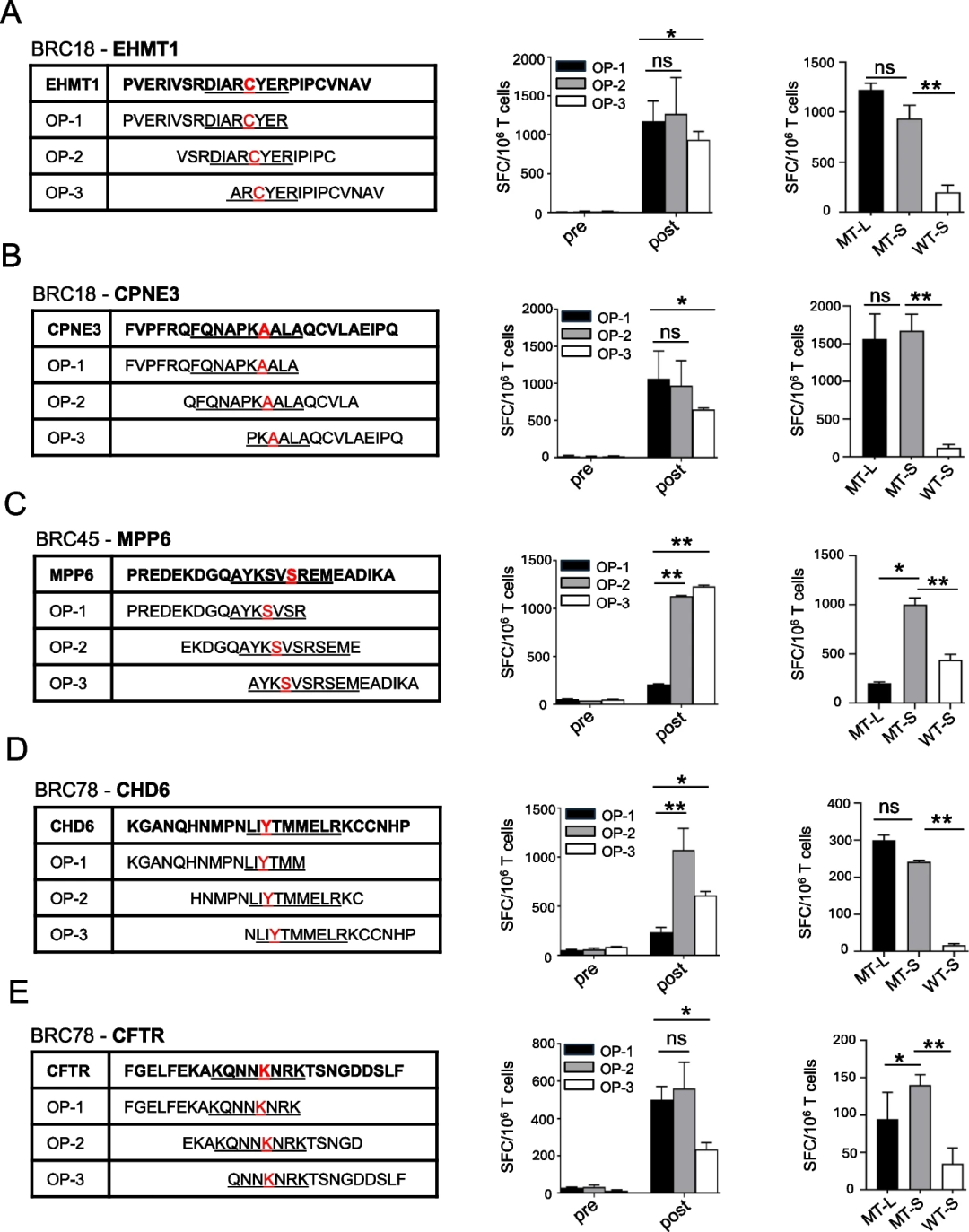
图3.接种疫苗前后免疫应答对预测候选新抗原的特异性
在体外用新抗原PIGM、CHD6和CFTR刺激PBMC后进行大量TCR-seq,以确定新抗原特异性TCR是否扩增。分析表明,scTCR-seq鉴定的显性TCR Vβ克隆型显著扩增(图4),表明疫苗接种导致新抗原特异性TCR扩增。此外,研究团队对6名患者的10种免疫原性新抗原进行了额外的批量TCR-seq分析,证实了接种疫苗后特异性TCR克隆型扩增,这表明其他新抗原特异性克隆型也扩增了。
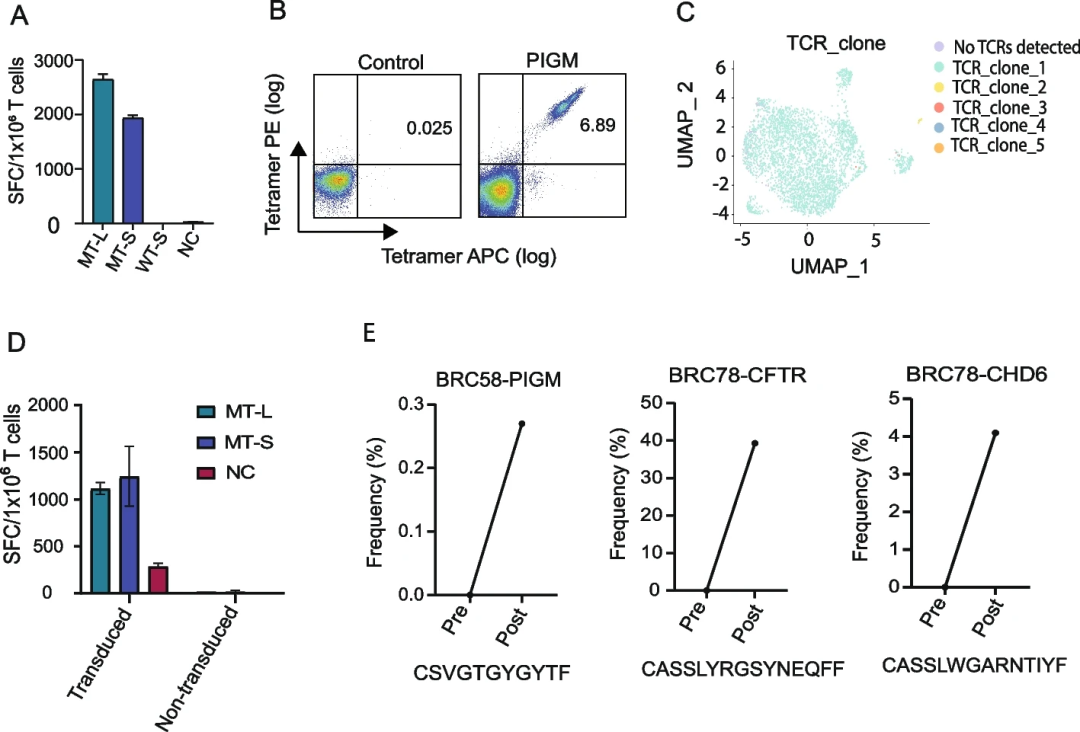
图4.分析证实新抗原疫苗可扩增新抗原特异性T细胞
4.新抗原DNA疫苗接种后临床结果的评价
总体而言,该新抗原DNA疫苗接种耐受良好,只有一例3级不良事件(高血压),其余不良事件为与注射部位疼痛相关的2级不良事件(28例中有13例2级不良事件),或主要与肌痛相关的1级不良事件(图5A)。目前接受新抗原DNA疫苗治疗的患者具有极好的临床结果,很少出现疾病复发。
研究团队将接种新抗原DNA疫苗的患者与在华盛顿大学医学院连续治疗的TNBC患者进行比较,发现随访36个月后,接种疫苗患者的无复发生存期(RFS)为87.5%(95% CI: 72.7-100%),而机构治疗TNBC患者的RFS为49%(95% CI: 36.4-65.9%)(p = 0.011)(图5B)。
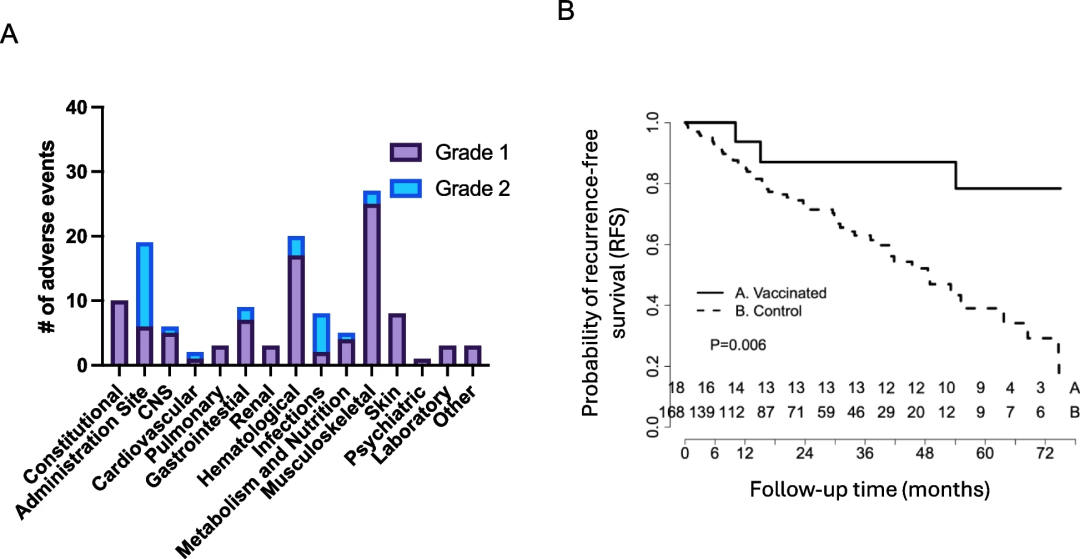
图5.新抗原疫苗治疗是安全的,并延长了患者的无复发生存期。
结 语
该研究是第一个完成利用新抗原DNA疫苗平台靶向人类癌症新抗原的临床试验,也是第一个完成针对TNBC患者的新抗原疫苗研究,分析了新抗原疫苗治疗该患者群体的可行性和潜力。此前的研究主要集中在高突变负荷的癌症,例如黑色素瘤、非小细胞肺癌、膀胱癌和胶质母细胞瘤。
研究结果表明,新抗原DNA疫苗安全且耐受性良好,没有明显的不良事件,能够诱导新抗原特异性免疫反应。数据分析显示,与机构历史对照队列相比,接种该疫苗的患者无复发生存率有所提高,显示了临床获益,填补了未满足的临床需求。

William Gillanders(右)团队分析接种疫苗后参与者的血液检测结果,来源:WashU Medicine
文章通讯作者、华盛顿大学William E. Gillanders教授表示:“DNA疫苗平台有利也有弊,主要优势之一是易于制造且耗时短,以及该平台的相对功效。研究结果比我们预期的要好。虽然这不是一个完美的研究,仍存在局限性,但我们将继续推行这种疫苗策略,并正在进行随机对照试验,对标准治疗加疫苗与标准治疗单独进行直接比较。到目前为止,在这些患者身上看到的结果让我们深受鼓舞。我们对这些新抗原疫苗的前景感到兴奋,希望能够改善侵袭性癌症患者的治疗效果。
论文原文:
Zhang, X., Goedegebuure, S.P., Chen, M.Y. et al. Neoantigen DNA vaccines are safe, feasible, and induce neoantigen-specific immune responses in triple-negative breast cancer patients. Genome Med 16, 131 (2024). https://doi.org/10.1186/s13073-024-01388-3
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#三阴性乳腺癌# #免疫反应#
7