西南医院张毅、齐晓伟教授/赵祥副教授ACS Nano封面:肿瘤源性细胞外囊泡肿瘤趋向性化疗-基因疗法实现三阴性乳腺癌局部免疫激活
2024-11-09 BioMed科技 BioMed科技 发表于上海
陆军军医大学团队提出基于功能化肿瘤源性细胞外囊泡的协同治疗策略,用于三阴性乳腺癌,可靶向肿瘤,下调 STAT3,抑制肿瘤生长和转移,激活抗肿瘤免疫。
陆军军医大学第一附属医院乳腺甲状腺外科张毅教授、齐晓伟教授与肿瘤科赵祥副教授团队合作在《ACS Nano》期刊上发表了以《Tumor-Derived Extracellular Vesicles Enable Tumor Tropism Chemo-Genetherapy for Local Immune Activation in Triple-Negative Breast Cancer》为题的论文,此工作同时被选为封面文章。针对三阴性乳腺癌恶性程度高,可用药物靶点有限、高异质性和免疫抑制性肿瘤微环境等特点,首次提出一种基于信号转导子和转录激活子 3小干扰RNA和阿霉素的功能化肿瘤源性细胞外囊泡的基因治疗、化疗和免疫治疗相结合的协同治疗策略,为进一步的临床应用奠定坚实基础。陆军军医大学第一附属医院乳腺甲状腺外科张毅教授、齐晓伟教授与肿瘤科赵祥副教授为共同通讯作者,乳腺甲状腺外科彭再慧助理研究员、赵婷婷研究实习员、郜苹苹研究实习员为共同第一作者。


图1. 研究成果被选为ACS nano封面文章。
阿霉素作为一种广泛使用的化疗药物,是三阴性乳腺癌的一线化疗选择。大量临床前研究表明,阿霉素与免疫检查点抑制剂联合使用更有效。然而,因三阴性乳腺癌的高度异质性肿瘤微环境导致这种协同化学免疫疗法会遇到肿瘤抵抗和复发。信号转导和转录激活因子 3(STAT3)是驱动三阴性乳腺癌侵袭和免疫抑制的核心转录因子,其过度激活与三阴性乳腺癌的化疗耐药和不良预后密切相关。由此,研究团队提出并优化了一种基于阿霉素和靶向信号转导子和转录激活子 3的小干扰RNA功能化肿瘤源性细胞外囊泡的协同基因化疗策略。
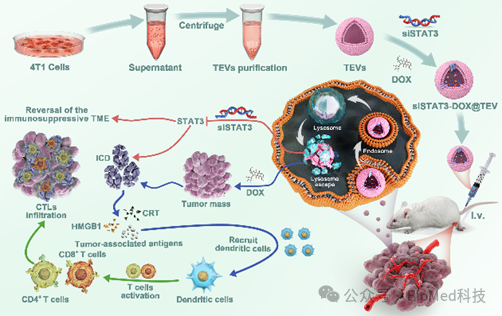
图2. siSTAT3-DOX@TEV的制备及治疗原理示意图
在这项工作中,研究者通过自主研发的方法将信号转导子和转录激活子 3小干扰RNA(siSTAT3)和阿霉素(DOX)修饰在肿瘤细胞外囊泡(TEV)上,形成复合细胞外囊泡制剂(siSTAT3-DOX@TEV),并表征其形貌、粒径、负载率以及稳定性等参数(图3)。随后,在体外实验和小鼠模型中证实其肿瘤组织靶向性,并显著下调肿瘤内信号转导子和转录激活子 3的表达水平,协同有效诱导肿瘤细胞免疫原性死亡(图4)。在小鼠中构建原位和肺转移模型,给药2周后取材进行抑制肿瘤和转移的效果评估:siSTAT3-DOX@TEV能显著抑制肿瘤生长,显著减少了肺转移病灶(图5)。此外,这项研究还通过质谱流式细胞技术深度解析经过治疗后三阴性乳腺癌的免疫微环境,结果显示siSTAT3-DOX@TEV显著增加抗肿瘤的M1型巨噬细胞,促进树突细胞成熟,激活并促进抗肿瘤T细胞浸润,有效激活抗肿瘤免疫反应(图6)。
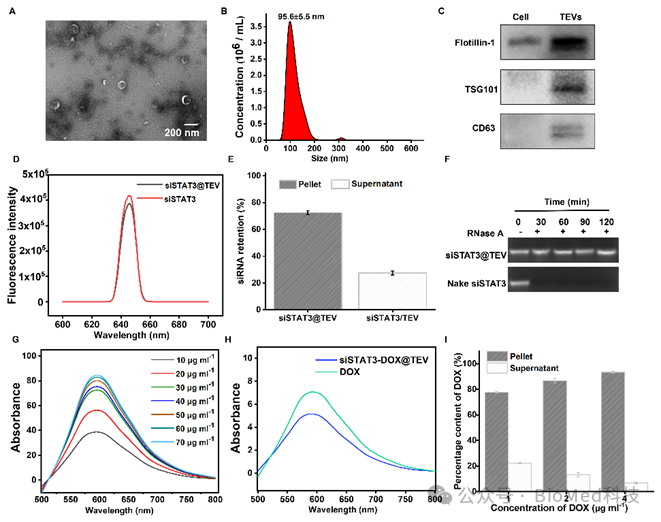
图3. siSTAT3-DOX@TEV的制备及其表征
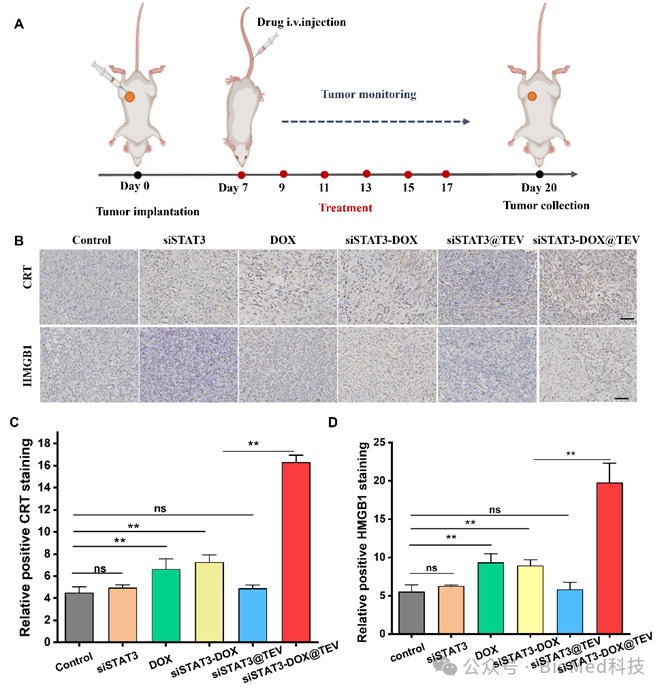
图4. 协同治疗有效诱导肿瘤细胞免疫原性死亡
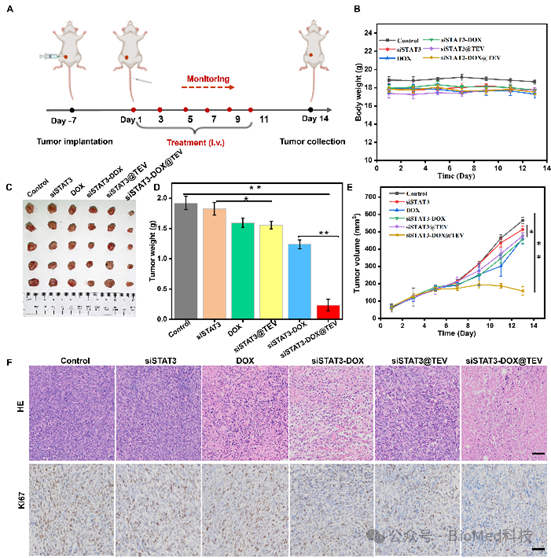
图5. 协同治疗有效抑制三阴性乳腺癌生长
通过以上研究表明,提出的基于肿瘤源性细胞外囊泡的基因-化疗协同治疗策略可有效激活抗肿瘤免疫,显著抑制三阴性乳腺癌原发病灶和转移灶,这为三阴性乳腺癌的临床治疗提供了新思路。
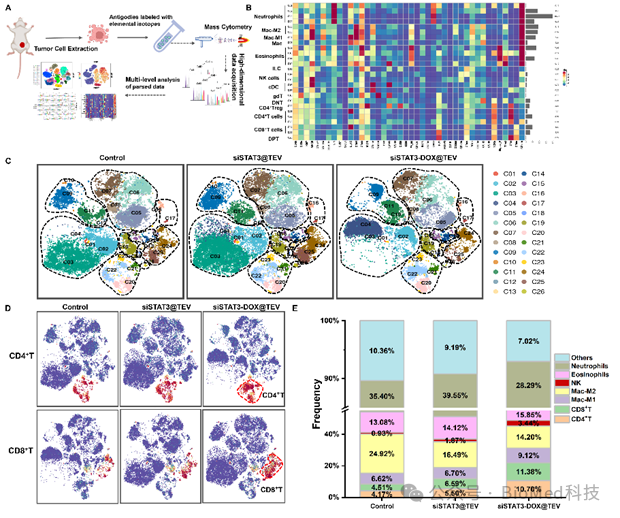
图6. 质谱流式检测技术揭示治疗前后三阴性乳腺癌免疫微环境变化
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c12967
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#三阴性乳腺癌# #STAT3# #细胞外囊泡#
22