NGS panel检测多种儿童脑肿瘤脑脊液cfDNA基因突变,与肿瘤组织样本分析百分之百一致
2024-08-18 苏州绘真医学 苏州绘真医学 发表于上海
研究对儿童原发性中枢神经系统肿瘤患者脑脊液游离 DNA 检测,发现可检测相关变异,与肿瘤组织分析一致,为诊断提供新途径,未来需更大规模研究优化。
肿瘤DNA的临床测序对于儿童原发性中枢神经系统(CNS)肿瘤的综合诊断和选择治疗是必要的,但神经外科活检并非没有风险。本研究将血液和脑脊液(CSF)中的游离DNA(cfDNA)描述为儿童脑肿瘤“液体活检”的来源。通过腰椎穿刺、脑室造口术或手术从患有中枢神经系统肿瘤的儿科患者中采集脑脊液样本。提取后,使用UW-OncoPlex™(一种经过临床验证的下一代测序平台)对CSF衍生的cfDNA进行测序。还评估了脑脊液衍生的cfDNA结果与配对血浆和肿瘤样本的一致性。
从15例原发性中枢神经系统肿瘤患儿中获得17份脑脊液样本。肿瘤类型包括髓母细胞瘤(n=7)、非典型畸胎瘤样/横纹肌样瘤(n=2)、伴有H3 K27变异的弥漫性中线胶质瘤(n=4)、毛细胞星形细胞瘤(n=1)和多形性黄色星形细胞瘤(n= 1)。在9/17(53%)的样本中检测到了CSF衍生的cfDNA,8/10(80%)的提取样本足以进行测序。在匹配的肿瘤组织中也检测到了所有体细胞突变和拷贝数变异,而在血浆样本和对照中没有肿瘤来源的cfDNA。在没有恶性细胞细胞学证据的情况下,在仅200µl CSF中检测到肿瘤来源的cfDNA变异。检测到几种临床相关变异,包括KIAA1549::BRAF融合。
使用CSF衍生的cfDNA可检测一系列儿童脑肿瘤中临床相关的基因组变异。下一代测序平台能够检出高产量的DNA变异,与组织分析的一致性为 100%。
研究背景
中枢神经系统(CNS)原发肿瘤是最常见的肿瘤之一,是儿童疾病相关死亡的主要原因。这些CNS肿瘤的组织学和分子构成与在成人人群中观察到的有很大不同,因此需要仔细部署目前诊断所需的分子检测。当代治疗和风险分层的改进得益于基因组特征的进步,使我们能够通过整合的分子诊断来定义肿瘤。在各种诊断模式中,靶向二代测序(NGS)panels已成为一种可靠的临床方法,用于完成CNS肿瘤的分子谱分析,用于诊断、预后评估和确定与治疗相关的改变。尽管诊断工具有了显著改进,但儿科神经肿瘤学的一个共同挑战是获取肿瘤组织活检进行诊断的神经外科风险。许多儿童肿瘤起源于中线部位,包括视路或脑干,在这些部位,组织的手术获取可能对视力或基本神经功能构成特殊风险。在这些中线位置,即使是与活检相关的小的出血并发症也可引起临床上毁灭性的神经系统后果。对于肿瘤完全切除的患者,目前通过放射学影像进行监测,这可能受到无法发现微小病变或无法将疾病与治疗相关变化区分开来的限制。这些局限性可以通过一种微创、高灵敏度和特异性的取样方法(如脑脊液(CSF)采集)来克服。
游离DNA(cfDNA)是在血液、尿液、粪便和脑脊液等生物体液中自由循环的细胞外DNA。细胞游离DNA的释放通常是细胞死亡的结果,细胞死亡可由凋亡和/或坏死引起。cfDNA通常是碎片化的,肿瘤来源的cfDNA高度碎片化,约为145个碱基对,但这一情况可能因位点不同而有所不同。在CNS肿瘤患者中,检测到的DNA既包括“正常”胚系DNA,也包括肿瘤DNA。CNS肿瘤衍生的cfDNA在血浆中并不大量存在,但已从原发性和继发性CNS肿瘤成人患者的CSF中成功分离出cfDNA。与血浆相比,CSF是少细胞的,这使来自血液中丰富的正常细胞的信号减少,使CSF成为检测肿瘤DNA的理想分析物。在儿童中进行的初步研究也证明了通过CSF cfDNA进行肿瘤分子谱分析的可行性,例如在H3K27M变异的弥漫性中线胶质瘤中进行突变特异性检测。cfDNA提取后,可通过多种方法(从针对单位点突变的数字PCR到靶向二代测序分析)对其进行分子特征分析。在初步验证和临床效用研究中,将cfDNA结果与CNS肿瘤组织突变和组织病理学关联起来尤为重要。本研究描述了多种儿童CNS肿瘤中CSF衍生cfDNA的靶向分子谱。
研究方法
研究者采集了15例原发性CNS肿瘤患者的脑脊液,包括2例患者在肿瘤特定治疗期间不同时间点的连续样本,共采集了17份原发性CNS肿瘤患者的CSF样本。对照CSF样本取自3例缓解期白血病患儿。本研究选择的血浆样本与CSF采集日期最接近,且均在CSF采集后3日内。根据2021年世界卫生组织CNS肿瘤分类系统对CNS肿瘤进行常规组织学、免疫组织化学和测序分析。
研究结果
患者特征:
15例原发性中枢神经系统肿瘤儿童患者,包括7名女性(47%)和8名男性(53%);患者中位年龄为7岁(范围:1-17岁),接受肿瘤、脑脊液和血浆配对检测。研究者在两个时间点采集了2例患者的CSF样本,共获得了原发性CNS肿瘤患者的17份CSF样本,以及缓解期白血病患者的3份对照CSF样本。肿瘤组织学包括9例胚胎性肿瘤(7例髓母细胞瘤和2例非典型畸胎样/横纹肌样瘤)和6例胶质肿瘤(4例高级别胶质瘤和2例低级别胶质瘤)。受试者的人口统计数据见表1。在初始肿瘤切除时获得3份CSF样本,与腰椎穿刺获得的样本(n=11)相比,所有通过脑室造口获得的样本(n=3)均在手术后3天内收集。3份样本在肿瘤复发时采集,其余样本在初次诊断时采集。腰椎穿刺采集的样本来自分期切除后10-19天,治疗期间切除后35-985天或复发时(图1)。
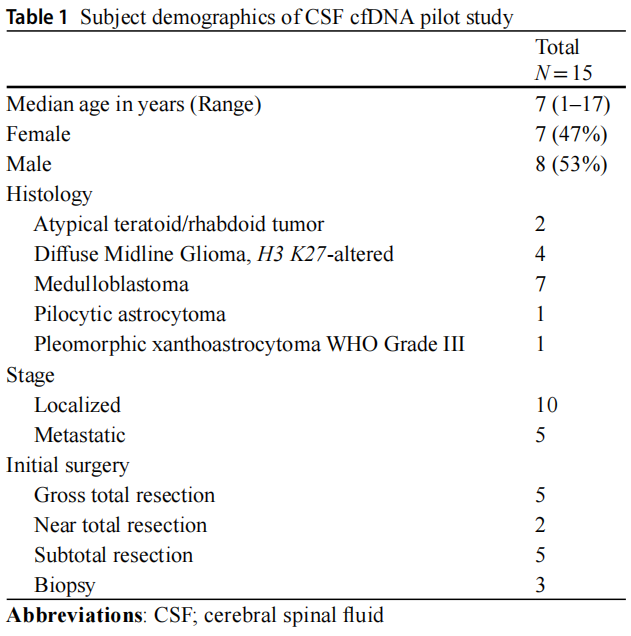
表1
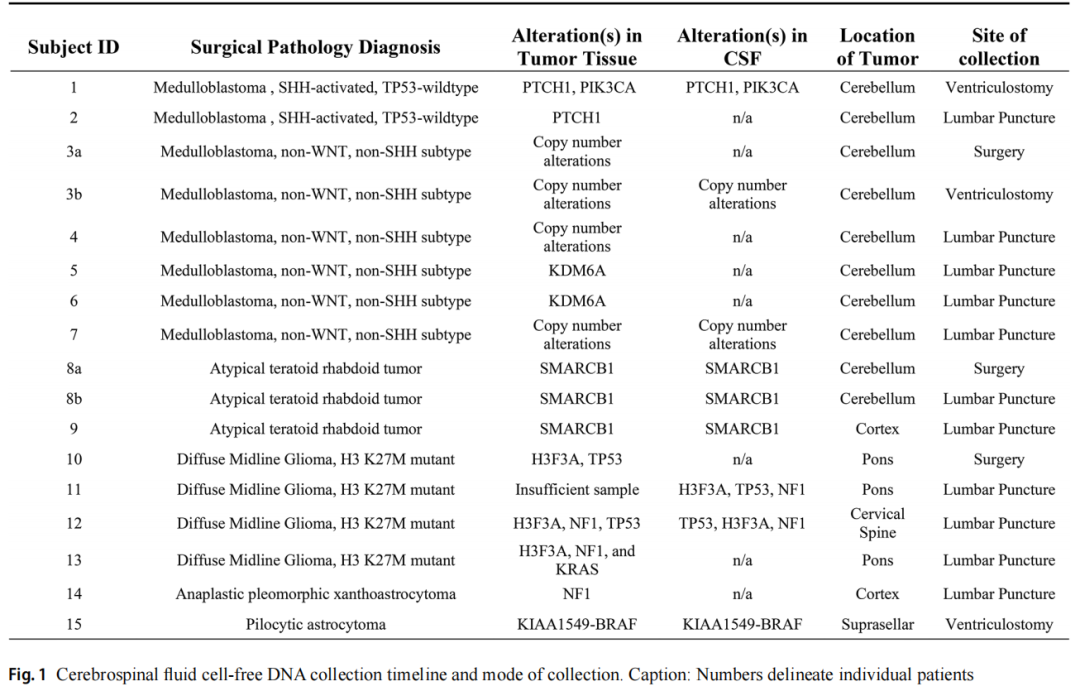
图1
cfDNNA检测:
研究者成功在8/15例(53%)患者的9/17份(53%)CSF样本中分离出cfDNA(图2)。在有足够cfDNA的所有病例中,测序显示CSF中的基因变异与肿瘤组织分析一致。UW OncoPlex™靶向测序证实7/8例患者肿瘤组织存在体细胞突变,1例弥漫性软脑膜脊髓肿瘤患儿分子诊断为弥漫性中线胶质瘤,免疫组化检测H3 K27M变异,肿瘤活检样本提取DNA不足。CSF评估、处理和比较测序结果的详细信息见表2。
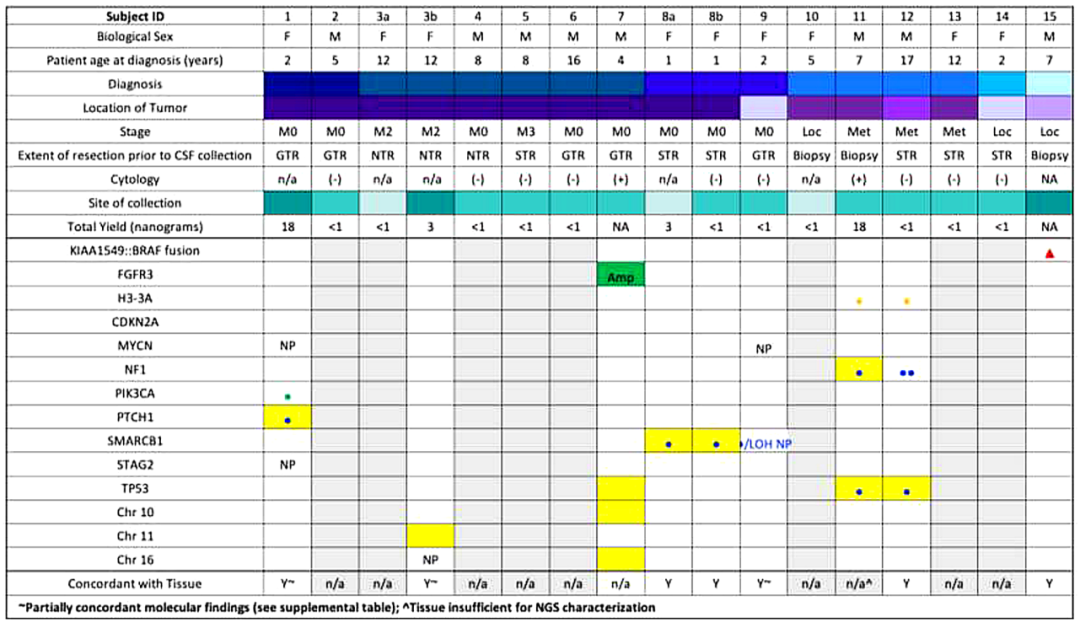
图2
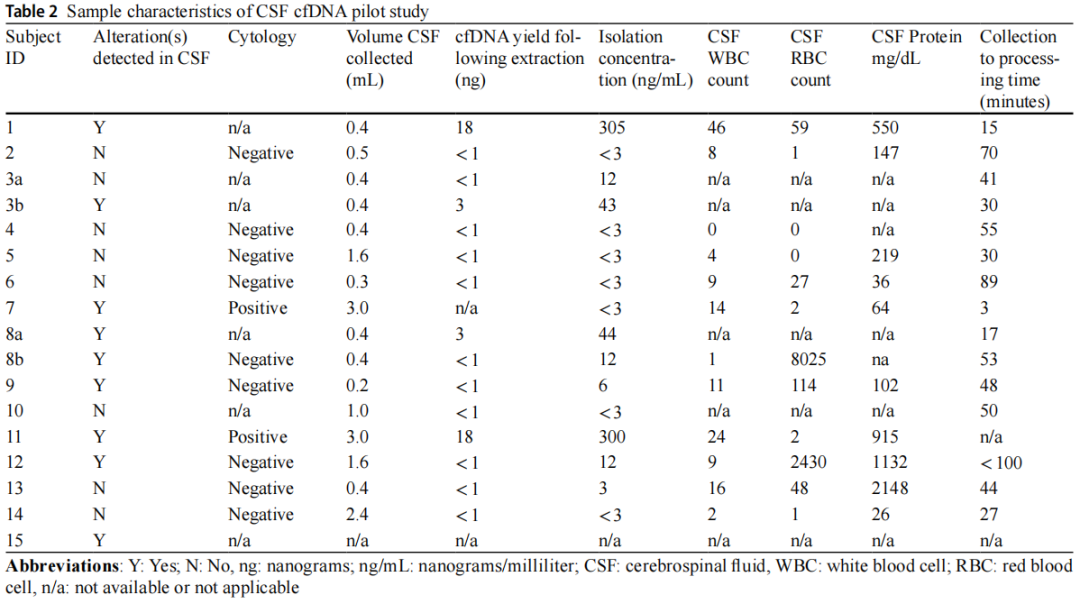
表2
在最少200uL的CSF中检测到肿瘤来源的cfDNA(9个测序样本的CSF中位容量为0.4 mL,范围为0.2-3 mL)。成功测序样本的cfDNA浓度(ng/mL)范围为6-305 ng/mL。除1例样本外,其余样本中>5 ng/mL的游离DNA足以成功测序。在脑室造瘘术(3/3,100%)、手术(1/3,33%)、腰椎穿刺分期(2/5,40%)、治疗期间或复发时的腰椎穿刺(3/6,50%)样本中检测到变异。成功测序的CSF标本中,3/9例为全切除或近全切除后获得,6/9例为次全切除或活检后获得。cfDNA处理的中位时间为41 min(范围:3-99 min)。
在一个样本中,在没有肿瘤细胞学证据的情况下检测到cfDNA。在CSF中检出cfDNA或未检出cfDNA的任何样本中,均未检出血浆cfDNA突变。以3例白血病患儿脑脊液为阴性对照;所有产生的cfDNA均不足以进行测序(表2)。
样本特征:
在CSF白细胞计数(p=0.25)、CSF红细胞计数(p=0.13)或CSF蛋白(p=0.63)方面,有和没有足够cfDNA用于测序的样本无相关性。cfDNA阳性和阴性样本在肿瘤切除程度(p=0.45)、采集和处理之间的时间(p=0.23)、CSF体积(p=0.47)、肿瘤分期(p=0.86)或CSF细胞学(p=0.9)方面也没有差异。
讨 论
在这里,研究者描述了在儿童和青少年原发性CNS肿瘤患者中使用临床验证的NGS检测CSF衍生cfDNA的经验。这些初步数据证明了该分析物在多种儿童中枢神经系统肿瘤(包括胚胎性肿瘤和胶质瘤(低级别和高级别))中的临床有效性和潜在的诊断临床效用。在超过一半的样本中检测到CSF cfDNA,这与包括多种CNS肿瘤类型的其他CSF cfDNA研究相似(表3)。在仅1 ng的总cfDNA中检测到基因变异,和在cfDNA>5 ng的所有病例中均检测到。与现有研究(中位CSF体积范围为1-5 mL)相比,本研究的最小CSF体积是已报道的最小的。研究者发现CSF cfDNA基因变异与肿瘤基因变异的一致率为100%。
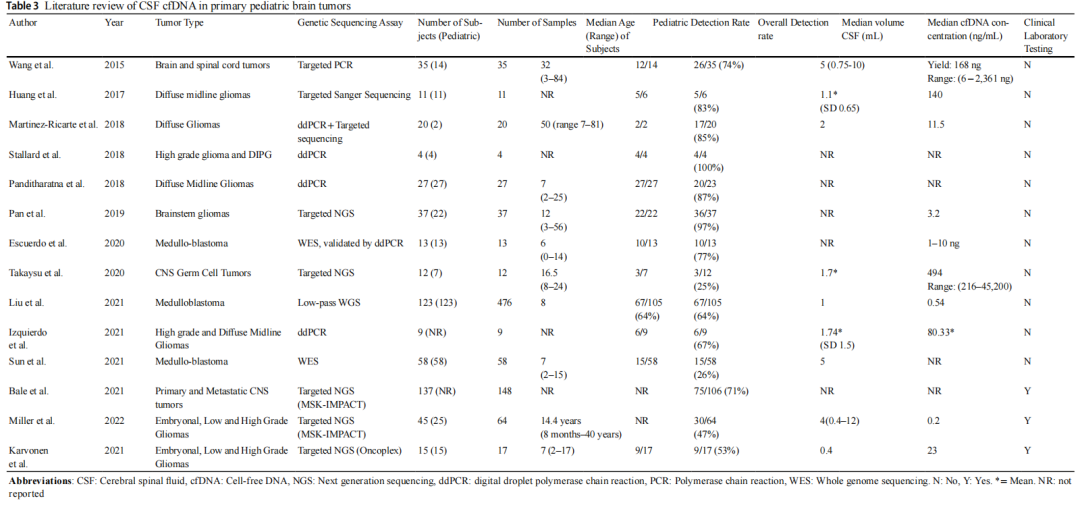
表3
随着进一步的验证研究,通过CSF cfDNA肿瘤取样可能与组织肿瘤取样相比具有几个有临床意义的优势。诊断时的cfDNA检测可以克服有限的物理活检中由于肿瘤异质性造成的采样误差,或者可以在无法进行手术活检的患者中进行测序。此外,在没有细胞学阳性的情况下也可以检测到cfDNA变异,这表明早期发现复发的可能性,即在常规腰椎穿刺或影像学评估之前。通过微创技术在影像学检查或进展或复发的临床证据之前了解中枢神经系统肿瘤的分子特征的能力具有影响临床实践的潜力。
表3总结了儿童CNS肿瘤患者cfDNA检测的文献现状。迄今,用于cfDNA的检测方法包括低通全基因组测序、全外显子组测序、微滴数字PCR和Sanger测序等。使用靶向NGS panel测序进行cfDNA检测是一种先例,并且在该中心使用已经过临床验证的检测方法是可行的选择。据研究者所知,这是报告CSF cfDNA临床测序的第一所儿科医院和第二所中心。研究者报告了最小的CSF中位体积(0.4 mL),而其他研究的CSF中位体积范围为1-5 mL,这一区别与儿科相关,在儿科中,出于安全性考虑,较小的容量是可行和首选的。研究者报告的CSF cfDNA检出率为53%,与之前研究的平均69%(范围:26-100%)相当。
研究者报告了通过CSF液体活检检测出具有临床意义的基因变异,例如KIAA1549::BRAF融合,这是儿童毛细胞星形细胞瘤(最常见的儿童CNS肿瘤)中最常见的基因变异。在另外一个系列的4例病例中,cfDNA已报告了检测这种融合的能力。该突变与MEK和泛RAF抑制剂的出现具有临床相关性,MEK和泛RAF抑制剂是一种在该病中显示出革命性前景的靶向疗法。此外,需要药物治疗的儿童低级别胶质瘤(如本报告中的患者)通常位于涉及视路的中线位置,因此手术切除甚至活检可能不可行。液体活检可以对儿童低级别胶质瘤(包括其他类型的肿瘤)进行更安全的采样,用于诊断、预后和研究纳入标准。
优势和局限性
本初步研究的主要局限性是样本量小。样本的选择是基于同一时间点血浆和脑脊液样本的组织配对确诊的分子肿瘤诊断的可用性。尽管如此,在包括多种CNS肿瘤在内的儿科队列临床研究中,使用临床验证的UW-OncoPlex™检测cfDNA仍然是本研究的一个优势。儿童CNS肿瘤虽然是儿童中最常见的肿瘤,但也代表了一组罕见疾病,每一种肿瘤都具有不同的临床相关分子特征,在髓母细胞瘤的情况下,对于任何一个分子亚组都是必需的;或用于高级别和低级别胶质瘤的诊断确认和治疗选择。未来的研究需要纳入更广泛的基因panels,以进一步表征其他儿童CNS肿瘤。
研究者报告了其在西雅图儿童医院(Seattle Children’s Hospital)的经验,UW-OncoPlex™是该医院用于检测癌症变异的常用NGS检测方法,但与所有检测panel一样,在广泛推广方面存在局限性。检测的性能指标(如灵敏度)取决于被测序的肿瘤类型及其基因变异,包括突变的基因和突变的类型。例如,在进行本研究时,未包括TTYH1和C19MC,因此该检测将无法发现具有多层菊形团的胚胎性肿瘤的分子变异特征。目前还没有被普遍接受的cfDNA检测方法。对CSF cfDNA使用UW-OncoPlex™的一个显著优势是对FFPE肿瘤使用相同的检测,从而便于比较CSF和肿瘤的基因变异。这允许使用相同的仪器和方法对两种分析物进行测序,这是简化临床实验室流程的理想方法。
对CSF成分进行的统计学分析表明,在CSF细胞或蛋白质成分对cfDNA检测的影响方面,它们没有统计学显著性。需要进一步的研究来更好地阐明可能阻碍cfDNA检测的样本因素,以优化cfDNA的检出率。虽然本研究数据表明,与LP获得的样本相比,在脑室造瘘术或手术中获得的样本中,cfDNA的检出率较高,但与Miller及其同事的观点一致,这一发现不具有统计学显著性。未来的工作将进一步解决CSF提取和cfDNA检测的模式,因为之前的文献表明,在手术时间附近获得的样本中,由于机械破碎,以及与特定肿瘤位置(即脑室附近)相关的样本中,检测cfDNA的可能性可能增加。
在多种儿童CNS肿瘤中,使用靶向二代测序检测CSF cfDNA中临床相关的基因变异是可行的。此外,cfDNA样本中检测到的基因变异与多种儿童CNS肿瘤中的一致性为100%。未来需要在更大的患者队列中开展研究,以确定最佳的cfDNA采集、处理方法,并对常规临床应用进行验证。
参考文献:
Ronsley R, Karvonen KA, Cole B, et al. Detection of tumor-derived cell-free DNA in cerebrospinal fluid using a clinically validated targeted sequencing panel for pediatric brain tumors. J Neurooncol. 2024;168(2):215-224. doi:10.1007/s11060-024-04645-y
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#中枢神经系统肿瘤# #基因变异# #脑脊液#
98