【JAMA Oncol】CAR-T治疗后第二原发肿瘤的病理生物学、流行病学及缓解策略
19小时前 聊聊血液 聊聊血液 发表于陕西省
《JAMA Oncology》近日发表综述,讨论了 SPC 的病理生物学、流行病学以及缓解策略。
CAR-T后第二肿瘤
嵌合抗原受体 T 细胞(CAR-T)疗法已获批用于多种血液肿瘤,包括侵袭性和惰性淋巴瘤、多发性骨髓瘤以及急性淋巴细胞白血病。所有商业产品都包含靶向 CD19 或BCMA的嵌合抗原受体(CAR),关键临床试验均表明可获得高缓解率。此外,CAR-T的治疗范围也扩大到二线甚至一线治疗,包括在实体瘤中也在探索。
CAR-T 产品也可能伴随一种新的毒性作用:第二原发肿瘤(second primary cancers,SPC)(图 1)。
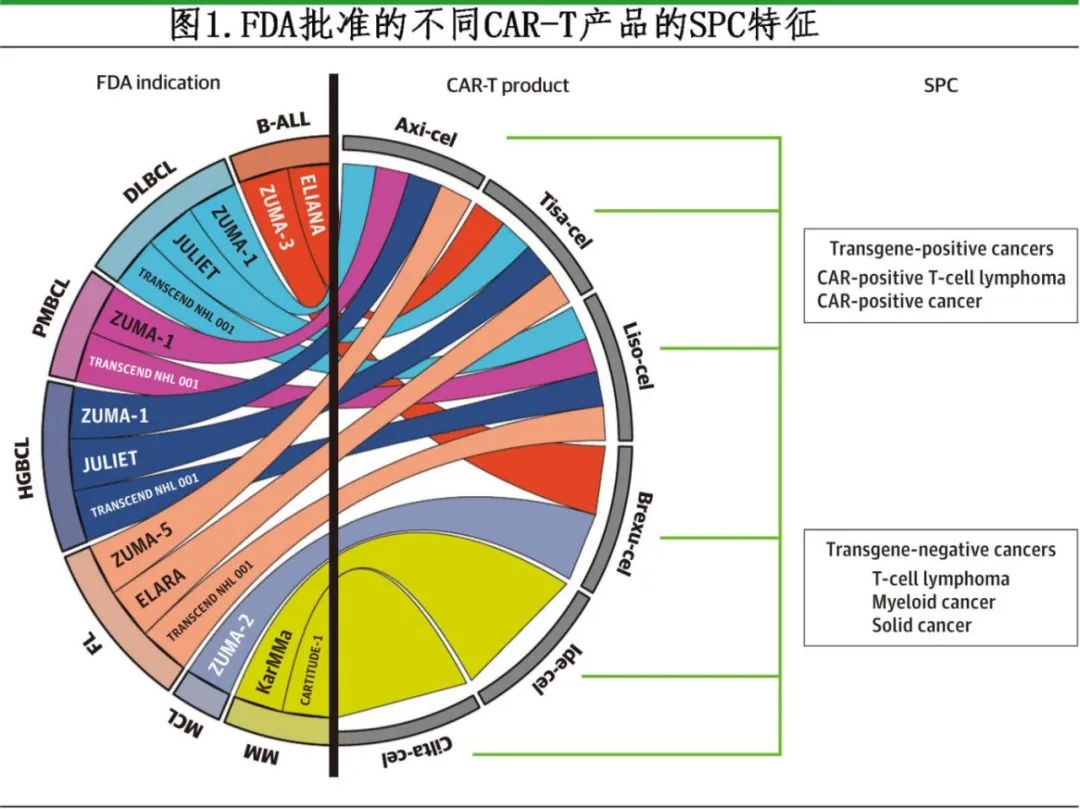
《JAMA Oncology》近日发表综述,讨论了 SPC 的病理生物学、流行病学以及缓解策略。

CAR-T治疗后SPC的病理生物学
CAR-T 产品通过将转基因转导到 T 细胞中制备。在大多数情况下,自体细胞的病毒转导与 T 细胞的遗传健康受损无关,然而慢病毒的半随机基因组整合理论上具有致瘤潜力(图 2A)。
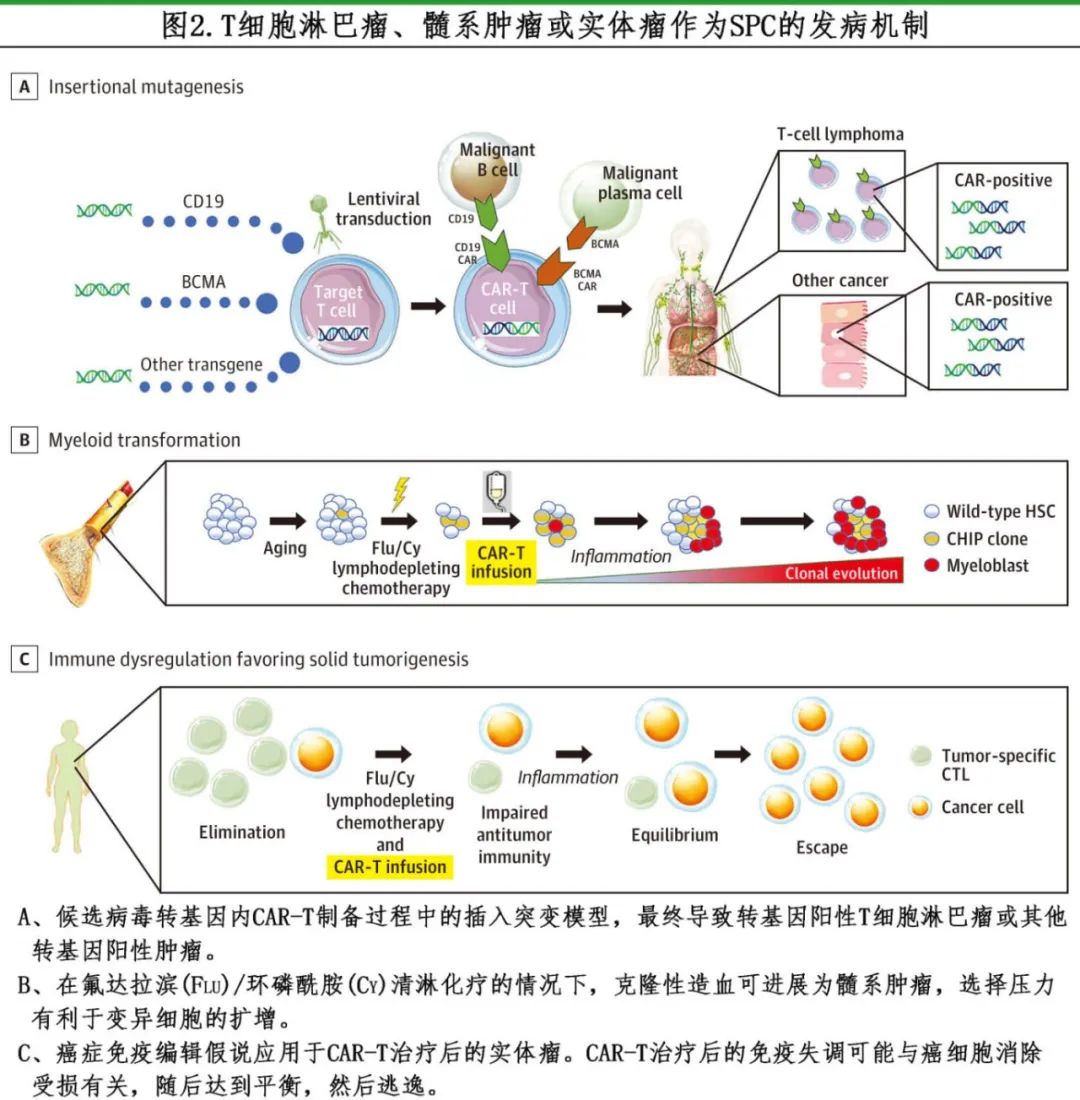
病毒构建体的整合通常发生在 T 细胞基因组内的活跃基因表达位点,可能是染色质内的常染色质,插入诱变可能与转基因阳性肿瘤相关(图2A)。在接受ciltacabtagene autoleucel (cilta-cel)治疗多发性骨髓瘤的患者中,已报道到两例由于插入诱变(导致 T 细胞淋巴瘤)导致的转基因阳性 SPC 病例。Harrison 等报告了1例淋巴结活检结果为 CAR 阳性的肿瘤,作者认为这种罕见肿瘤可能与 NFKB2、TET2、JAK3 或 PTPRB 的体细胞变异相关,并且这些变异可能在 cilta-cel 制备前就存在于克隆中,具有恶性潜能;这些变异存在于用于制备 CAR-T 产品的收集细胞中。CAR 转基因插入 PBX2 的3′非翻译区可能启动了 T 细胞淋巴瘤,但无法证实。另一个病例由 Ozdemirli 等报道,其中信使 RNA 测序证明T 细胞淋巴瘤中存在转基因,在编码 RNA 聚合酶亚基的 SSU72 内含子区域观察到慢病毒插入。插入突变(即转基因阳性肿瘤)引起的 SPC 与易感条件或既往化疗的遗传毒性应激引起的 SPC 有区别。推断转基因阳性 SPC 的发生率远低于转基因阴性肿瘤(表1),但需要确定性研究来证实。
SPC 的概念在髓系文献中有很好的描述,在原发肿瘤暴露于细胞毒性化疗后,治疗相关髓系肿瘤可在造血系统中发生(图2B)。TP53 异常在这些继发性肿瘤中很常见。潜在寿命的延长(特别是在接受化疗的年轻患者中)可能与SPC的风险增加相关,因为SPC的发展需要更长的时间。原发肿瘤患者的死亡可能掩盖了SPC的竞争风险,但CAR治疗后的持久缓解可以揭示SPC的风险。
免疫调节紊乱是 CAR-T 治疗后淋巴细胞耗竭过程的一个标志,而且在这个过程之后,患者的免疫会发生较大变化。随后的免疫功能障碍会削弱抗肿瘤免疫监视机制,并可能导致肿瘤细胞(包括实体瘤细胞)生长(图2C)。在 CAR-T 治疗后,肿瘤免疫编辑可能起作用,对恶性细胞产生免疫耐受。
CAR-T治疗后SPC的流行病学
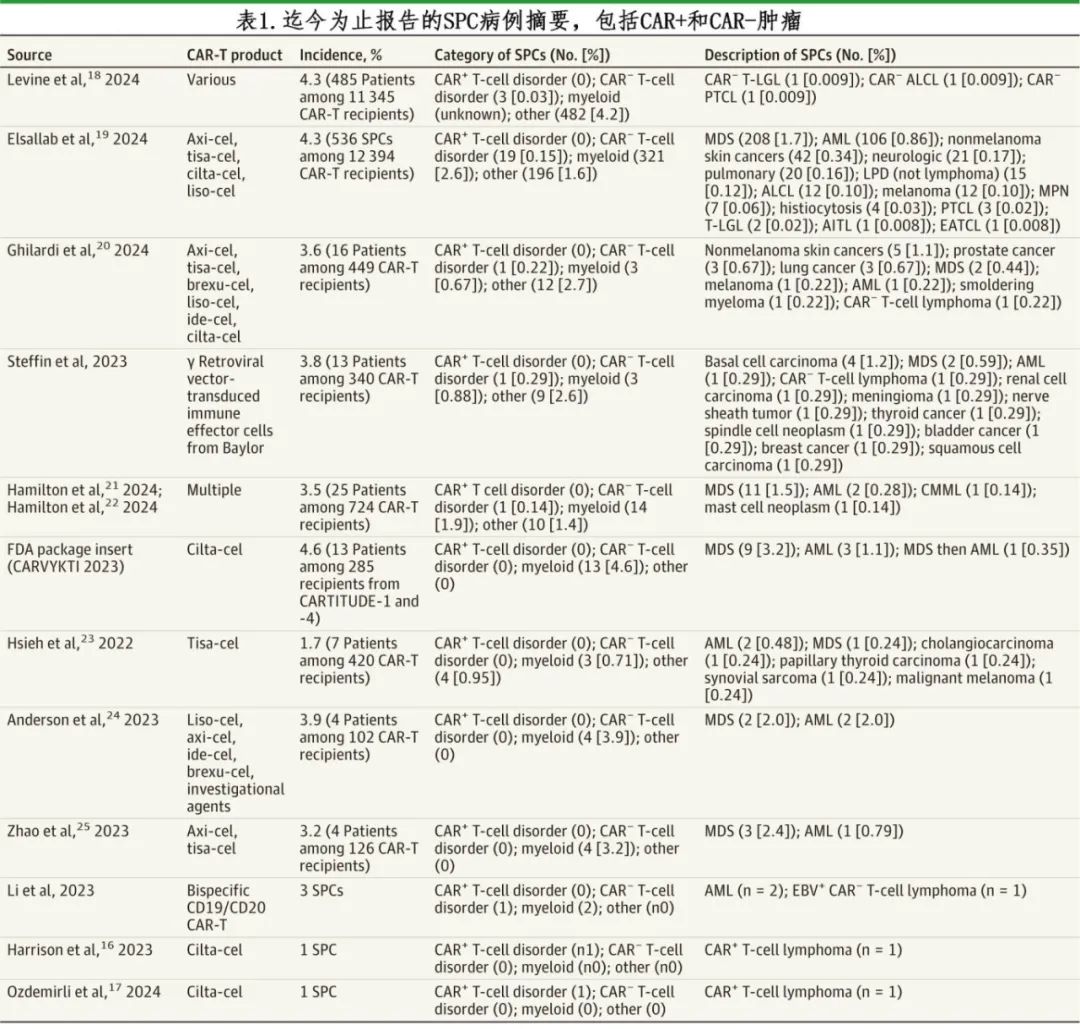
2023 年 11 月,美国FDA收到了约 3 万例 CAR-T 疗法受者中 20 例 CAR-T 治疗后 T 细胞淋巴瘤病例的报告,其中许多 T 细胞肿瘤发生于 CAR-T 治疗后的 24 个月内。随后FDA 发布了关于 CAR-T 疗法致癌潜力的指导意见草案。
2022 年,华盛顿大学牵头的一项多中心回顾性研究报告称,在 420例 CAR-T 细胞疗法受者中有 7 例(1.7%)发生SPC。这些 SPC 诊断中的大多数为实体瘤(表 1)。作者得出结论,SPC 的发生率总体上非常低。
2023 年,Beth Israel Deaconess Medical Center报告称,在 102 例 CAR-T 细胞疗法受者中有 4例(3.9%)出现髓系肿瘤。中国两家医院的一个病例系列显示,在 126 例 CAR-T 细胞疗法受者中有4例患者(3.2%)诊断出继发性髓系肿瘤,包括骨髓增生异常综合征和急性髓系白血病;对这些继发性髓系肿瘤的单细胞 RNA 测序数据显示,肿瘤内部存在转录改变。
2023 年,斯坦福大学的调查人员报告了 CAR-T 治疗接受者中的克隆性造血扩增;这些克隆在 CAR-T 输注前的基线样本中就存在。在 40例在 CAR-T 治疗前后可评估克隆性造血(CH)的患者中,CAR-T 治疗前检测到 46 个 CH 克隆,CAR-T 治疗后检测到 51 个 CH 克隆。耶路撒冷希伯来大学随后报告称,4 例患者在接受 CAR-T 治疗后被诊断为骨髓增生异常综合征,这 4 例患者在接受 CAR-T 治疗前都有分子变异,提示存在基线 CH。目前尚不清楚 CAR-T 治疗是促进现有髓系克隆的扩增还是促进新克隆的发展,目前尚不清楚CAR-T疗法是促进现有骨髓克隆的扩增还是促进新克隆的发展,但目前的数据表明是前者。
2024 年,国际血液和骨髓移植研究中心指出,在总共 11345 例CAR-T 细胞疗法受者中有 485 例患者(4.3%)出现 SPC,3 例报告 T 细胞淋巴瘤;中位随访时间为 13 个月。近期宾夕法尼亚大学报告称,在 CAR-T 输注后出现了 CD8 阳性 T 细胞淋巴瘤。癌细胞内的CAR转基因水平非常低,表明并非转化的CAR-T细胞作为起源细胞;SPC的总体风险为3.6%。与其他报告不一致的是,作者还认为SPC 很罕见(表 1)。
疾病控制和桥接治疗可能在 SPC的流行病学中发挥作用,尤其是在 CAR-T 治疗前进行了多个周期的基因毒性治疗的情况下。在评估 SPC风险时有一个一个混杂变量,那就是桥接化疗通常用于疾病更具侵袭性的患者,而这一组患者很可能接受更多线的前期治疗。
比较未接受CAR-T治疗的患者的SPC风险是值得的,这一点从基于人群的非霍奇金淋巴瘤和多发性骨髓瘤的登记组分析中可以看出。未接受 CAR-T 治疗的患者中 SPC 的发生率因疾病亚组而异,范围为 4%至 20%。基于这些数据,与未接受 CAR-T 的患者相比,CAR-T 细胞受者的 SPC 发生率似乎并不更高。然而应注意,不同研究报告的随访时间各不相同。CAR-T随机临床试验中SPC 的风险(基于 TRANSFORM、CARTI-TUDE-4、ZUMA-7 和 KarMMa-3 试验的主要数据)在 3%至 8%之间;还需要对这些随机临床试验进行更长时间的随访,并专门以 SPC 的发生率为终点。
关于CAR-T治疗后SPC缓解策略的建议
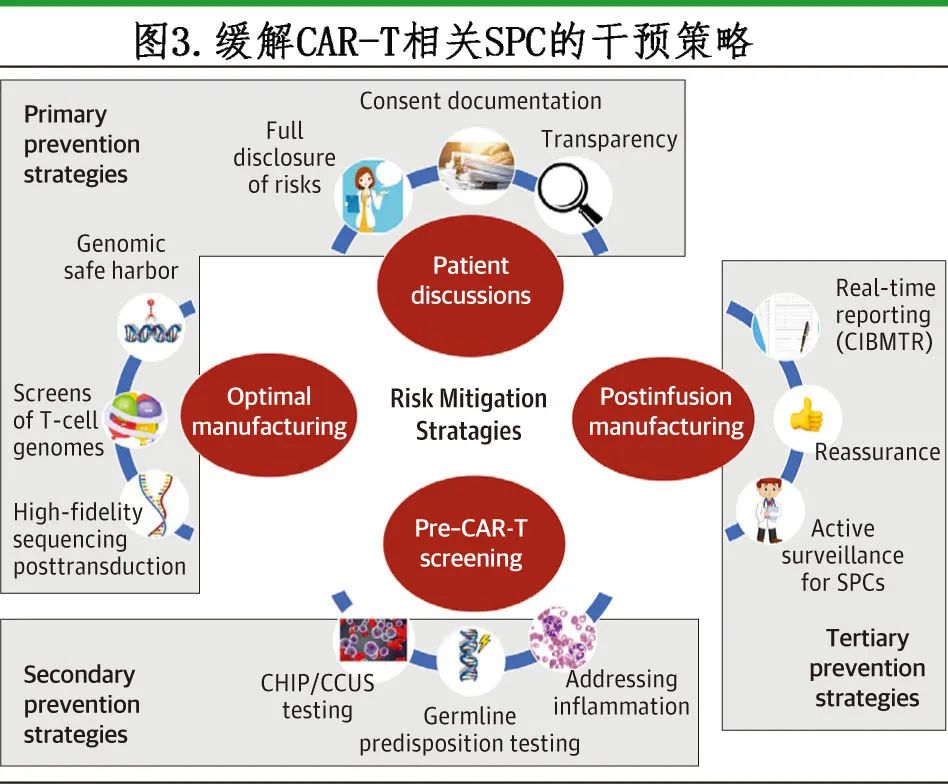
一级预防
缓解SPC风险应始于开放性交流,包括充分披露 CAR-T 治疗后 SPC 较小但明确的风险(图 3)。患者的知情同意文件应承认该风险,包括定量数据,如临床发病率(表 1)。在 CAR-T 治疗前,医生和患者应进行面对面的讨论。患者必须明白,转基因介导的T细胞肿瘤可能发生但风险非常小。
还应披露导致 SPC的其他因素,包括清淋预处理导致的抗癌免疫监视减弱以及化疗带来的细胞毒性应激。CAR-T 治疗后免疫重建的减少似乎在 SPC中起一定作用。随着更早线进行 CAR-T 治疗以及减少基因毒性化疗的使用,SPC的风险可能也会降低。来自 TRANSFORM、CARTITUDE-4、ZUMA-7 和 KarMMa-3 试验(均在二线环境中研究 CAR-T)的数据显示,接受 CAR-T 治疗的患者与标准治疗相比,SPC的风险并未增加。CAR-T 治疗的早期应用可能减少CAR-T 治疗后的免疫重建受损并降低 SPC 风险,但应进行更长期的试验随访以予以确认。
制备方面的考虑因素及基因组安全港的识别
病毒载体的半随机整合对插入诱变构成威胁,根本问题在于非特异性整合到不稳定位点。一些靶基因在受到 CAR 转基因插入的扰乱时,与 CAR-T 细胞的克隆性增殖有关,这些基因包括 CBL 原癌基因 B(CBLB)和四甲基嘧啶二加氧酶 2(TET2)。例如CAR 转基因插入 PBX2 基因3′非翻译区与cilta-cel治疗后 T 细胞淋巴瘤的发生有关。诱变能力可能取决于靶位点的两个主要特征:易感性和致病性。基因组易感性必须有助于 CAR 转基因的插入,并且该位点在功能上必须致病,以诱导转基因阳性细胞的转化和克隆性细胞增殖。
从制备的角度出发,可以提出特定的风险缓解方法。首先,非病毒基因治疗可以将插入诱变风险最小化。例如CRISPR-Cas9 基因编辑系统已用作将基因插入 T 细胞基因组的替代来源,并且该系统能够敲入 CAR cassette。新型编辑技术可以将理想的治疗性转基因植入T细胞,与基于病毒的技术相比,非随机整合的风险可能较低。位点特异性敲入可以使CAR整合到安全位点,碱基编辑也可以用来产生具有独特功能的有效CAR-T细胞,此外转座子系统也进行了研究,尽管似乎前景不佳。
此外,在转导含 CAR 病毒到 T 细胞之前,确定安全港位点(harbor sites)可能有价值。标准操作程序需要包括检查点,以确保转基因已整合到安全港,或者至少确保整合未发生在关键抑癌基因或介导 T 细胞转化的癌基因中。当前的 CAR-T 学者可能需要与能够及时对转导后的自体产品进行高保真测序的生物技术企业合作。这种转导后测序的两个主要缺点包括成本和时间,可能会给 CAR-T 疗法的整体采购和管理过程增加经济障碍。此外,转导后测序可能会延迟产品对患者的使用,患者在等待 CAR-T 输注期间可能需要接受额外的桥接治疗。
二级预防
不分适合接受 CAR-T 治疗的患者,根据其既往的健康状况,本身就有发生CAR-T 后SPC的风险,必须考虑二级预防策略。已在存在基线CH的患者中发现了 CAR-T 治疗后的 SPC,基线 CH 会增加患髓系肿瘤的风险,而与 CAR-T 治疗相关的清淋化疗过程可能会对造血功能产生不利影响。在细胞疗法领域,特别是在干细胞移植中,关于在异基因干细胞移植前对供者进行 CH 筛查尚存在争议。细胞治疗前的CH筛查需考虑个体化和全系统风险-获益。对于在 CAR-T 治疗前进行自体 CH 筛查的文献有限,因为刚刚开始了解清淋和 CAR-T 治疗前存在基线 CH 的潜在后果,这些患者患治疗相关髓系肿瘤的风险可能会增加。
可以考虑对 CAR-T 候选者进行 CAR-T 治疗前的骨髓活检,并进行髓系变异检测。对 CAR-T 候选者进行基线造血系统 CH 筛查的优点包括能够确保健康淋巴细胞的动员和单采,以及能够提供详细的基因组信息,从而在 CAR-T 输注前证明患者的造血健康状况。CAR-T 受者进行 CH 筛查的缺点包括:缺乏共识指南的正式管理建议;对于无已知髓系疾病的患者,即使存在致病变异但干预能力有限;对所有 CAR-T 候选者进行髓系特异性基因二代测序相关成本;发现髓系变异对患者造成的心理伤害;由于患者等待二代测序检测结果而延迟 CAR-T 治疗的实施,等等。
对于基线存在CH的患者,目前尚无共识性指南支持或反对CAR-T 治疗。存在潜能未定的CH(CHIP)或意义未明的克隆性细胞减少症不应排除 CAR-T 治疗,因为原发疾病存在死亡的竞争风险。未来的研究可能需要解决与CH相关的特定协变量,这些协变量可能与CAR-T受体的临床结局不良相关;感兴趣的协变量示例可能包括:CHIP或意义未明的克隆性血细胞减少症诊断时的年龄、变异基因、变异等位基因频率以及髓系细胞内并发变异的数量。
胚系易感性的筛查
遗传易感性是评估 CAR-T 治疗后发生 SPC 可能性时的一个考虑因素(尽管其影响较小)。携带胚系变异的患者在接受 CAR-T 治疗前,其基因组的完整性可能已受损。清淋化疗或将慢病毒转导到具有一个缺陷等位基因的关键基因的第二份拷贝中,都可能导致基线基因组完整性受到破坏。在 2022 年的一份早期报告中,一例携带胚系 TP53 变异的患者在 CAR-T 治疗后出现SPC,而且似乎基线易感综合征(predisposition syndrome)与 SPC 的发生有关。基线检测胚系易感综合征可转移发生 SPC 的风险。在决定 CAR-T 治疗时应考虑对 SPC 的易感倾向,但不一定排除 CAR-T 治疗;CAR-T 治疗可能是治愈性的,而放弃 CAR-T 治疗留给患者的选择并不多。鉴于关于这个话题的权威文献有限,相关决策最好根据个体情况做出。虽然存在发生 CHIP 的风险,但原发肿瘤死亡的竞争风险很高,对于侵袭性淋巴瘤,通常在 60%左右。如果对这些患者进行细胞治疗,可以考虑接受 SPC 的积极监测。目前正在进行几项研究,以确定可能患 SPC 风险极高的患者。
基线炎症评估及一般健康筛查
额外的二级预防措施可能包括定期通过体格检查、实验室检查或影像学检查进行筛查。基于人群的二级预防一直是早期识别各种肿瘤(如结肠癌、乳腺癌或宫颈癌)的标志,然而对于接受 CAR-T 治疗的患者,目前尚无常规的筛查指南。在 CAR-T 融合前后,已知的筛查方法(如乳腺 X 线摄影或结肠镜检查)的作用还是待定。需要进行前瞻性研究,以确定高危人群和筛查频率。
炎症是已知的致癌触发因素,对抗炎症可能有助于预防恶性髓系细胞的克隆性增殖。在许多情况下,患者本身就有合并炎症性疾病的基线合并症,如并发风湿性疾病、自身免疫性疾病或慢性感染。对于计划接受 CAR-T 治疗的部分患者,可以考虑采用二级预防策略,旨在早期检测风险(如评估基线红细胞沉降率、C反应蛋白水平和铁蛋白)或抑制炎症反应。还需要前瞻性数据来了解旨在减轻炎症的干预措施的获益与风险。
三级预防
可靠地报告 SPC 是三级预防的有效形式,应在所有机构中予以鼓励,以确保向公众充分呈现数据。确定偏差和报告偏差可能会扭曲 SPC 发病率的评估(表 2)。目前的文献在报告 SPC 时中位随访时间非常短,如果允许足够长的中位随访时间,SPC 的真实发病率可能会更高。随访时间的长短偏差也可能在不经意间与报告参数有关。患有无症状和进展缓慢的 SPC 的患者可能未诊断出SPC。

全球的细胞治疗中心应承担准确报告 CAR-T相关SPC 的责任,SPC 的发生率可视为维持安全标准的一个指标。报告最好通过像国际血液和骨髓移植研究中心这样的中央登记组进行。此外,SPC 的亚型也可以报告,因为侵袭性 SPC 与惰性 SPC 非常不同。报告CAR-T 相关T 细胞肿瘤的亚型尤为重要,因为我们才刚刚开始了解非故意的转基因插入是否是致因。在未来 2 到 3 年期间,一旦有更多的报告数据可用,T 细胞肿瘤的范围可能会更广。可以考虑在所有学术中心制定国家级报告要求,以便该领域有更多的原始数据来得出具有临床意义的结论。
可以理解,关于 CAR-T 相关 SPC的这一新信息可能会引发相当大的社会心理困扰。鉴于 CAR-T 治疗后 SPC的总体风险较低,在大多数情况下可能需要给予慰藉。几乎所有病例系列都一致报告称,SPC的发生率低于 5%(表 1)。转基因阳性 T 细胞淋巴瘤的发生率甚至更低,可能只有百分之一。关于 CAR-T 治疗的决策必须在 CAR-T 相关 SPC的风险与诱导原发血液肿瘤深度和持久缓解的获益之间进行权衡。最佳的临床判断可能会告诉我们,与原发肿瘤进展的风险相比,SPC 的风险似乎极小。美国FDA认为,针对原发肿瘤的 CAR-T 疗法的总体获益超过 CAR-T 相关 SPC 的风险。对于特别担心 SPC风险的患者,个性化方法可能是最好的选择,共享决策可能有较高意义。
CAR-T 输注后应积极监测 SPC。建议包括美国国家综合癌症网络在内的共识小组以及疾病聚焦合作小组出台 CAR-T 输注后早期检测策略的指南。积极监测策略可能包括常规的体格检查、生物标志物检测或按预先指定的时间间隔进行影像学检查。在 CAR-T 治疗后,如果 SPC的基线评估风险较高,诊断工作应考虑全身PET/CT扫描、外周血流式细胞术以及 T 细胞亚群分析。通过在下一版WHO分类方案中纳入这些 SPC 的新疾病亚型(或诊断限定词),可以提高对 CAR-T 治疗后 SPC 的认识,可能有助于广大临床医生群体正式意识到这种风险。
结论
近期关于 CAR-T SPC 的最新消息在公众及CAR-T 疗法的医生和科学家中引起恐慌,但也为原创研究和风险缓解带来机会。2025 年,对 CAR-T 产品的优化设计可能是当务之急,也是防止更多事件的第一步。在医生和科学家开发下一代 CAR-T 产品时,确定 T 细胞基因组中遗传安全港的重要性也不容小觑,位点特异性转基因整合可能是接下来最有价值的总体方法。尽管CAR-T疗法与SPC的发展之间存在关联,但除了罕见的转基因阳性T细胞淋巴瘤病例外,在很大程度上缺乏因果关系。
CAR-T 疗法的治疗范围正在扩展到自身免疫性疾病,但关于这一患者群体中 SPC 发病率的数据仍有待观察。目前缺乏关于自身免疫性疾病适应症 CAR-T 治疗后 SPC 风险的报告数据。对于有肿瘤适应症的 CAR-T 受者,目前SPC 风险相对较小,不应必然削弱将细胞疗法应用于自身免疫性疾病的热情。SPC 是一个特别值得关注的不良事件,因此应密切关注,但鉴于与肿瘤患者相比,自身免疫性疾病患者接受的化疗暴露、基因毒性药物暴露以及维持治疗(如免疫调节剂)的暴露要少得多,预计自身免疫性疾病 CAR-T 接受者的风险也更低。
总之,针对原发肿瘤的 CAR-T 疗法的获益似乎超过发生 SPC 的小风险,在大多数情况下。对美国FDA不良事件报告系统的分析得出结论,SPC 的发生率仅为 4.3%,与放弃 CAR-T 疗法的机会成本相比,这一比例仍然相对较低。鉴于 SPC的风险极小且缺乏明确的因果关系证据,作者倾向于在临床上有指征时进行 CAR-T 治疗。目前还没有记录在案的髓系肿瘤病例是由转基因阳性造血干细胞/祖细胞在髓系特异性位点插入转基因后克隆扩增引起的。期待对该主题进行进一步研究,并最终鼓励该领域优化 CAR-T 设计,以便 CAR-T 疗法能够继续在全球市场提供高价值的个性化肿瘤。
参考文献
Patel SA, Spiegel JY, Dahiya S. Second Primary Cancer After Chimeric Antigen Receptor–T-Cell Therapy: A Review. JAMA Oncol. Published online December 12, 2024. doi:10.1001/jamaoncol.2024.5412
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#CAR-T治疗# #第二原发肿瘤#
4