【BMT】徐开林/潘彬教授等发表综述:非霍奇金淋巴瘤CAR-T治疗后复发的机制及策略
22小时前 聊聊血液 聊聊血液 发表于陕西省
徐开林等教授发文总结 CD19 CAR-T 细胞治疗 B 细胞非霍奇金淋巴瘤后复发机制、治疗失败后的方案等。
CAR-T复发后策略
多款CD19 CAR-T 细胞在 B 细胞非霍奇金淋巴瘤(NHL)中获得较高缓解率,包括复发/难治性弥漫性大 B 细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)、滤泡性淋巴瘤(FL)和边缘区淋巴瘤(MZL)。徐州医科大学附属医院徐开林教授和潘彬教授等近日于《Bone Marrow Transplantation》发表文章,总结了来自临床试验和真实世界数据的长期结局,确定了与疗效相关的协变量,分析了复发机制,讨论了复发策略,并总结了 CAR-T 细胞治疗失败后的治疗方案数据。现整理主要内容供参考。

CD19 CAR-T细胞治疗后复发的机制
在接受 CD19 CAR-T 细胞治疗的 B 细胞非霍奇金淋巴瘤患者中,相当一部分患者最终会进展或复发。在 ZUMA-1、JULIET 和 TRANSCEND NHL 001研究中,46%至60%的患者未达到完全缓解。在 ZUMA-1中,50%的晚期弥漫性大 B 细胞淋巴瘤患者在中位随访 15 个月时进展。在 JULIET中,93例晚期弥漫性大 B 细胞淋巴瘤患者总缓解率为 52%,1 年复发率为 35%。未达到完全缓解的患者包括对 CD19 CAR-T 细胞治疗耐药的患者,以及短暂缓解但迅速进展的患者,部分患者会在达到完全缓解后复发。
复发包括CD19 阳性和阴性复发,与复发相关的不同机制见图 1。对初始治疗的原发难治通常类似于 CD19 阳性复发,原因包括CAR-T 细胞功能差和/或免疫抑制性肿瘤微环境;原发难治也可能源于 CAR-T 细胞的制备和扩增失败。本文重点关注 CD19 阳性或 CD19 阴性复发的机制,以及可能预防复发的策略。
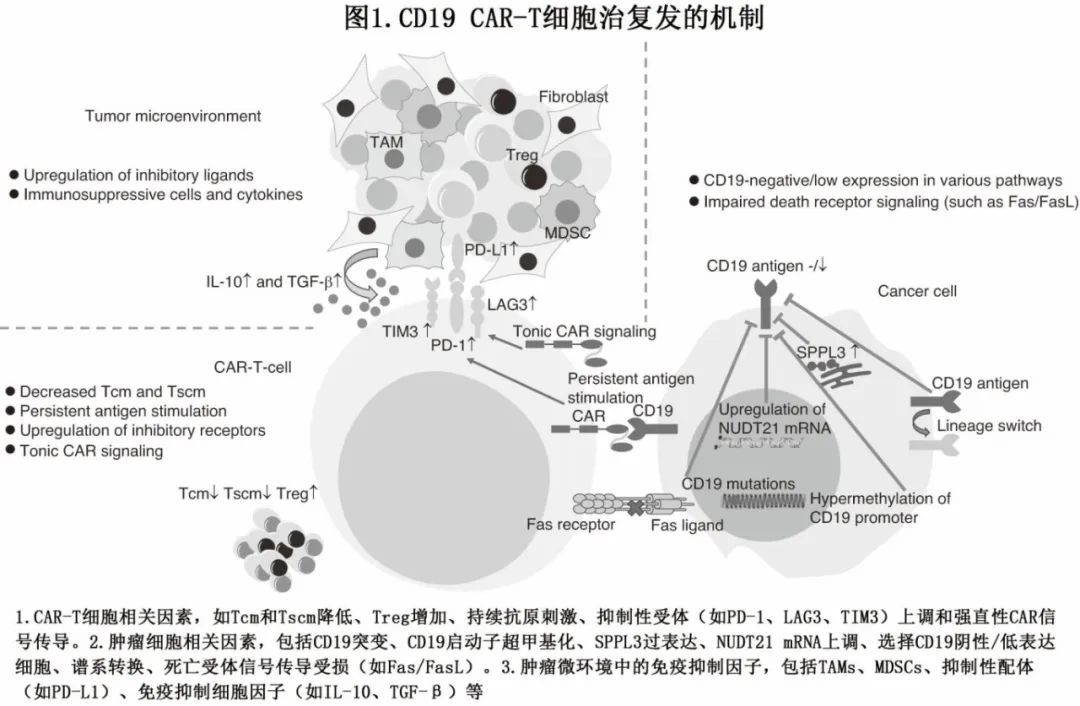
CD19阳性复发的机制
CD19 阳性复发主要是由体内 CAR-T 细胞的持久性差或功能障碍所引起。CAR-T 细胞的持久性与针对靶细胞的持续疗效密切相关。中央记忆 T 细胞和干细胞记忆 T 细胞的分化程度较低,与分化程度较高的效应 T 细胞相比,具有更优的持久性。此外,抗 CD19 CAR-T 细胞的多功能性(polyfunctionality,产生一系列细胞因子的能力)也与非霍奇金淋巴瘤患者临床结局的改善相关。调节性 T 细胞可抑制 T 细胞的抗肿瘤效应,与 CAR-T 细胞的反应呈负相关。持续的抗原刺激、持续的 CAR 信号传导以及抑制性受体的上调可能会导致 CAR-T 细胞功能障碍或耗竭。
CD19 CAR-T 细胞持久反应不佳和抗肿瘤效率低下的另一个最常见原因可能是淋巴瘤的生物学侵袭性,尤其是在既往多线治疗失败之后。大量淋巴瘤细胞可以产生免疫抑制性淋巴瘤内微环境,其中包含大量的免疫抑制性配体、细胞因子和细胞。肿瘤细胞中的死亡受体信号受损可导致抗CD19 CAR-T细胞毒性失效。通过在肿瘤细胞中使用基于 CRISPR/Cas9 的全基因组功能缺失筛选,发现肿瘤细胞中 Fas 相关蛋白死亡结构域表达的降低可损害CAR T 细胞的效应功能。
通过抑制 TET2、HPK1 和 RASA2,或过表达 JUN、BCL-2 和 TRAF,可以增强抗 CD19 CAR-T 细胞的抗肿瘤效果和持久性。通过在 CD3ζ 结构域中突变免疫受体酪氨酸基激活基序 1(ITAM1)和 ITAM2,可延长基于 CD28 的抗 CD19 CAR-T 细胞的持久性。与小鼠来源的单链可变片段(scFv)相比,人源 scFv 显示出较低的抗原性和增强的 CAR-T 细胞持久性。通过结合 4-1BB 和 CD28,第三代 CAR-T 细胞具有更好的疗效和更长的持久性。通过在 CAR 细胞质结构域中突变赖氨酸抑制泛素化介导的 CAR 降解,可增加 CAR-T 细胞的持久性。在 CAR-T 细胞培养中添加 IL-15 可促进 CAR-T 细胞的扩增并增加记忆表型,同时增加持久性。在疾病早期采集 T 细胞或缩短 CAR-T 细胞的培养时间也可增加持久性。分泌程序性死亡 1(PD-1)阻断 scFv 的 CAR-T 细胞可抵消PD-L1 的作用,并提高CAR-T 细胞和旁观者 T 细胞的抗肿瘤活性,研究证实表达 PD-1/CD28 开关受体的 CAR-T 细胞可增强杀伤 PD-L1 阳性 B 细胞淋巴瘤细胞的能力。细胞毒 T 淋巴细胞相关蛋白 4 的基因缺失可增强抗 CD19 CAR-T 细胞的抗肿瘤功效。
CD19阴性复发的机制
CD19基因突变可导致 CD19 抗原缺失,在 CD19 CAR-T 细胞治疗后的 CD19 阴性复发中较为常见。抗 CD19 CAR-T 细胞无法杀死具有跨越 CD19 位点的半合子缺失、CD19 外显子 2 的新生移码突变和错义突变以及 CD19 mRNA 的替代剪接的白血病细胞。在白血病原始细胞中存在不含外显子 2 的 CD19 mRNA 异构体,可逃避 CAR-T 细胞的识别。CD19 阴性复发是 CAR-T 细胞选择性杀伤 CD19 阳性肿瘤细胞的结果,保留CD19 阴性/低表达细胞。表观遗传和转录后修饰也对 CD19 表达有显著影响。基因启动子的高甲基化导致 CD19 表达缺失。由于信号肽肽酶样 3(一种高尔基体驻留的膜内蛋白酶)缺失导致 CD19 高糖基化,抑制CAR-T 细胞介导的细胞毒性。RNA 结合蛋白 NUDT21 通过调节 CD19 mRNA 的聚腺苷酸化和稳定性来限制 CD19 表达。NUDT21 的上调与复发时 CD19 的缺失相重叠。
谱系转换也会导致 CD19 抗原缺失,包括慢性淋巴细胞白血病、套细胞淋巴瘤、B 细胞急性淋巴细胞白血病中均有报道。在制备 CAR-T 细胞期间,CAR 基因可能偶然转导到白血病 B 细胞中,导致异常表达的 CAR 与 CD19 结合并掩盖 CD19 抗原表位。
靶向其他 B 细胞特异性抗原(如 CD20 和 CD22)可能有助于预防 CD19 阴性复发,具体策略包括双特异性或多特异性 CAR-T 细胞,或者通过改变 CAR-T 细胞的靶点。
CD19 CAR-T细胞治疗失败后的治疗方案
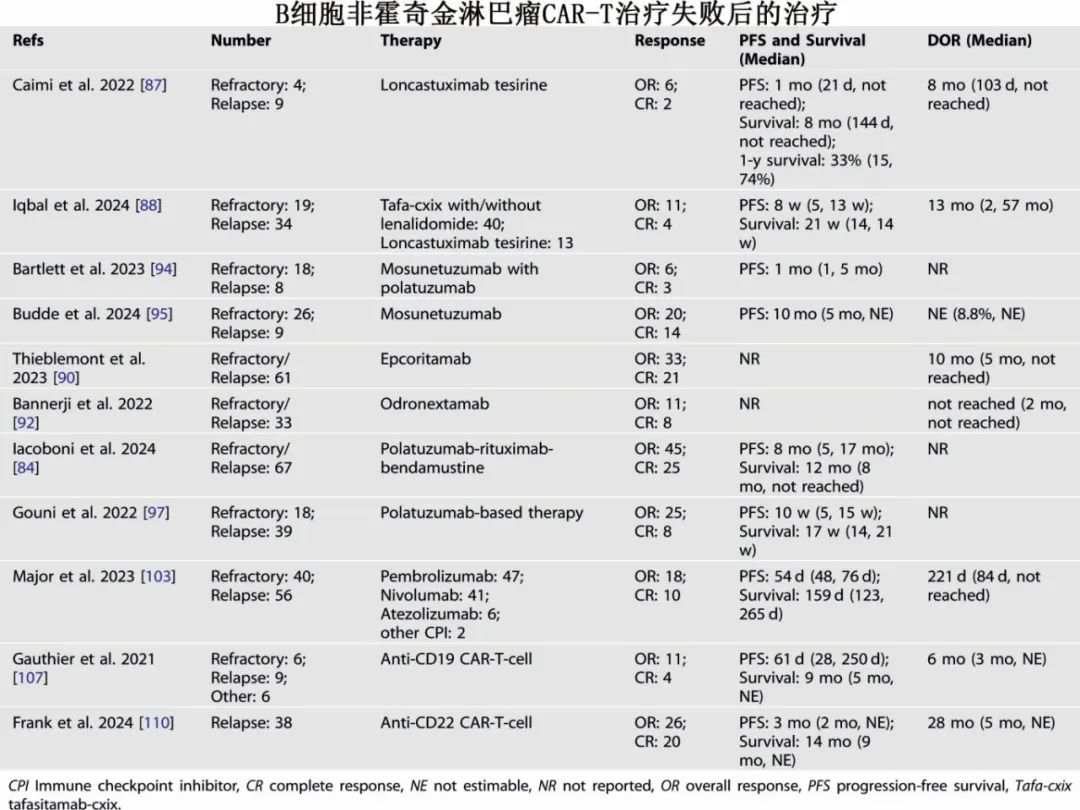
对于 CD19 CAR-T 细胞治疗失败的患者,目前尚无标准治疗方案。原发性难治或 CD19 CAR-T 细胞治疗复发的患者往往疾病进展迅速,且此前接受过广泛的治疗。CD19 CAR-T 细胞治疗失败后,部分患者可能获益于异基因移植或其他治疗(如重复输注 CAR-T 细胞)。大多数报告未区分原发性难治和复发患者的干预措施及结果。在有限的临床试验和回顾性分析中,异基因移植似乎比其他干预措施更有效,然而疾病、临床状况和其他因素导致大多数患者无法接受异基因移植。关于单抗和双特异性抗体的研究有 10 项,关于抗体药物偶联物的研究有 6 项;大多数研究中患者数量少、异质性大,诊断和既往治疗各不相同。基于抗体的治疗效果有限,导致 CAR-T 细胞疗法失败的因素在抗体疗法失败方面也可能起作用。
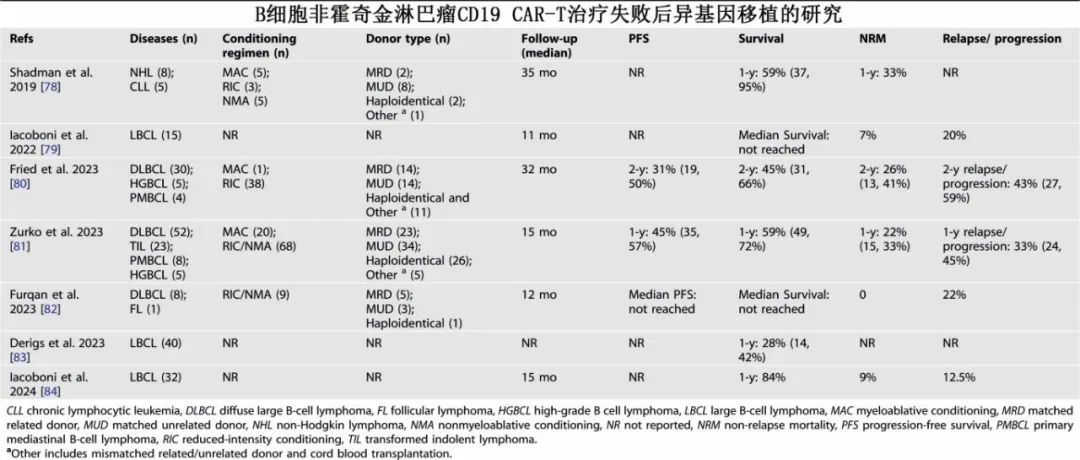
异基因造血干细胞移植
在 CIBMTR一项研究中,174 名血液学家中有 88.5%倾向于在 CAR-T 细胞治疗失败后进行异基因移植。B 细胞非霍奇金淋巴瘤抗 CD19 CAR-T 细胞治疗失败后异基因移植的报告中,1 年生存率为 28-84%,大多数患者在异基因移植中接受减低强度或非清髓性预处理方案。对于部分抗 CD19 CAR-T 细胞治疗失败的晚期弥漫性大 B 细胞淋巴瘤患者,异基因移植可带来持久缓解。
基于抗体的疗法
CD19 单克隆抗体和抗体药物偶联物。tafasitamab-cxix(CD19单克隆抗体)单药或联合来那度胺、loncastuximab tesirine(CD19抗体药物偶联物)均有报道,但整体疗效有限。
CD20双特异性抗体。有多种 CD20 双特异性抗体获批用于治疗晚期 B 细胞非霍奇金淋巴瘤,部分在CAR-T治疗失败的患者中有效。一项纳入34例 CAR-T 细胞治疗失败的晚期弥漫性大 B 细胞淋巴瘤患者的多中心研究中,双特异性抗体治疗的总缓解率和完全缓解率分别为 51%和 36%,中位无进展生存期为 5 个月,中位生存期为 14 个月。一项荟萃分析研究了双特异性抗体对接受过或未接受过 CAR-T 细胞治疗的晚期弥漫性大 B 细胞淋巴瘤的疗效,合并完全缓解率为 36%;未接受过 CAR-T 细胞治疗的患者中完全缓解率为 37%,接受过 CAR-T 细胞治疗的患者完全缓解率推断为<36%。在一项 1 期研究中,19 例患者接受mosunetuzumab 治疗,包括 4 例晚期惰性非霍奇金淋巴瘤患者和 15 例CAR-T 细胞治疗失败的患者,结果7 例患者缓解,其中 5 例完全缓解。在一项 1/2 期研究中,26 例 CAR-T 细胞治疗失败的晚期 LBCL 患者接受mosunetuzumab 治疗;3 例完全缓解,3例部分缓解,3例在 1 年时无复发。在一项 1/2 期研究中,35 例晚期弥漫性大 B 细胞淋巴瘤患者接受mosunetuzumab联合维泊妥珠单抗,中位无进展生存期为 10 个月;26 例 CAR-T 细胞治疗耐药患者的中位缓解持续时间为 13 个月,中位无进展生存期为 6 个月。在一项 1/2 期研究中,61例晚期 LBCL 患者接受epcoritamab(CD3xCD20双特异性抗体)治疗,总缓解率和完全缓解率分别为 54%和 34%;中位随访<1年,中位缓解持续时间为 10 个月。在 NP30179 1/2 期研究中,51例 CAR-T 细胞治疗失败的晚期弥漫性大 B 细胞淋巴瘤患者接受奥妥珠单抗联合或不联合格菲妥单抗;18 例患者完全缓解。在 ELM-1 1 期研究中,33 例晚期弥漫性大 B 细胞淋巴瘤患者接受 odronextamab(CD3xCD20双特异性抗体),11例患者获得缓解,其中 8 例完全缓解;中位缓解持续时间未达到。
CD79b抗体药物偶联物。在一项回顾性研究中,67 例晚期弥漫性大 B 细胞淋巴瘤患者接受维泊妥珠单抗-利妥昔单抗-苯达莫司汀治疗,总缓解率和完全缓解率分别为 67%和 38%,中位无进展生存期为 8 个月,中位生存期为 12 个月。在一项回顾性研究中,29 例晚期大B细胞淋巴瘤患者接受基于维泊妥珠单抗的治疗方案,其中 10 例完全缓解,4 例部分缓解,1 年生存率为 37%。在一项回顾性分析中,57 例在 CAR-T 细胞治疗后出现难治性(n=18)或复发性(n=39)的大B细胞淋巴瘤患者接受维泊妥珠单抗联合利妥昔单抗或苯达莫司汀治疗,总缓解率和完全缓解率分别为 44%和 14%;中位随访 47 周,中位无进展生存期为 10 周,中位生存期为 17 周。
免疫检查点抑制剂
2 期JULIET研究评估了与 T 细胞耗竭相关的标志物,如 PD-1、LAG3 和 TIM3。在 PD-1-PD-L1 相互作用评分最高的 5例患者中,4例对 tisa-cel 无反应,1例在 3 个月时复发;在 LAG3 阳性 T 细胞百分比最高的 11例患者中,7 例无反应,4 例在 6 个月内复发。在临床前研究和临床病例报告中,免疫检查点抑制剂疗法在体外和体内均可逆转 T 细胞耗竭,并增强 CAR-T 细胞的疗效。在一项 1/2 期研究中,12例晚期 B 细胞非霍奇金淋巴瘤患者接受帕博利珠单抗治疗;3例患者缓解,包括1例完全缓解。一项15 个美国中心的研究中,96例晚期 B 细胞非霍奇金淋巴瘤患者接受抗 PD-1或抗PD-L1 抗体治疗,总缓解率为 19%,完全缓解率为 10%,中位无进展生存期和生存期都很短,分别为 54 天和 159 天。11 例在 CD19 CAR-T 细胞治疗后未完全缓解的晚期弥漫性大 B 细胞淋巴瘤患者接受纳武利尤单抗治疗;之前对 CAR-T 细胞有反应的 6 例患者中有 4 例获得完全缓解,而5 例无反应者中无一例完全缓解。在 CAR-T 细胞治疗中会发生 T 细胞耗竭,且其与疗效呈负相关。然而,在 CAR-T 细胞治疗失败后,单独靶向 PD-1 大多无效;其他抑制性受体也可导致 T 细胞耗竭,对这些抑制性受体进行联合靶向可增强抗肿瘤效果。
重复CAR-T细胞输注
CD19 CAR-T 细胞。在 ZUMA-1 研究中,13例CD19 抗原阳性晚期弥漫性大 B 细胞淋巴瘤患者在首次输注 axi-cel 后接受了二次输注;7 例患者缓解,4 例完全缓解,中位缓解持续时间为 81 天。在一项 1/2 期研究中,21 例首次输注 CD19 CAR-T 细胞治疗失败的晚期 B 细胞非霍奇金淋巴瘤患者接受二次输注,在第二次输注前,8 例患者的 CD19 抗原呈阳性,4 例减少;3 例未进行评估,10 例无缓解,11 例缓解,包括4 例完全缓解,中位随访 43 个月,中位无进展生存期和生存期分别为 61 天和 9 个月。一项研究中,6 例 CD19 CAR-T 细胞治疗后进展的晚期弥漫性淋巴瘤患者接受表达 PD-1/CD28 嵌合开关受体的 CD19 CAR-T 细胞治疗(CD19-PD-1/CD28-CAR);3 例完全缓解,1 例疾病稳定,但疗效是来自 CD19 CAR-T 细胞还是 PD-1/CD28 嵌合开关受体尚不清楚。对于首次 CD19 CAR-T 细胞输注治疗失败的患者,第二次 CD19 CAR-T 细胞输注大多无效。针对新的 CD19 表位或具有修饰的效应模块的 CD19 CAR-T 细胞还需要进一步研究。
CD20 CAR-T 细胞。在一项 1 期研究中,14例晚期弥漫性大 B 细胞淋巴瘤患者在 CD19 CAR-T 细胞治疗失败(抗 CD19 治疗,n=12;抗 CD19/CD22 治疗,n=1;抗 CD19/CD79b 治疗,n=1)后接受CD20 CAR-T 细胞(C-CAR066)治疗;8 例患者完全缓解,5 例患者部分缓解,4 例患者在 2 年时仍处于完全缓解状态,中位无进展生存期为 9 个月,中位随访时间为 20 个月。在初始 CD19 CAR-T 细胞治疗失败后,CD20 CAR-T 细胞能使部分晚期大B细胞淋巴瘤患者产生持久反应。
CD22 CAR-T 细胞。在一项多中心 1 期研究中,38 例晚期淋巴瘤患者接受 CD22 CAR-T 细胞治疗,其中包括 37 例在 CD19 CAR-T 细胞治疗后复发以及 1 例在自体移植后复发;总缓解率和完全缓解率分别为68%和 53%,中位缓解持续时间为 28 个月,中位无进展生存期为 3 个月,中位生存期为 14 个月,中位随访时间为 23 个月。一项研究中,7 例晚期弥漫性大B细胞淋巴瘤(包括疾病稳定或进展)患者接受 CD22 CAR-T 细胞治疗;4 例完全缓解,2例部分缓解,180 天无进展生存率和总生存率均为 67%。CD20 和 CD22 CAR-T 细胞可能是 CD19 CAR-T 细胞治疗失败后的有效疗法,且仍在研究中。
靶向多种抗原的CAR-T细胞。在一项 1/2 期研究中,4 例 CD19 CAR-T 细胞治疗后复发的晚期 B 细胞非霍奇金淋巴瘤患者接受 CD19 和 CD22 CAR-T 细胞治疗;2例完全缓解,1 例部分缓解。在一项 1/2 期研究中,9 例晚期 B 细胞非霍奇金淋巴瘤患者接受双特异性 CD19/CD20 CAR-T 细胞治疗; 6 例完全缓解,1 例部分缓解,3例完全缓解患者复发,缓解持续时间分别为 6 个月、20.5个月和 24.6个月。靶向不同抗原的 CAR-T 细胞可能对部分 CD19 CAR-T 细胞治疗失败的患者有效,但相关数据较少。如果存在肿瘤免疫抑制性微环境,第二次 CAR-T 细胞输注可能无效,但如果第一次输注无效是因为 CAR-T 细胞存在缺陷或数量不足,第二次输注可能会有效。
总结
尽管 CD19 CAR-T 细胞在 CD19 阳性淋巴瘤的治疗中显示出令人瞩目的安全性和有效性,但仍有相当比例的患者无反应或复发。后续治疗仍存在争议,并且相关研究较少,且这些研究大多样本量不足和给予多种干预措施。CD19 CAR-T 细胞治疗失败的机制复杂、定义不明确,且在不同患者中有所不同。因此,不太可能任何一种挽救性干预措施对每个患者都有效,需要根据 CD19 CAR-T 细胞治疗失败的原因进行个性化管理。无论失败机制如何,首次 CD19 CAR-T 细胞输注治疗失败后适合移植患者可能会从异基因移植中获益,异基因移植具有直接抗淋巴瘤作用,并可能重建肿瘤和骨髓免疫微环境。基于初始 CD19 CAR-T 细胞治疗失败的机制(如先前输注的 CD19 CAR-T 细胞不足或失活),基于抗体的干预措施和重复输注 CD19 CAR-T 细胞可能仅对部分患者有效。总之,晚期 B 细胞非霍奇金淋巴瘤在 CD19 CAR-T 细胞治疗失败后中仍有缓解的机会,但长期疗效尚不清楚。
参考文献
Zhang, X., Xu, K., Gale, R.P. et al. Strategies following failure of CAR-T-cell therapy in non-Hodgkin lymphoma. Bone Marrow Transplant (2024). https://doi.org/10.1038/s41409-024-02463-4
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#非霍奇金淋巴瘤# #CAR-T治疗#
3