读书报告 |细胞间线粒体转移增强T细胞的代谢适应性和抗肿瘤功能
2025-01-08 iCombo iCombo 发表于陕西省
这一研究为线粒体转移作为细胞治疗的一种新模式提供了重要支持,并为未来细胞疗法的改进提供了新的方向。
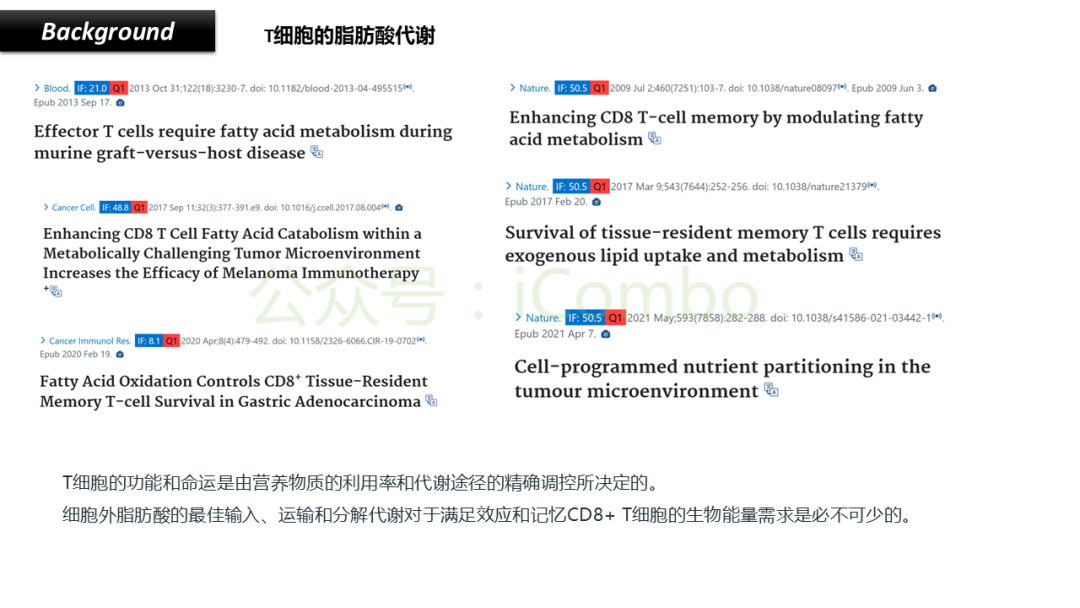
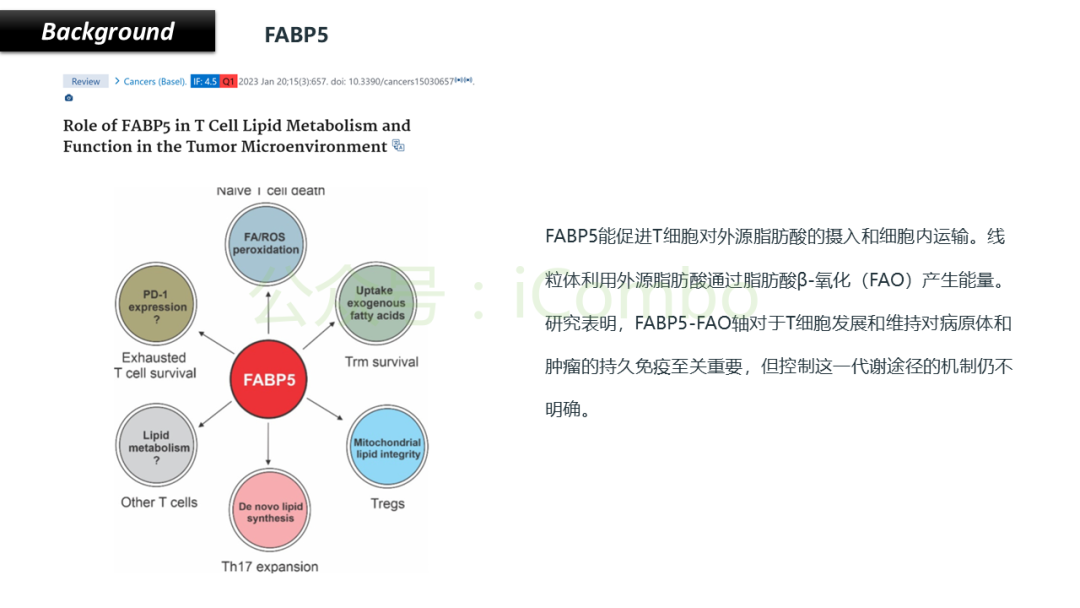
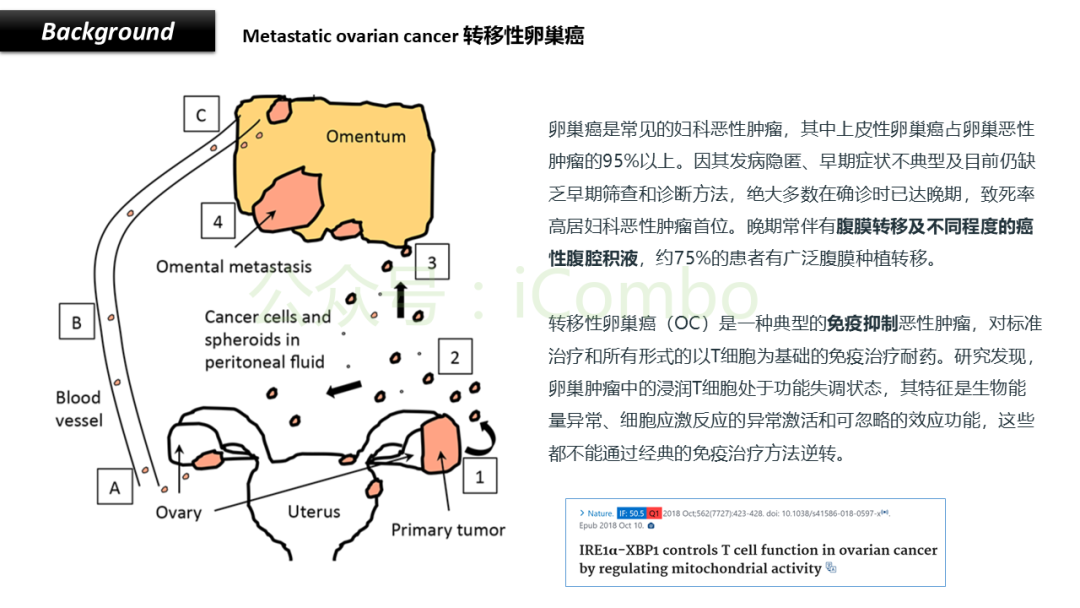
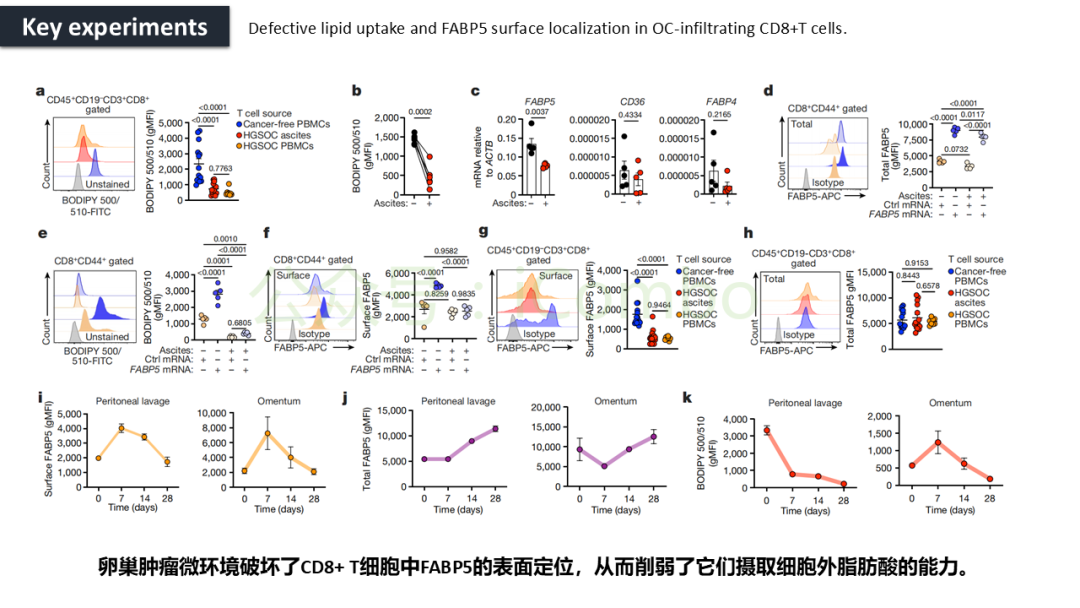
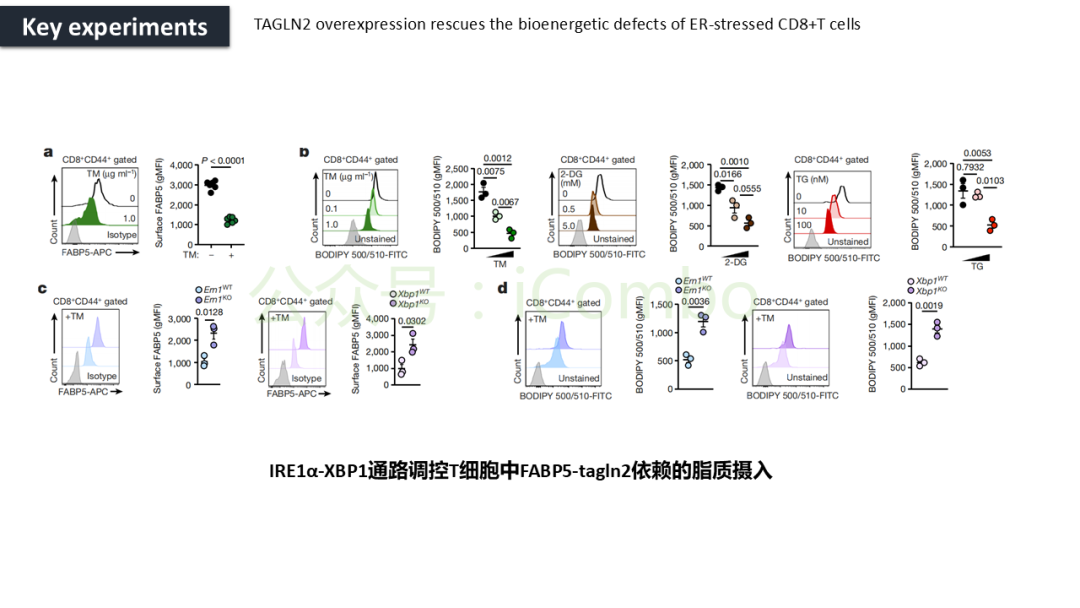
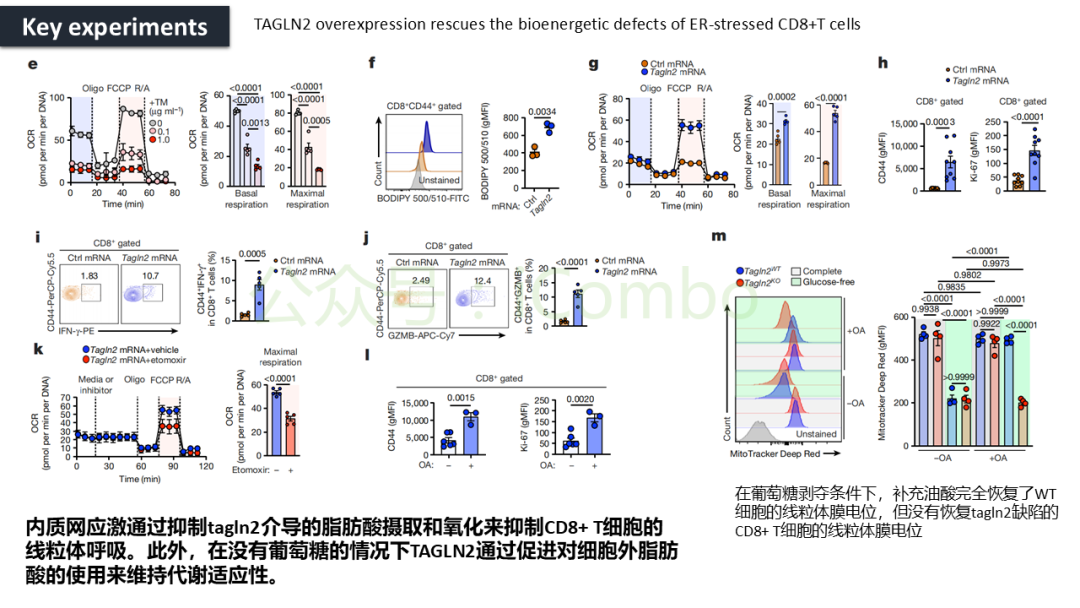
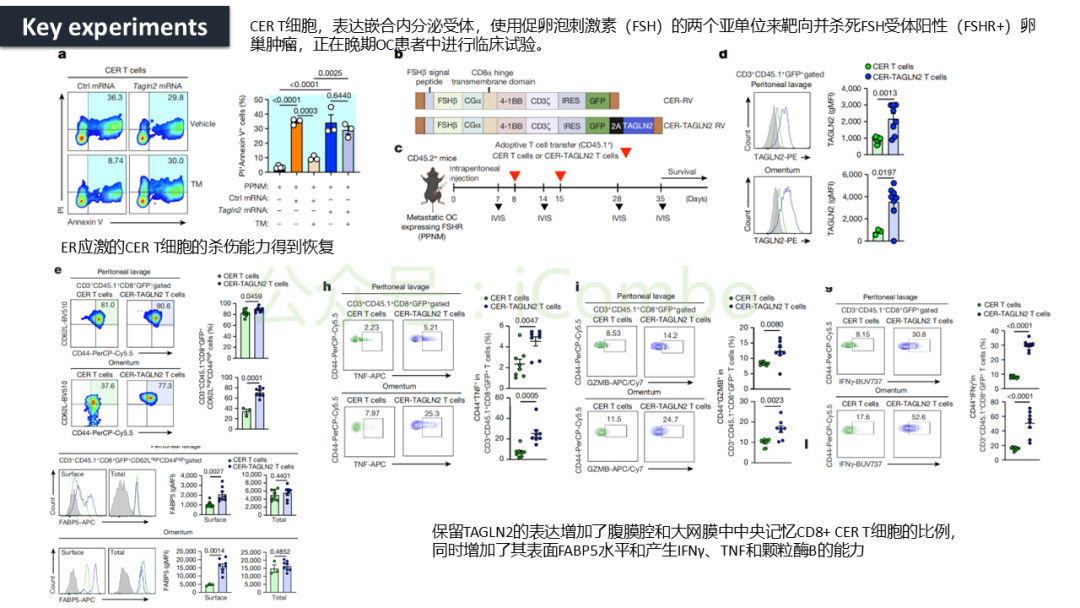
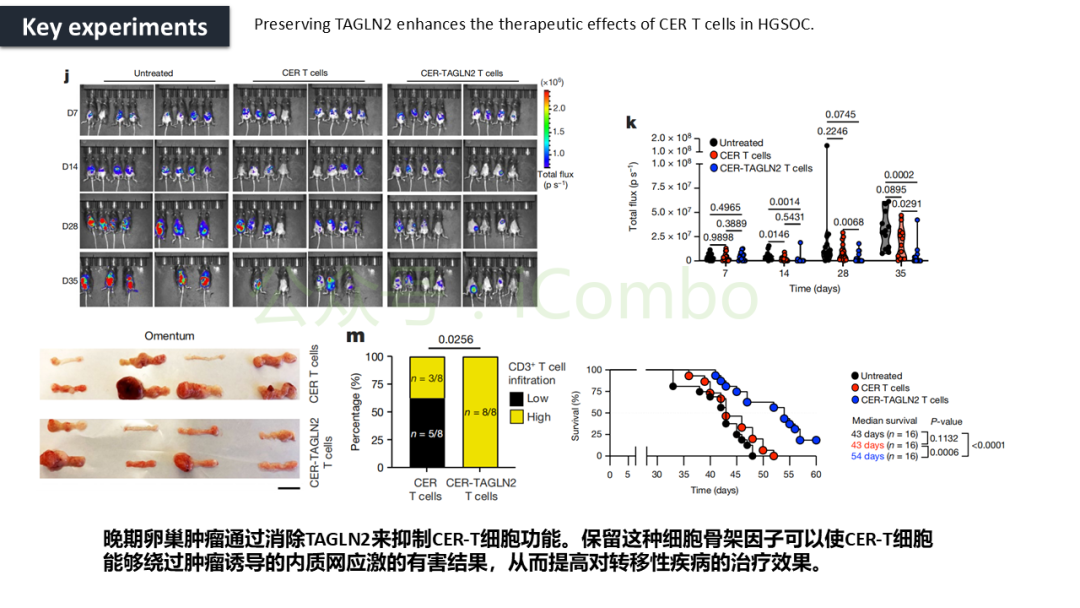
导读 CAR-T疗法是一种新型的免疫治疗方法,能通过基因修饰技术,将带有特异性抗原识别结构域及T细胞激活信号的遗传物质转入T细胞,激活T细胞并通过其直接和间接杀伤肿瘤细胞的作用达到治疗肿瘤的目的。然而,CAR-T疗法在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,但对实体肿瘤的疗效有限。主要原因是T细胞存在于恶劣的肿瘤微环境中,正常的线粒体活动被破坏,T细胞发生衰竭,导致T细胞抗肿瘤反应缺陷和免疫逃避。因此,通过提升T细胞线粒体功能而抑制T细胞耗竭,是以T细胞为靶点开发抗肿瘤策略的研究重点。 此前的研究尝试包括利用T细胞的内在特性,例如产生或选择线粒体功能较强的T细胞亚群,以及通过基因工程促进线粒体生成,或者在T细胞生成过程中添加抗氧化剂以保护线粒体的完整性。然而,如果T细胞中的线粒体功能或线粒体DNA已经受损,这些方法通常效果不佳。近年来有研究表明,线粒体转移不仅可以协助修复受损细胞,肿瘤细胞还可能利用这一机制,从肿瘤浸润淋巴细胞和基质细胞中获取线粒体,以促进自身生长。而线粒体转移的机制包括有通过间隙连接和通过微囊泡转移的线粒体。然而,目前认为最主要的一种线粒体转移途径依赖于隧道纳米管(TNTs)的介导。TNTs是由F-肌动蛋白支持的膜突起,可以跨越很远的距离架起细胞桥,使细胞质因子和细胞器在连接的细胞之间进行交换。那么是否能够通过驱动细胞间的线粒体转移而恢复耗竭T细胞的线粒体功能,从而开发新的靶向T细胞的实体瘤治疗策略,目前仍有待研究。 本文作者发现通过TNTs从骨髓基质细胞向T细胞转移线粒体,能够显著增强CD8+ T细胞的线粒体呼吸功能,并使其在肿瘤环境中更加高效地增殖和渗透,从而有效克服了T细胞免疫疗法中的耗竭问题,抗肿瘤效果显著提升。这一研究为线粒体转移作为细胞治疗的一种新模式提供了重要支持,并为未来细胞疗法的改进提供了新的方向(Nature.2024 Nov;635(8040):1010-1018. doi: 10.1038/s41586-024-08071-y)。



本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#CAR-T疗法# #CD8+ T细胞#
1