浙江大学李洪军/王伟林/顾臻/丁元STTT:微生物重塑肿瘤微环境,增强过继T细胞疗法的创新策略!
12小时前 BioMed科技 BioMed科技 发表于陕西省
这项工作展示了细菌疗法在攻击肿瘤内部和过继T细胞疗法攻击肿瘤外围的双重治疗策略中,展现出强大的治疗效果,有助于实现对晚期肿瘤的根除,包括黑色素瘤和肝细胞癌。
细菌疗法利用某些细菌的特性,能够选择性地靶向肿瘤,尤其是在肿瘤的缺氧区域。这些细菌在肿瘤微环境中能够优先定植,通过多种机制杀伤肿瘤细胞,例如重塑肿瘤的免疫微环境、激活抗肿瘤免疫反应等。研究表明,细菌可以通过诱导细胞凋亡、破坏细胞代谢、递送治疗剂等方式促进肿瘤的消退。此外,细菌的工程化改造使得它们能够在肿瘤内分泌治疗性蛋白或核酸药物,从而增强治疗效果。
在细菌疗法的研究中,嵌合抗原受体T细胞(CAR-T)疗法也被广泛关注。CAR-T疗法在血液肿瘤治疗中取得了显著成功,但在实体瘤治疗中仍面临诸多挑战。这些挑战主要源于肿瘤相关抗原(TAAs)的表达极少且不特异,导致靶向TAAs存在脱靶风险。为了解决这一问题,研究者们开始探索将细菌与CAR-T疗法结合的可能性,通过细菌的靶向作用来增强CAR-T细胞对肿瘤的识别和杀伤能力。
细菌的靶向机制主要依赖于其在肿瘤内的生长优势。细菌能够在肿瘤的缺氧区域生存并增殖,这为其提供了良好的生长环境。研究发现,细菌能够通过释放促炎细胞因子,如TNF,增加局部血流量,从而促进细菌的浸润。此外,细菌的趋化行为是由特定受体引导的,这些受体能够识别肿瘤释放的化合物,从而实现对肿瘤的选择性靶向。
随着合成生物学的发展,研究者们能够对细菌进行基因改造,使其具备更高的靶向性和安全性。例如,工程化的细菌能够表达特定的黏附素,从而提高其在肿瘤组织中的定植能力,并减少对健康组织的非特异性结合。这种精准的靶向定位不仅提高了细菌治疗的有效性,还降低了潜在的毒副作用。
浙江大学李洪军、王伟林、顾臻和丁元等人开发了一种基于细菌的辅助方法,通过肿瘤内注射大肠杆菌MG1655菌株(E. coli MG1655),来增强过继T细胞疗法对实体瘤的治疗效果。这项工作展示了细菌疗法在攻击肿瘤内部和过继T细胞疗法攻击肿瘤外围的双重治疗策略中,展现出强大的治疗效果,有助于实现对晚期肿瘤的根除,包括黑色素瘤和肝细胞癌。这项工作发表在《Signal Transduction and Targeted Therapy》期刊上,题为“Remolding the tumor microenvironment by bacteria augments adoptive T cell therapy in advanced-stage solid tumors”。

【主要内容】
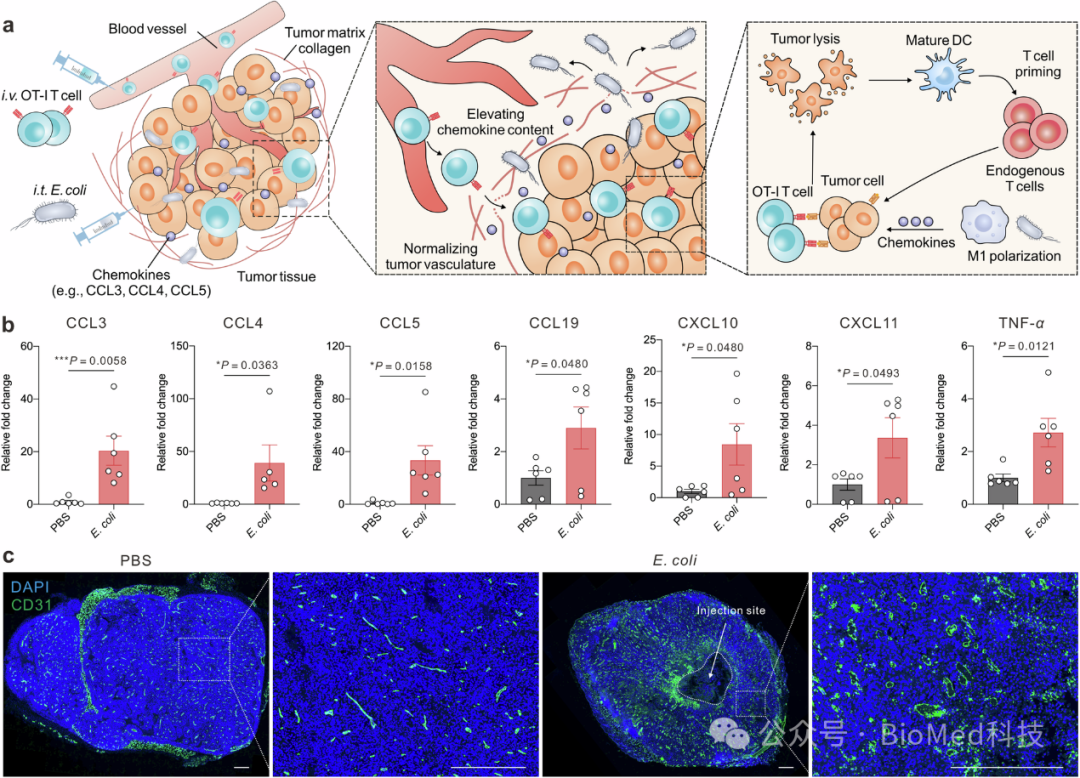
图1 细菌疗法在增强过继T细胞治疗中的作用机制
E. coli MG1655通过刺激肿瘤相关巨噬细胞分泌CCL5等趋化因子,吸引过继转移的T细胞进入肿瘤组织。同时,E. coli对肿瘤血管的破坏和新血管形成起到了促进T细胞从血液外渗到肿瘤组织中的作用。这些改变共同作用,使得细菌辅助的T细胞治疗策略在小鼠黑色素瘤模型中实现了87.5%的肿瘤缓解率,并在体外胰腺肿瘤模型中显示出优越的治疗效果。
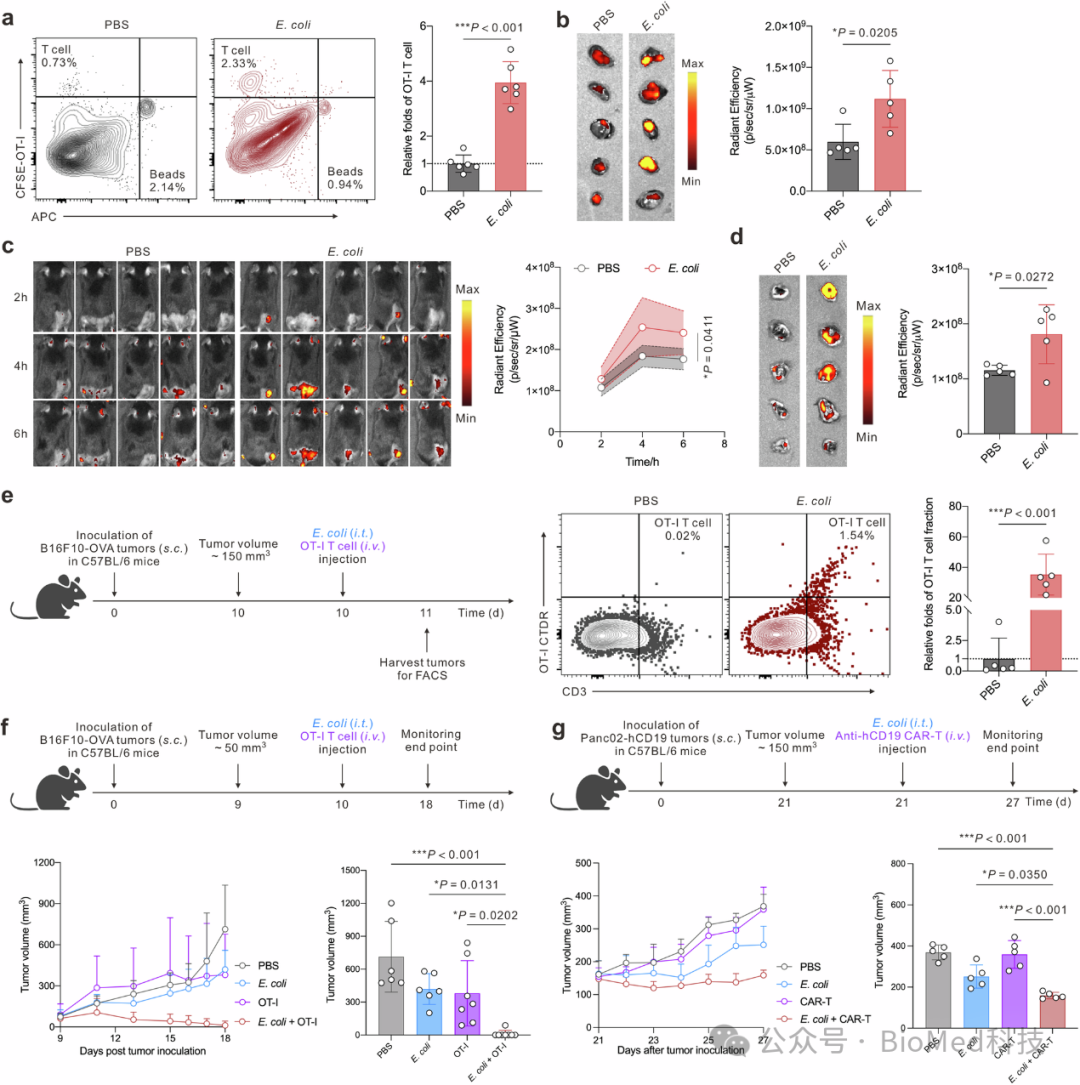
图2 E. coli MG1655对增强过继T细胞治疗实体瘤效果
研究发现,肿瘤内注射E. coli MG1655能显著提高OT-I T细胞向肿瘤的浸润。实验通过体外和体内实验验证,E. coli处理的组别中OT-I T细胞与对照组相比显示出更高的迁移比例,且在E. coli组中OT-I CD8 T细胞的肿瘤浸润量显著增加。此外,将E. coli与OT-I T细胞或抗hCD19 CAR-T细胞联合应用于B16F10-OVA和Panc02-hCD19-luci肿瘤模型中,结果显示这种联合疗法在黑色素瘤中实现了87.5%的完全缓解率,并显著抑制了胰腺肿瘤的生长。
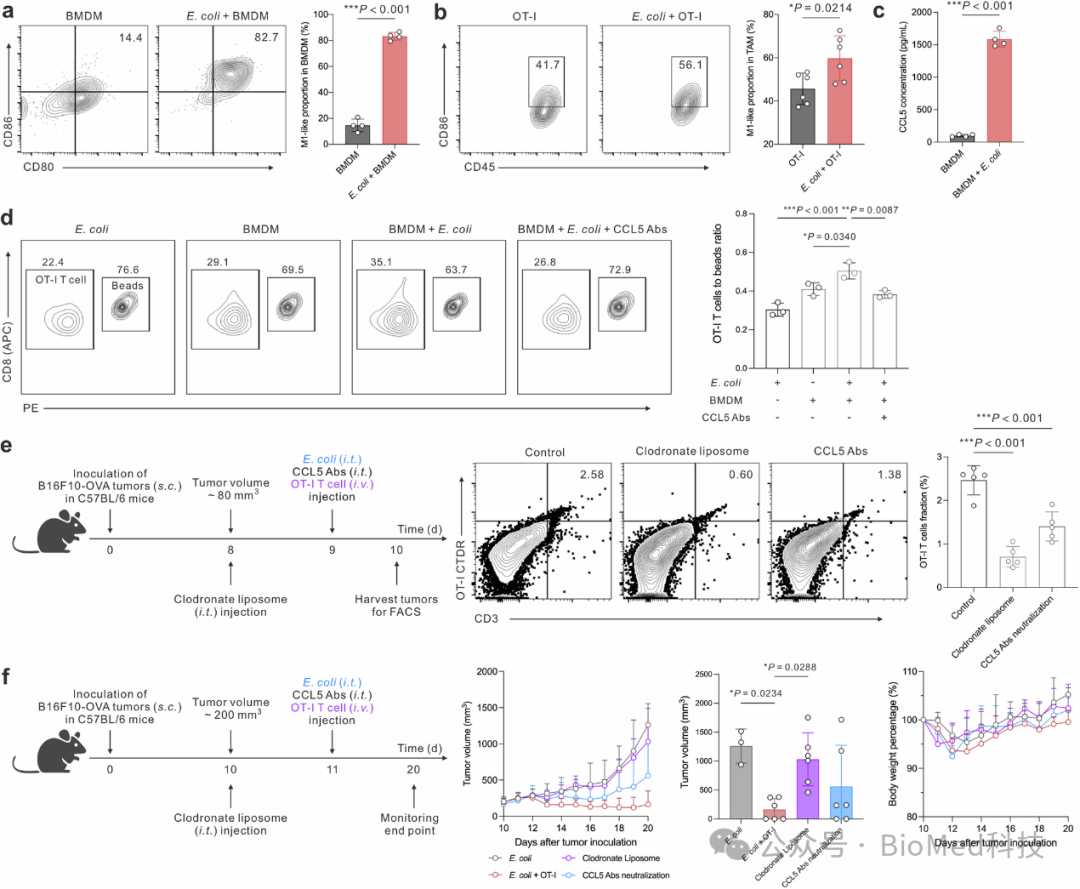
图3 E. coli MG1655促进过继转移的T细胞在肿瘤中的浸润
研究发现,E. coli MG1655能够显著上调骨髓来源巨噬细胞(BMDM)中M1型表型标记物的表达,表明E. coli诱导了向炎症性巨噬细胞表型的转变。此外,E. coli的存在还增强了BMDM分泌CCL5的能力,而CCL5是关键的趋化因子,能够吸引T细胞。实验通过共培养实验和迁移实验证实了E. coli诱导的CCL5在T细胞浸润中的关键作用。进一步的实验显示,TAM耗竭剂和CCL5中和抗体能够减少肿瘤内OT-I CD8 T细胞的比例,而这种减少与肿瘤生长抑制效果的降低相关。
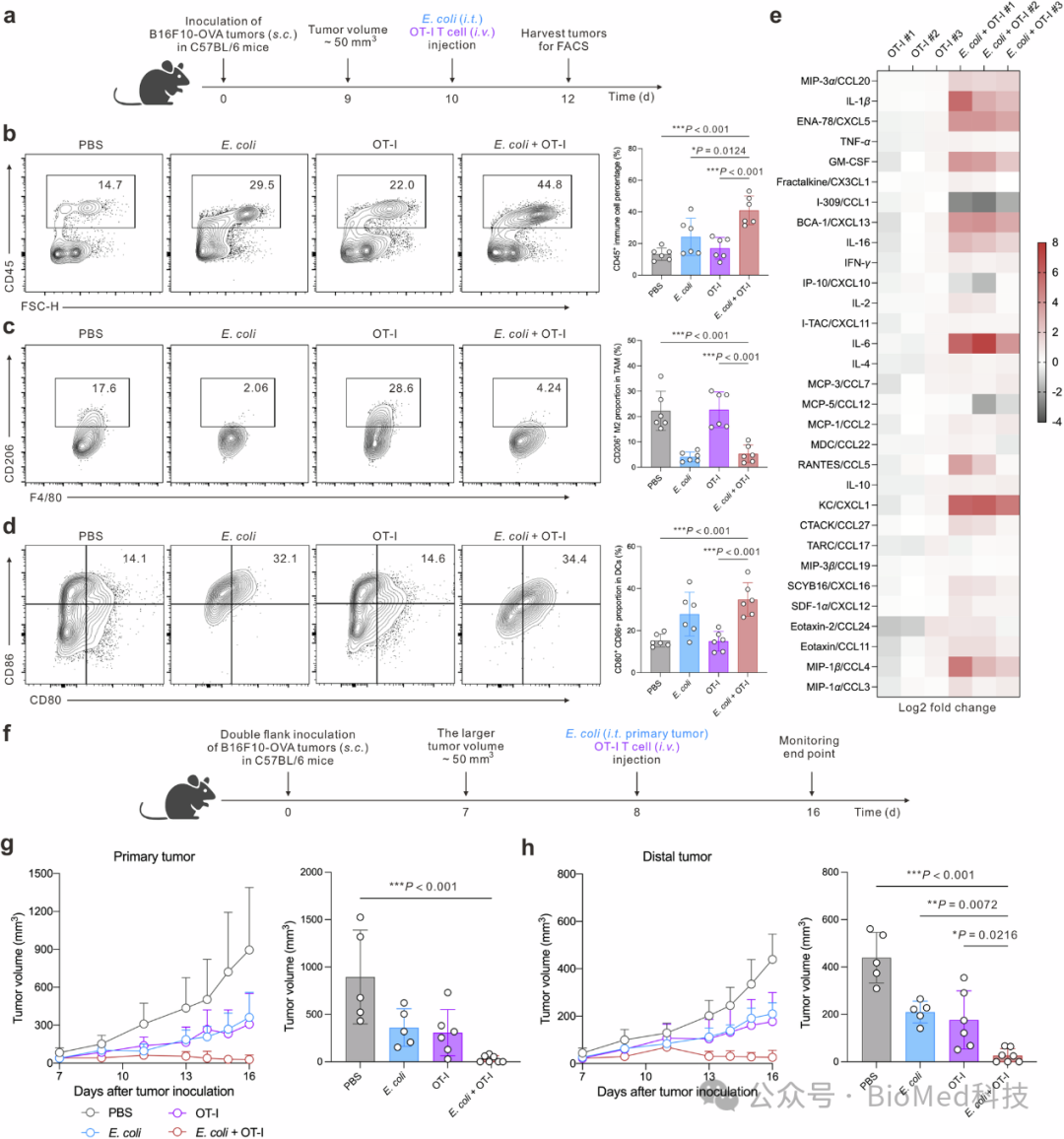
图4 E. coli与过继转移的T细胞协同作用
研究发现,E. coli与OT-I T细胞的组合治疗能显著提高肿瘤内免疫细胞的浸润水平,减少M2型巨噬细胞的比例,并促进肿瘤内树突状细胞的成熟,表现为CD80和CD86表达的增加。此外,E. coli的加入还增强了肿瘤微环境中多种与免疫细胞招募、激活和效应功能密切相关的趋化因子和细胞因子的表达。在双侧黑色素瘤小鼠模型中,E. coli和OT-I T细胞的联合应用显著抑制了原发肿瘤和远端肿瘤的生长,其中E. coli单独应用也能抑制远端肿瘤的生长。这些结果表明,E. coli通过激活先天免疫系统和增强树突状细胞的抗原呈递能力,促进了原位肿瘤疫苗效应,从而激活了针对肿瘤的系统性免疫反应,增强了对原发和远端肿瘤的控制。
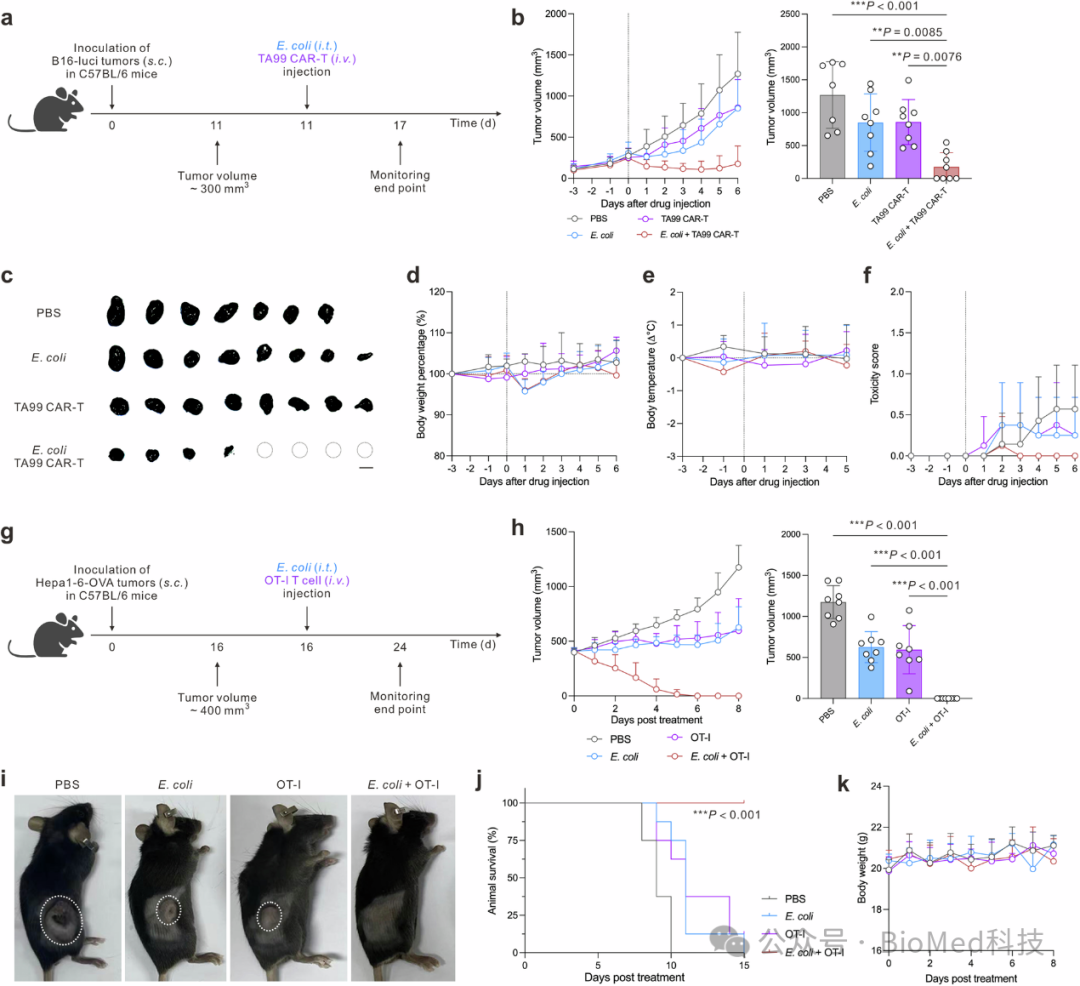
图5 E. coli与过继T细胞疗法联合应用在晚期黑色素瘤和肝细胞癌模型中的治疗效果
研究发现,当肿瘤体积达到300 mm³时,使用E. coli与特定识别黑色素瘤相关蛋白1(TRP-1)的TA99 CAR-T细胞联合治疗,实现了显著的肿瘤完全缓解率,达到50%。此外,这种治疗方案表现出良好的耐受性,小鼠体重和体温在治疗期间未出现显著不良影响。在肝细胞癌模型中,当肿瘤体积达到400 mm³时,应用E. coli与OT-I CD8 T细胞的联合治疗,实现了100%的肿瘤清除率,且所有小鼠在治疗后15天内保持存活。小鼠体重在整个治疗期间保持正常,显示了该治疗方法的安全性。
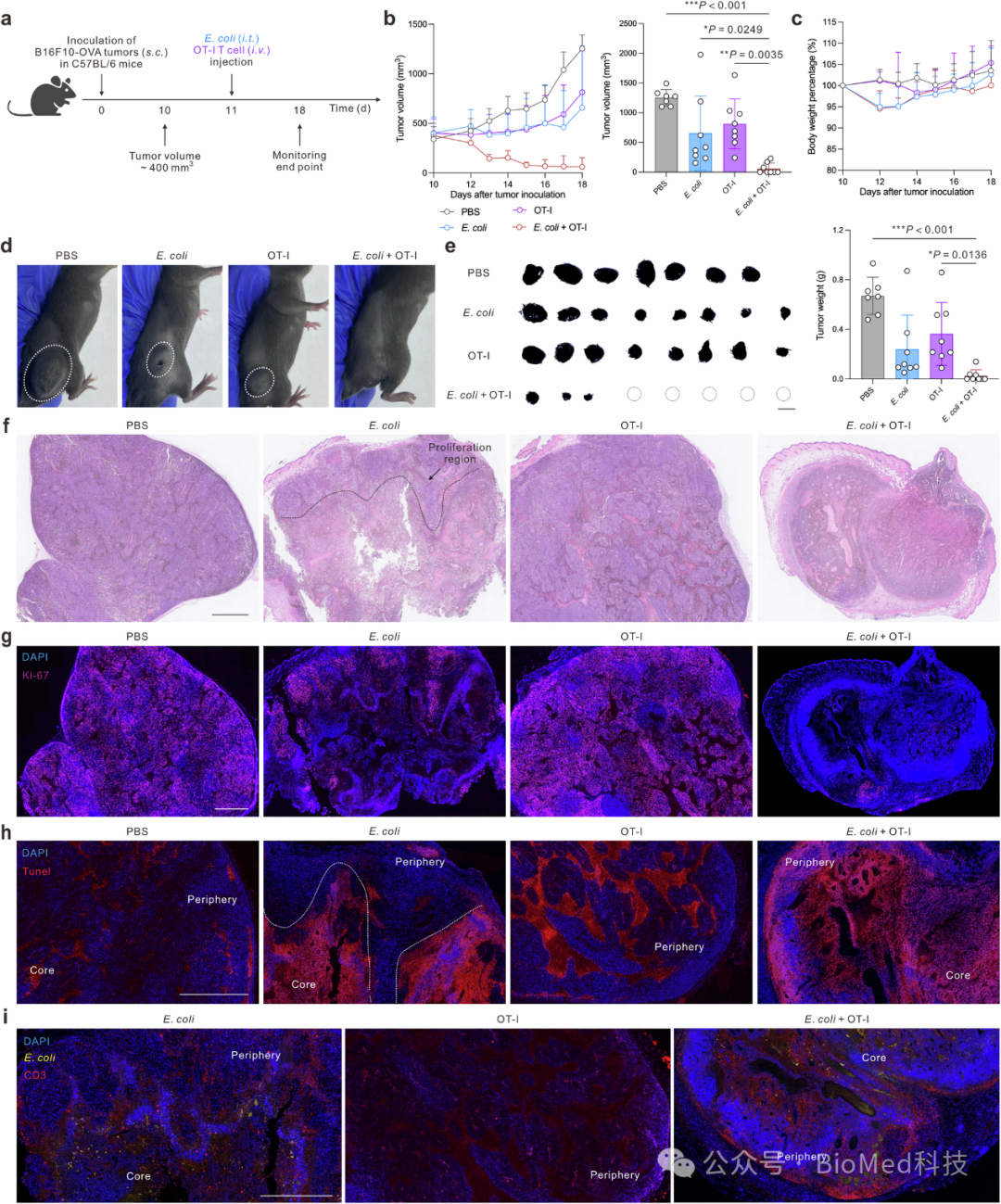
图6 E. coli与过继T细胞疗法联合应用在消除晚期实体瘤中的作用机制和效果
研究发现,当肿瘤体积增长至400 mm³时开始治疗,联合治疗组(E. coli + OT-I T细胞)的肿瘤体积显著减小,与其它治疗组相比,显示出明显的治疗效果。治疗期间,小鼠体重保持稳定,表明治疗具有良好的耐受性。联合治疗组中有5只小鼠实现了肿瘤完全消失。通过组织学和免疫组化分析,研究者观察到E. coli单独治疗主要在肿瘤核心区域引起坏死,而OT-I T细胞治疗主要影响肿瘤外围。联合治疗组则在肿瘤整个区域实现了更全面的肿瘤退化,表现为降低的增殖标记Ki-67和增加的凋亡标记TUNEL。此外,研究还发现E. coli主要在肿瘤的缺氧核心区域定植,而T细胞则主要分布在肿瘤外围。联合治疗组中,T细胞对肿瘤组织的浸润显著增加,导致整个肿瘤区域的生长得到有效控制。
【全文总结】
本文研究了利用E. coli MG1655重塑肿瘤微环境以增强过继T细胞治疗实体瘤的效果。研究发现,该细菌疗法能够改善肿瘤血管、激活免疫反应,并促进T细胞浸润,与过继T细胞治疗联合使用时,在小鼠模型中对黑色素瘤和胰腺肿瘤显示出显著疗效。此外,该疗法还增强了对远端肿瘤的控制,并表现出良好的耐受性和生物安全性。这项研究为开发新型癌症免疫疗法提供了有价值的策略。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















前往app查看评论内容
6 0