Nature:生命的“肝”霖:基因编辑猪肝脏异种移植人体取得突破性进展!
2025-03-28 生物探索 生物探索 发表于陕西省
全球肝供体短缺,研究聚焦异种移植。窦科峰团队将六基因编辑猪肝脏移植到脑死亡患者体内,其存活 10 天并发挥功能,证实可行性,为解决难题带来希望,同时指出仍面临诸多挑战。
引言
生命的接力,常常面临“肝”尬的困境。每年,无数患者在漫长的等待中,与生的希望擦肩而过,器官短缺已成为全球医疗领域亟待解决的难题。研究人员从未放弃探索的脚步,他们将目光投向了异种器官移植——一个充满挑战却又充满希望的领域。想象一下,如果有一天,我们可以借助其他物种的器官,来延续人类的生命,那将是医学史上多么激动人心的时刻!
然而,跨越物种的屏障谈何容易?免疫系统的强大力量,会将外来器官视为入侵者,毫不留情地发起攻击。为了攻克这一难题,研究人员另辟蹊径,利用基因编辑技术,对猪的基因进行“改造”,使其器官能够更好地适应人体环境。此前,经过基因编辑的猪心脏和肾脏已经展现出初步的成功,为我们带来了曙光。
而现在,一个更加复杂、更具挑战性的器官——肝脏,也迎来了它的“高光时刻”!3月26日《Nature》的研究报道“Gene-modified pig-to-human liver xenotransplantation”,震撼了医学界:研究人员成功地将一颗经过六重基因编辑的猪肝脏,移植到一位脑死亡的受者体内,并且令人难以置信的是,这颗异种肝脏竟然在人体内维持了长达10天的功能!这究竟是如何实现的?这项突破性的进展又意味着什么?它能否真正帮助我们摆脱“一肝难求”的困境?

告别“一肝难求”:异种器官移植的新篇章
对于终末期肝病患者而言,肝脏移植是唯一有效的治疗手段。然而,全球范围内,能够进行肝脏移植的供体数量远远无法满足日益增长的需求。“一肝难求”的困境,让无数患者和家庭承受着巨大的痛苦。为了解决这一难题,研究人员一直在积极探索新的途径,而利用动物器官进行异种移植(xenotransplantation)便是其中一个备受关注的方向。猪由于其生理功能和器官大小与人类较为接近,且易于饲养和繁殖,成为了异种器官移植的理想供体。然而,异种移植面临的最大挑战是超急性排斥反应(hyperacute rejection),即受者的免疫系统在移植后迅速攻击并摧毁外来器官。
为了克服这一障碍,研究人员付出了巨大的努力。通过基因编辑技术,对猪的基因进行改造,敲除(knockout)会引起人类强烈免疫反应的基因,并导入能够提高移植器官与人体相容性的基因。此前,经过基因编辑的猪心脏和肾脏已经成功移植到人体,并取得了初步的积极成果。而该研究则聚焦于更为复杂的肝脏移植,其难度和挑战性可想而知。这项研究的成功,标志着异种器官移植领域又迈出了关键的一步,为未来解决器官短缺问题提供了新的策略和可能性。
“超级猪”的诞生:基因编辑技术的神奇力量
该研究中使用的供体猪是一只经过六个基因编辑的巴马小型猪(Bama miniature pig)。为了确保基因编辑的成功,研究团队对供体猪的外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)进行了流式细胞术(flow cytometry)检测。结果显示,猪体内介导超急性排斥反应的关键基因,包括编码α-1,3-半乳糖转移酶的GGTA1基因、编码β-1,4-N-乙酰半乳糖胺转移酶2的B4GALNT2基因以及合成N-糖基神经氨酸(Neu5Gc)的CMAH基因,都得到了有效的灭活(inactivated)。这意味着移植后,受者的免疫系统不太可能因为这些特定的猪抗原而立即发起猛烈的攻击。
与此同时,研究人员还检测到,供体猪的PBMCs中人类补体调节蛋白(human complement regulatory proteins, CRPs)的表达显著增加,包括CD46(膜辅助蛋白)和CD55(衰变加速因子)。这些人类蛋白能够抑制超急性排斥反应,延长异种移植器官的存活时间。此外,为了激活抗血栓蛋白C并防止血栓形成,研究团队还在猪的基因组中插入了人类血栓调节蛋白(human thrombomodulin, THBD,编码hTBM)基因。免疫组织化学染色(immunohistochemistry staining, IHC)结果也证实,hTBM以及CD46和CD45在基因编辑后均表达上调(upregulated)。这些基因改造,使得这只“超级猪”的肝脏在理论上具备了与人体免疫系统和平共处的潜力。
更为重要的是,研究团队在移植前对受者进行了检测,确认其体内针对猪细胞的异种反应性免疫球蛋白M(xenoreactive immunoglobulin M, IgM)和IgG抗体水平较低。同时,在围手术期(peri-operatively),研究人员在受者的PBMCs或肝脏中均未检测到猪内源性逆转录病毒(porcine endogenous retrovirus, PERV),并且供体和受者肝脏中的猪巨细胞病毒(porcine cytomegalovirus, PCMV)也得到了有效控制。这些结果表明,经过严格筛选和基因编辑的供体猪,能够最大程度地降低移植过程中潜在的感染风险。
示意图(Credit: Nature)
精心设计的移植手术:为异种肝脏保驾护航
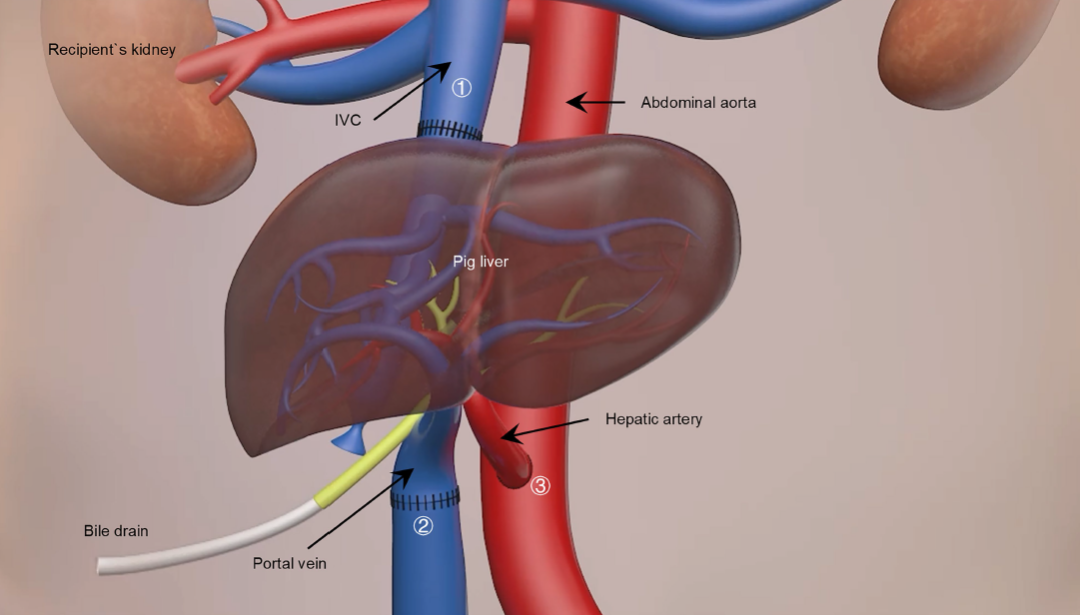
为了最大限度地提高移植的成功率,研究团队选择了异位辅助性肝脏移植(heterotopic auxiliary liver transplantation)的方式。在移植前,他们对供体猪进行了血管分割(vascular segmentation),并通过超声评估发现,供体猪的门静脉(porcine portal vein, PV)和下腔静脉(inferior vena cava, IVC)的大小与受者的血管大致匹配。这为术中血管的吻合(anastomosis)提供了有利条件。
手术过程中,医生在受者右肾静脉下方部分切除了下腔静脉,然后将供体肝脏的肝上段下腔静脉与受者下腔静脉的近端相连,供体猪的门静脉则与受者下腔静脉的远端吻合。随后,供体猪的肝动脉被桥接到受者的腹主动脉,胆汁则通过引流管排出体外。研究结束后,移植的猪肝脏被移除,受者的下腔静脉则使用人工血管进行了重建。这种异位辅助性移植的策略,可以在不影响受者自身肝脏功能的情况下,为移植的猪肝脏提供血液供应和功能支持,同时也为未来移除移植器官或进行自体肝脏功能恢复提供了便利。
功能初显:移植肝脏的“生命迹象”
移植手术后,研究团队对移植肝脏的功能进行了严密的监测。令人欣喜的是,在供体肝脏门静脉再灌注(portal vein reperfusion)两小时后,便观察到了金黄色的胆汁产生,并且胆汁的产量在术后持续增加,到第10天达到了66.5毫升。肝脏分泌胆汁是其重要功能之一,这表明移植的猪肝脏已经开始工作。此外,通过酶联免疫吸附试验(enzyme-linked immunosorbent assay),研究人员还检测到术后受者体内猪肝脏来源的白蛋白(porcine liver-derived albumin)水平也随之升高。白蛋白是肝脏合成的重要蛋白质,它的出现进一步证实了移植肝脏的功能活性。
尽管如此,在反映肝脏功能的关键酶指标方面,丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase, AST)的水平在移植后出现了不一致的变化。ALT水平始终保持在正常范围内,而AST水平在术后第一天急剧升高,随后迅速下降。虽然这种差异的原因尚不完全清楚,但研究人员认为,AST的显著升高不太可能意味着移植肝脏的功能障碍。与此同时,其他肝功能指标,如碱性磷酸酶(alkaline phosphatase)在整个研究过程中都维持在正常范围内,而胆红素(bilirubin)和γ-谷氨酰转移酶(γ-glutamyl transpeptidase, γ-GGT)在研究后期出现升高,这可能与受者自身肝脏出现轻微的肝内胆汁淤积(intrahepatic cholestasis)有关。总体而言,这些初步的功能指标表明,移植的基因编辑猪肝脏能够在人体内存活并开始发挥功能。
免疫系统的“温柔以待”:未见明显的排斥反应
异种器官移植面临的最大风险是免疫排斥反应。为了评估受者对移植猪肝脏的免疫反应,研究团队在整个研究过程中密切监测了受者的免疫指标。由于术前使用了抗胸腺细胞球蛋白(anti-thymocyte globulin),受者体内的T细胞活性,特别是CD4+ T细胞,在术后早期受到了抑制,而B细胞数量则有所增加。在术后第3天,研究人员开始使用利妥昔单抗(rituximab),这迅速降低了B细胞的数量。C反应蛋白(C-reactive protein, CRP)和降钙素原(procalcitonin)是反映炎症反应的指标,它们在术后初期出现升高,随后迅速下降。白细胞介素6(interleukin-6, IL-6)的表达在术后也维持在非常低的水平。其他细胞因子,包括肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、干扰素α(interferon-α, IFN-α)和干扰素γ(interferon-γ, IFN-γ)在术后早期似乎也受到了抑制。这些数据共同表明,移植后受者的炎症反应得到了较好的控制。
更令人惊喜的是,组织学分析(histological analyses)显示,供体猪肝脏在围手术期仅出现轻微的肝窦充血和炎症细胞浸润,但没有观察到明显的免疫排斥反应迹象。对移植肝脏的肝细胞、星状细胞和肝窦内皮细胞(liver sinusoidal endothelial cells, LSECs)的评估显示,在第10天采集的猪肝脏样本中,肝细胞增殖(Ki67阳性)增加,星状细胞活化(α-平滑肌肌动蛋白阳性)降低,LSEC再群体化(CD31阳性)增加,这表明移植肝脏具备良好的再生能力,且没有出现排斥反应和纤维化的迹象。通过扫描电子显微镜(scanning electron microscopy, SEM)观察到的LSECs也显示出良好的分化,表明移植后猪肝脏的微循环没有受到破坏。透射电子显微镜(transmission electron microscopy, TEM)的观察则显示,移植前后猪肝脏肝细胞的超微结构没有显著差异,并且没有观察到病毒颗粒。这些组织学证据进一步支持了移植的基因编辑猪肝脏在短期内未发生明显排斥反应的结论。
前景与挑战:异种肝移植的未来之路
该研究的成功,无疑为异种肝脏移植带来了巨大的希望。尽管这项研究的时间仅为10天,且受限于伦理等因素,但其结果已经足以证明,通过基因编辑和合理的免疫抑制策略,异种猪肝脏在人体内短期存活并维持功能是可行的。这为未来进一步探索和优化异种肝脏移植技术奠定了坚实的基础。
然而,我们也必须清醒地认识到,异种肝脏移植仍然面临着诸多挑战。例如,如何进一步提高移植器官的长期存活率和功能维持时间?如何更有效地控制免疫排斥反应,并减少免疫抑制药物带来的副作用?如何确保移植过程中不发生潜在的猪病毒传播?这些问题都需要研究人员在未来的研究中不断探索和解决。此外,伦理和社会方面的考量也是异种器官移植发展中不可忽视的重要方面。
尽管如此,该研究的突破性进展仍然具有里程碑意义。它不仅为解决器官短缺问题提供了一种新的潜在解决方案,也为我们深入理解免疫系统与异种器官之间的相互作用提供了宝贵的数据。
可以预见,随着技术的不断发展,异种器官移植在未来有望成为拯救更多终末期肝病患者生命的有效手段。让我们共同期待,在不久的将来,生命的“肝”霖能够真正滋润每一个等待希望的生命。
参考文献
Tao, KS., Yang, ZX., Zhang, X. et al. Gene-modified pig-to-human liver xenotransplantation. Nature (2025). https://doi.org/10.1038/s41586-025-08799-1

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#基因编辑# #异种肝移植#
6