Nat Cancer:新型抗体-毒素偶联物CD47-LLO增强肿瘤免疫治疗效果
2025-03-04 MedSci原创 MedSci原创 发表于陕西省
该研究揭示了CD47-LLO抗体-毒素偶联物不仅增强了肿瘤细胞的吞噬作用和抗原呈递,还通过激活cGAS-STING通路和促进T细胞反应,显著增强了抗肿瘤免疫反应。为肿瘤免疫治疗提供了新的策略和思路。
近年来,肿瘤免疫治疗取得了显著进展,尤其是免疫检查点抑制剂(如PD-1/PD-L1抗体)的广泛应用,为癌症治疗带来了新的希望。然而,免疫检查点抑制剂的响应率有限,部分患者难以从中获益。因此,开发新的免疫治疗策略,以增强肿瘤特异性免疫反应,成为当前研究的热点。
CD47是一种“不要吃我”信号分子,广泛表达于肿瘤细胞表面,通过与巨噬细胞等免疫细胞上的信号调节蛋白α(SIRPα)结合,抑制肿瘤细胞的吞噬作用,从而帮助肿瘤细胞逃避免疫监视。因此,阻断CD47信号通路被认为是增强肿瘤免疫治疗效果的重要策略之一。
细菌毒素如单核细胞增生李斯特菌(Listeria monocytogenes)产生的溶血素O(LLO)具有破坏细胞膜的能力。LLO能够通过在吞噬体膜上形成孔道,促进细菌从吞噬体逃逸到细胞质中。这一特性被研究者利用,开发出基于LLO的免疫治疗策略,以增强肿瘤抗原的呈递和免疫激活。
2月25日,美国德克萨斯大学MD 安德森癌症中心团队在Nature Cancer杂志上在线发表了题为“An antibody–toxin conjugate targeting CD47 linked to the bacterial toxin listeriolysin O for cancer immunotherapy”的最新研究成果,该研究揭示了CD47-LLO抗体-毒素偶联物不仅增强了肿瘤细胞的吞噬作用和抗原呈递,还通过激活cGAS-STING通路和促进T细胞反应,显著增强了抗肿瘤免疫反应。为肿瘤免疫治疗提供了新的策略和思路。

研究发现,CD47-LLO能够显著增强巨噬细胞和树突状细胞对肿瘤细胞的吞噬能力。这种增强作用不仅依赖于CD47的靶向,还与LLO在吞噬体膜上形成孔道、促进肿瘤抗原逃逸到细胞质中有关。这一过程激活了细胞质中的免疫感应通路(如cGAS-STING通路),进一步增强了抗原呈递和免疫激活。
通过单细胞转录组测序和流式细胞术分析,研究者发现CD47-LLO处理后,肿瘤组织中浸润的CD4+和CD8+ T细胞数量显著增加。此外,CD47-LLO还能够增强T细胞的激活状态,促进肿瘤特异性T细胞的增殖和功能发挥。这些结果表明,CD47-LLO不仅增强了抗原呈递,还通过激活T细胞进一步增强了抗肿瘤免疫反应。
研究者发现,CD47-LLO处理后,肿瘤组织中的巨噬细胞和树突状细胞表现出更高的cGAS-STING通路激活水平。这一通路的激活有助于增强I型干扰素的产生,进一步促进T细胞的激活和抗肿瘤免疫反应。此外,cGAS-STING通路的激活还与肿瘤细胞的吞噬作用和抗原呈递密切相关,形成了一个正反馈循环,进一步增强了抗肿瘤免疫反应。
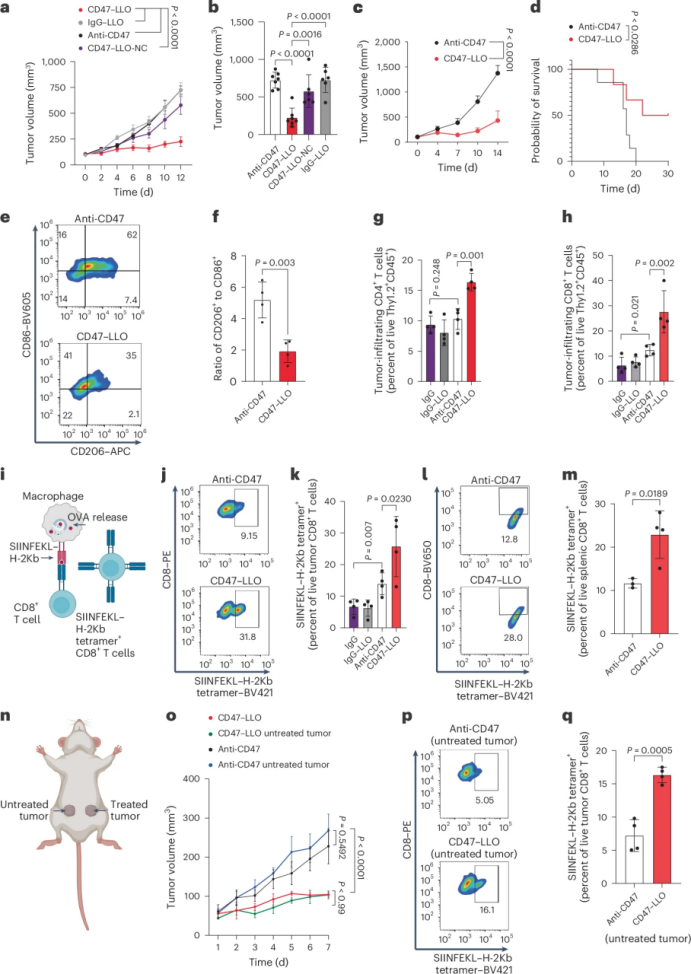
图 CD47-LLO在体内驱动肿瘤抗原驱动的 T 细胞反应
研究者进一步探索了CD47-LLO与免疫检查点抑制剂(如抗PD-1抗体)联合应用的效果。实验结果表明,这种联合治疗策略能够显著增强抗肿瘤效果,提高小鼠的生存率。联合治疗不仅增强了T细胞的浸润和激活,还减少了免疫抑制细胞的比例,进一步优化了肿瘤免疫微环境。
综上所述,本研究开发的CD47-LLO抗体-毒素偶联物是一种新型的免疫治疗策略,通过靶向CD47并利用LLO的特性,显著增强了肿瘤细胞的吞噬作用和抗原呈递。这种策略不仅激活了细胞质中的免疫感应通路,还促进了肿瘤特异性T细胞的反应,为肿瘤免疫治疗提供了新的思路。
原始出处:
An antibody-toxin conjugate targeting CD47 linked to the bacterial toxin listeriolysin O for cancer immunotherapy. Nat Cancer. 2025 Feb 25. doi: 10.1038/s43018-025-00919-0. Epub ahead of print. PMID: 40000910.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#CD47# #肿瘤免疫# #cGAS-STING#
0