论著|基于体素形态学分析探讨脑梗死远隔丘脑和黑质损害研究
2024-08-17 中国神经精神疾病杂志 中国神经精神疾病杂志 发表于上海
VBM技术可在脑梗死后1~3个月检测MCA供血区脑梗死患者同侧丘脑和黑质体积缩小,可用于检测其继发性损害。
摘 要
目的探讨颅脑核磁共振成像(magnetic resonance imaging, MRI)体素形态学分析(voxel-based morphometry, VBM)对检测脑梗死患者远隔丘脑和黑质继发性损害的临床价值。
方法前瞻性招募19例首次单侧大脑中动脉(middle cerebral artery, MCA)供血区脑梗死患者,在发病后1周、1个月、3个月分别行MRI三维全脑扫描,应用VBM方法分析丘脑和黑质体积的变化。
结果VBM结果显示,与发病1周时相比,脑梗死患者在发病1个月和3个月时同侧丘脑体积减小(体素值分别缩小637 mm3、1488 mm3,P<0.01),且体积萎缩部位主要位于丘脑背内侧核。同样,与发病1周时相比,脑梗死患者在发病1个月和3个月时同侧黑质体积减小(体素值分别缩小64 mm3、76 mm3,P<0.05)。
结论VBM技术可在脑梗死后1~3个月检测MCA供血区脑梗死患者同侧丘脑和黑质体积缩小,可用于检测其继发性损害。
关键词
体素形态学分析;大脑中动脉;脑梗死;丘脑;黑质;远隔损害;磁共振成像
急性脑梗死除局灶性神经功能缺损外,常常在远离原发梗死灶部位也会发生脑结构和功能改变,并影响神经功能康复,这种现象称为远隔损害[1]。与原发梗死灶致病特点不同,远隔损害发生在脑梗死后数天或数周,呈进行性发展,对脑梗死患者远期临床预后造成不良影响[2-3]。脑梗死后远隔损害采用常规磁共振成像(magnetic resonance imaging, MRI)检查难以早期发现。基于体素的形态学分析技术(voxel-based morphometry, VBM)可定量计算全脑组织不同结构的密度和体积,从而早期精确检测出具有差异的脑组织,且有更强的客观性和可重复性。本研究拟采用MRI基于VBM前瞻性动态观察大脑中动脉(middle cerebral artery, MCA)供血区脑梗死患者丘脑和黑质的继发性改变,并探讨其对检测脑梗死后远隔损害的临床价值。
1 对象与方法
1.1 研究对象 前瞻性招募2015年10月至2016年10月在暨南大学附属第一医院神经内科住院治疗的脑梗死患者。纳入标准:①年龄18~80岁;②首次发生脑梗死且病程<7 d;③颅脑MRI检查证实病灶为一侧MCA供血区脑梗死,但丘脑及黑质不存在明显异常信号。排除标准:①病情危重,估计患者生存期可能不足3个月;②有中枢神经系统感染、脑肿瘤、陈旧性脑梗死等病史,或头部外伤、手术史;③有神经退行性病变或脱髓鞘疾病,例如帕金森病、多系统萎缩、多发性硬化等;④因体内有金属植入物或金属异物(如人工金属瓣膜、心脏起搏器、钢板、支架、假体、人工关节)等而不能行颅脑MRI检查;⑤患者及其家属不能配合检查。本研究已通过暨南大学附属第一医院伦理审查委员会的审批。所有入组患者及家属知情同意并签署知情同意书。
1.2 MRI检查及VBM处理
1.2.1 MRI序列及扫描方法 脑梗死患者分别在发病第1周内、第1个月末(30 d±3 d)和第3个月末(90 d±3 d)共进行3次颅脑MRI检查。MRI检查采用美国GE公司Discovery MR 750 3.0 T磁共振仪器扫描,接收线圈为8通道相控阵头颅线圈,所有脑梗死患者取仰卧位,耳内填塞棉球减少噪声干扰,海绵垫固定制动头颅,扫描野包括整个颅脑,扫描序列包括T1液体衰减反转恢复(fluid-attenuated inversion recovery, FLAIR)序列、弥散加权成像(diffusion weighted imaging, DWI)、3D-时间飞跃法动脉血管成像(3D-time of flight magnetic resonance angiography,3D-TOF MRA)、T1颅脑容积成像(brain volume, BRAVO)。T1 FLAIR用于显示梗死病变细节,DWI用于明确脑梗死部位,3D-TOF MRA用于明确脑动脉狭窄情况,T1 BRAVO扫描参数:重复时间8.2 ms,回波时间3.2 ms,反转时间450 ms,视野240 mm×240 mm,矩阵256×256,激励次数1,翻转角12°,层厚/层间距2 mm / 0 mm,带宽31.2 kHz。为保证颅脑MRI检查结果具有较好的一致性,所有MRI检查由同1位影像科医师操作完成。
1.2.2 VBM数据预处理 将脑梗死患者的T1 BRAVO原始数据导入电脑,使用MRIcron所带的dcm2niigui工具进行格式转换。在对结构像进行预处理之前对脑梗死病灶位于左侧大脑半球的脑梗死患者图像进行左右翻转,使脑梗死病灶统一翻转至右侧,则健侧大脑半球均位于左侧。结构像预处理采用MATLAB R2012a的统计参数图8(statistical parametric mapping 8, SPM8)软件,将VBM8置入SPM8/toolbox之中,每例脑梗死患者结构像预处理步骤:①组织分割,采用SPM8自带的脑结构图像模板将患者T1解剖图像进行灰质、白质、脑脊液的分割;②配准与空间标准化,因脑梗死患者的颅脑大小、形态各异,为了减小个体差异,采用VBM8软件的DARTEL工具进行配准及标准化,将T1 BRAVO与MNI先验模板对齐,对图像进行非线性变换,预处理完成后则进行预处理结果显示和样本一致性检测;③平滑,利用8 mm的半高全宽(full width at half maximization, FWHM)高斯平滑核对所有分割后的灰质图像进行平滑。通过后处理得到丘脑和黑质的体积,采用平滑后的灰质图像进行统计学分析。
1.3 统计学方法 VBM处理后的影像数据由SPM8进行统计分析,进行灰质体积比较时,分别以丘脑和黑质模板作为MASK。采用SPM8进行配对t检验,分析脑梗死患者发病1个月、3个月相较1周时丘脑和黑质体积差异。丘脑统计分析时取P<0.01且体素阈值≥50个体素为差异有统计学意义;考虑黑质体积太小,黑质统计分析时取P<0.05且体素阈值≥50个体素为差异有统计学意义。得到的统计参数图用Xjview软件显示并映射到T1图像上生成伪彩图。
2 结果
2.1 基线结果 共纳入23例急性脑梗死患者,其中3例患者因未完成3次颅脑MRI检查而被排除,另有1例患者由于颅脑MRI质量较差而被排除。最终,共有19例患者纳入分析。患者年龄(55.3±13.0)岁,男16例,女3例。梗死部位的分布情况:仅涉及基底节区2例,基底节区、放射冠和/或半卵圆中心8例,基底节区和脑叶2例,额顶颞叶2例,颞顶叶3例,放射冠区和脑叶各1例。所有脑梗死患者为右利手,并且未接受静脉溶栓或血管内介入治疗。
2.2 脑梗死后远隔丘脑和黑质体积变化 与发病1周时相比,脑梗死患者在发病1个月和3个月时同侧丘脑体素值分别缩小637 mm3和1488 mm3(均P<0.01),体积萎缩部位主要位于丘脑背内侧核,见表1与图1、2。同样,与发病1周时相比,脑梗死患者在发病1个月和3个月时同侧黑质体素值分别缩小64 mm3和76 mm3(均P<0.05),见表1与图3、4。
表1 脑梗死患者梗死同侧丘脑和黑质体积变化结果(n=19)Tab.1 Results of volume changes in the ipsilateral thalamic and substantia nigra of patients with cerebral infarction
注:梗死同侧丘脑或黑质在发病1个月、发病3个月分别与1周基线时体积相比较,采用配对t检验进行统计分析。
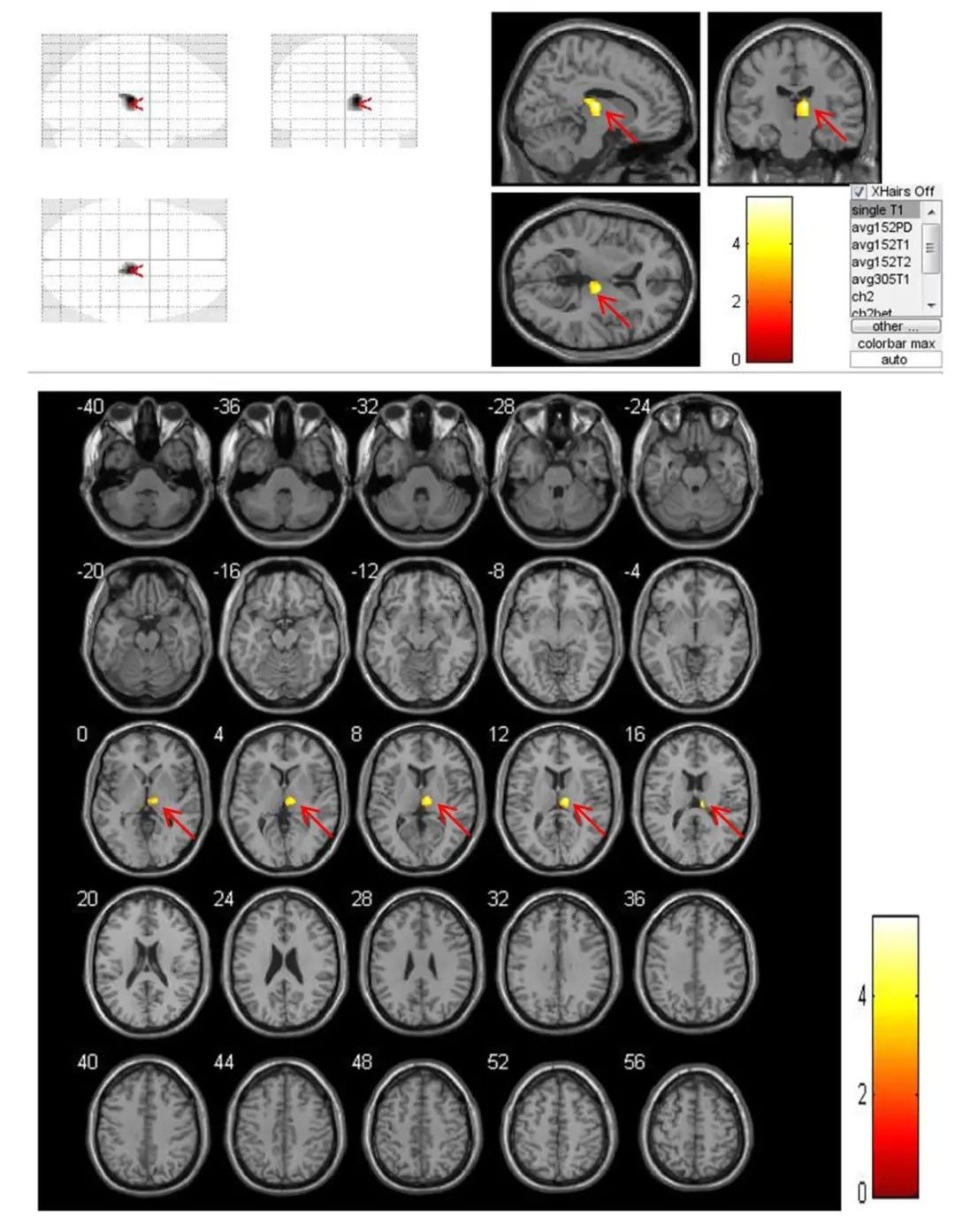
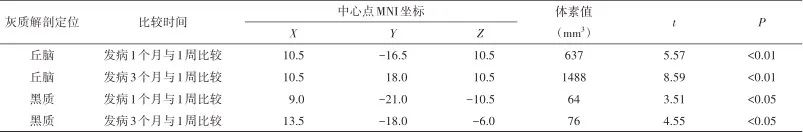
图1 VBM技术对脑梗死患者(n=19)发病1个月与1周时梗死同侧丘脑体积比较结果 注:VBM技术测量脑梗死患者发病1个月与1周时相比,梗死同侧丘脑体积明显缩小,且体积缩小部位主要位于丘脑背内侧核。黄色区域为体积明显缩小部位(红色箭头),不同颜色代表配对t检验的不同t值,P<0.01。Fig.1 Results of VBM technology in comparing the volume of the ipsilateral thalamic in patients (n=19) with cerebral infarction at 1 month and 1 week after onset
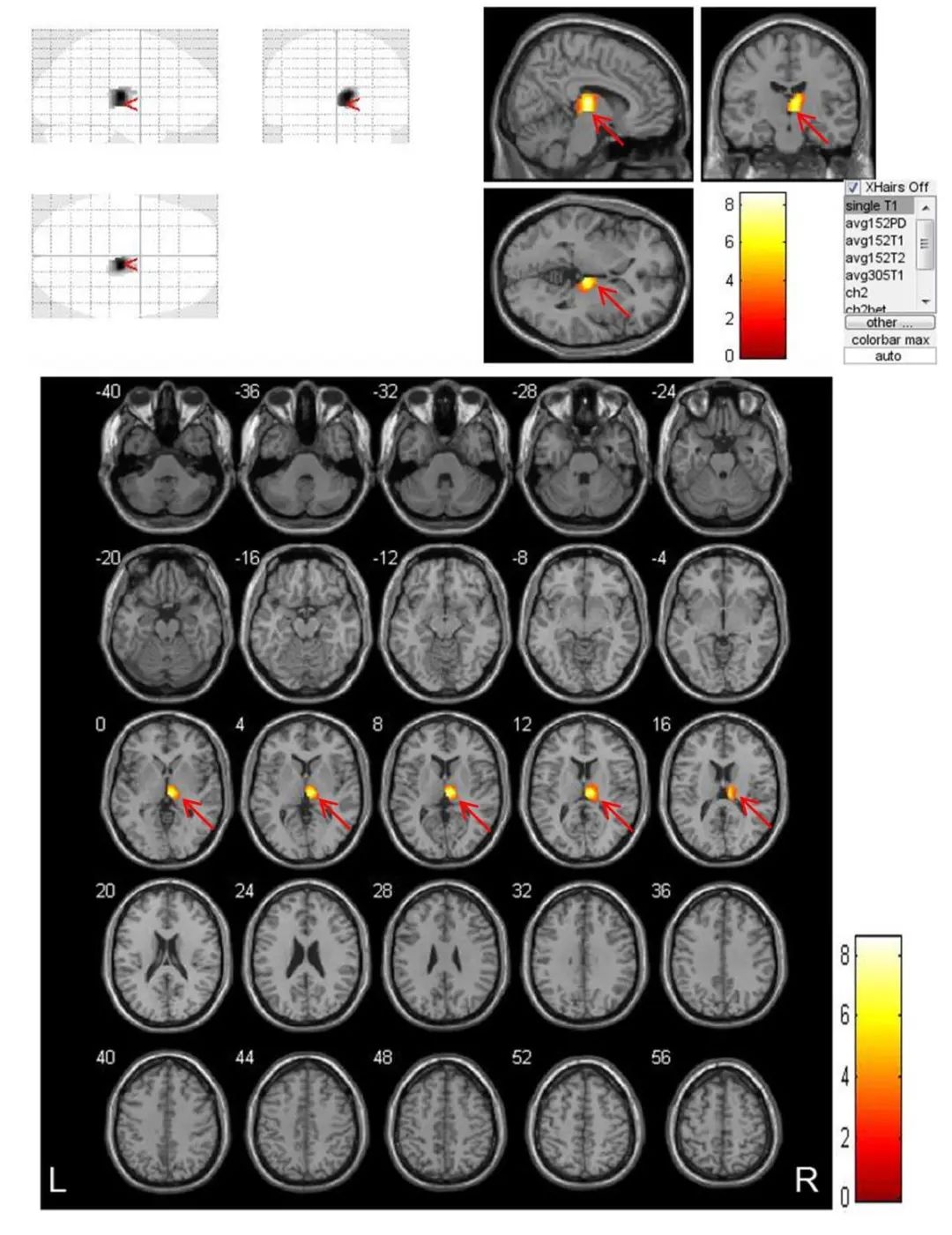
图2 VBM技术对脑梗死患者(n=19)发病3个月与1周时梗死同侧丘脑体积比较结果 注:VBM技术测量脑梗死患者发病3个月与1周时相比,梗死同侧丘脑体积缩小更加显著(红色箭头),且体积缩小部位主要位于丘脑背内侧核。黄色区域为体积显著缩小部位,不同颜色代表配对t检验的不同t值,P<0.01。Fig.2 Results of VBM technology in comparing the volume of the ipsilateral thalamic in patients (n=19) with cerebral infarction at 3 months and 1 week after onset
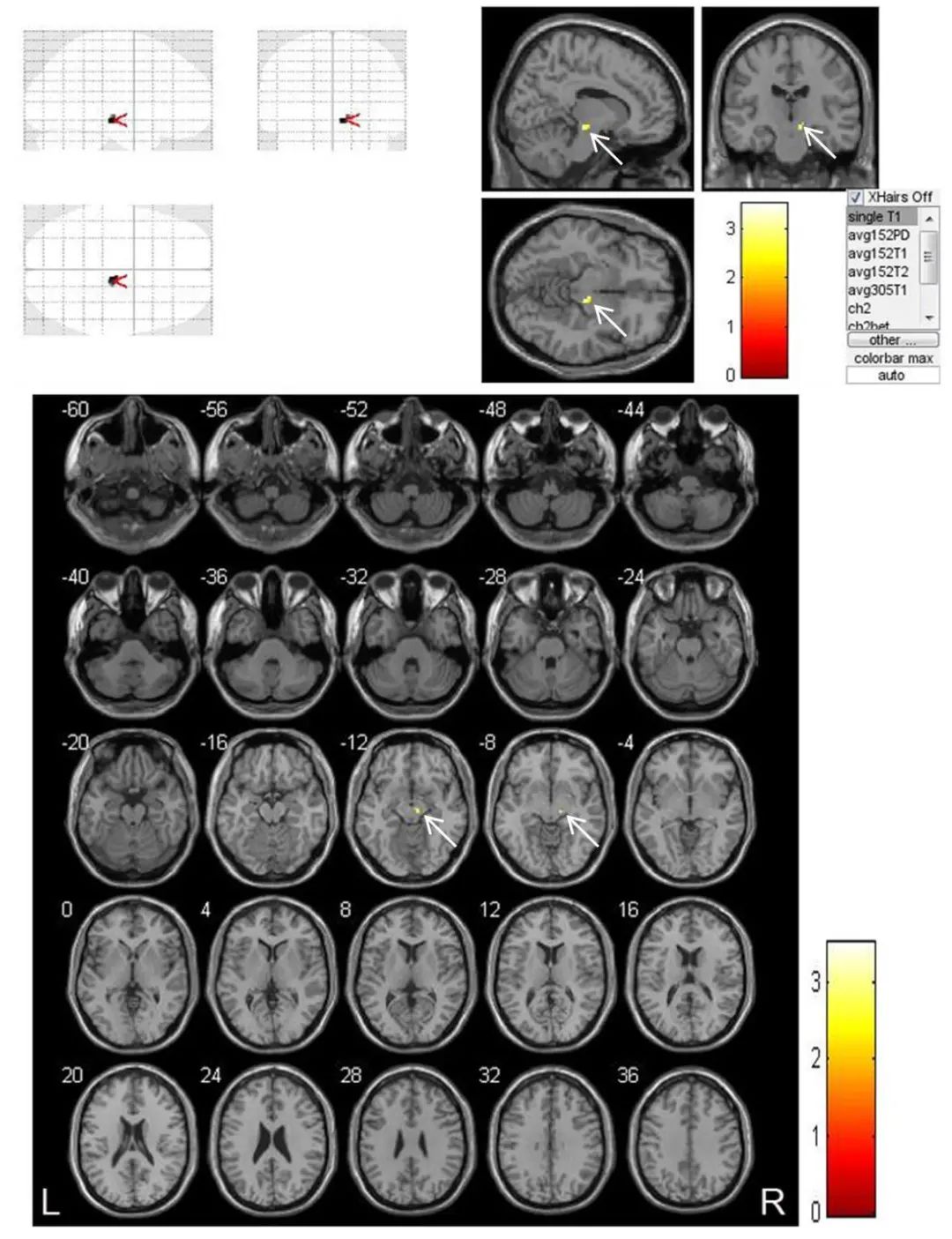
图3 VBM技术对脑梗死患者(n=19)发病1个月与1周时梗死同侧黑质体积比较结果 注:VBM技术测量脑梗死患者发病1个月与1周时相比,梗死同侧黑质体积明显缩小。黄色区域为体积明显缩小部位(白色箭头),不同颜色代表配对t检验不同t值,P<0.05。Fig.3 Results of VBM technology in comparing the volume of the ipsilateral substantia nigra in patients (n=19) with cerebral infarction at 1 month and 1 week after onset
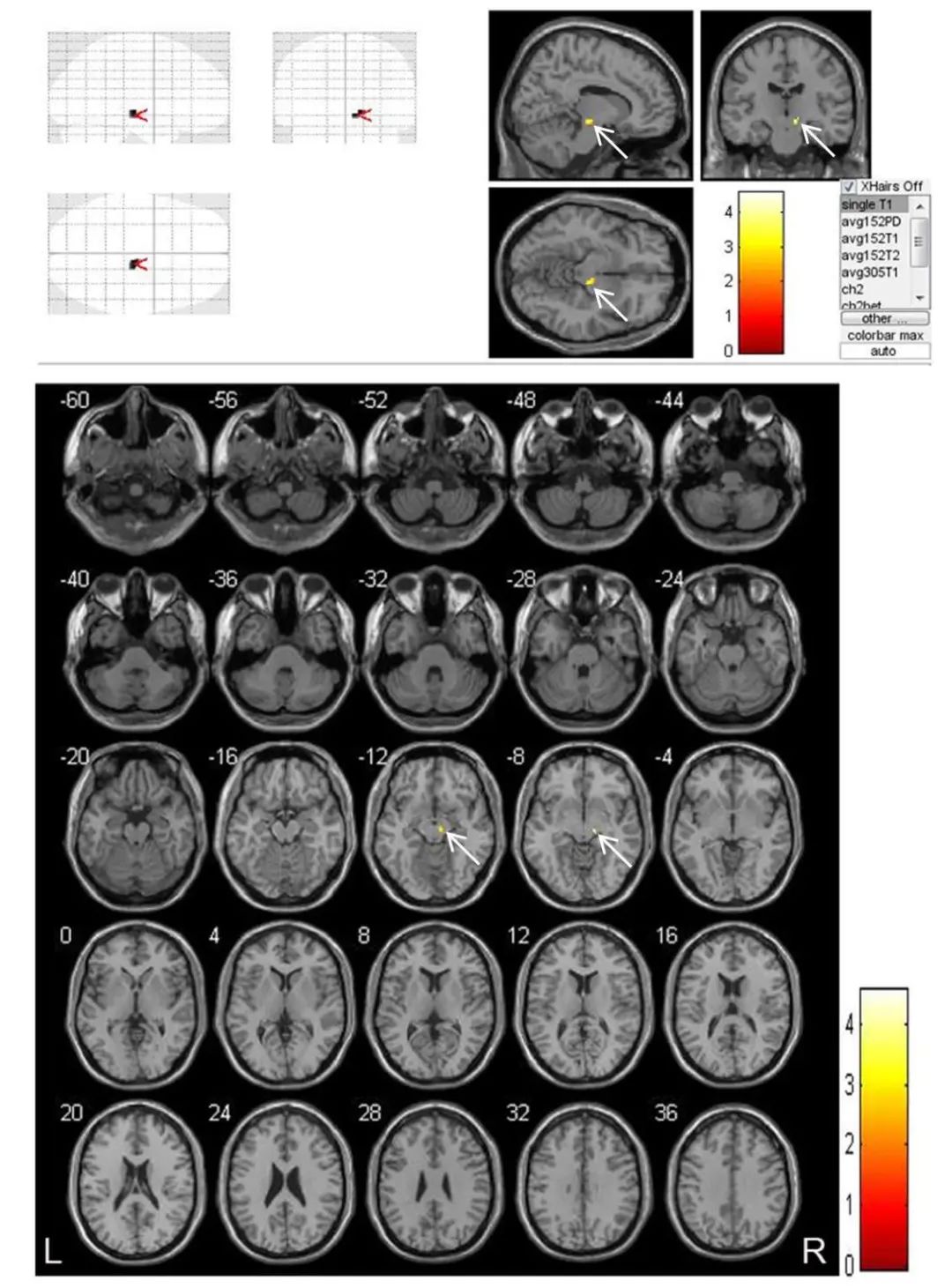
图4 VBM技术对脑梗死患者(n=19)发病3个月与1周时梗死同侧黑质体积比较结果 注:VBM技术测量脑梗死患者发病3个月与1周时相比,梗死同侧黑质体积缩小更加显著。黄色区域为体积显著缩小部位(白色箭头),不同颜色代表配对t检验的不同t值,P<0.05。Fig.4 Results of VBM technology in comparing the volume of the ipsilateral substantia nigra in patients (n=19) with cerebral infarction at 3 months and 1 week after onset
3 讨论
VBM是基于体素的形态测量学方法,通过完全自动化地分析大脑形态来定量计算不同组织密度和体积,以检测脑组织之间的差异。该方法能精确地研究全脑结构,在MRI中量化每个体素的脑组织变化,消除手工勾画误差,并提供可靠的影像学证据,具有自动、全面、客观等优点[4]。目前VBM主要用于研究精神分裂症[5-8]、癫痫[9-10]、阿尔茨海默病[11-12]、轻度认知功能障碍[13]、亨廷顿舞蹈症[14]、帕金森病[15]和脑梗死[16]等。本研究利用VBM动态测量脑梗死患者远隔部位丘脑和黑质体积,结果表明发病时间从1周、1个月到3个月时远隔部位丘脑和黑质体积进行性缩小。这些发现有助于深入了解脑梗死后远隔脑区的动态变化,为相关病理生理过程提供重要线索。
前循环脑梗死后远隔部位(如丘脑和黑质)常发生继发性损害[17-19],其可能的机制涉及神经轴突变性[20]、神经递质分泌和调节失衡[21]、神经炎性反应[22]及β淀粉样肽沉积[23-24]等。丘脑是间脑中最大的核团,位于第三脑室两侧,被认为是信息传递的中继站,参与多种功能调节,包括意识、认知、语言、运动、感觉和视觉等[25-26]。其中,丘脑背内侧核在认知功能中发挥重要作用,如记忆、注意力、情感和抽象思维,且该脑区与边缘系统和前额叶皮质有紧密的联系,是边缘系统(豆状核和尾状核)的主要投射区,其主要传入纤维来自边缘系统,并投射至杏仁核和尾状核[27]。既往采用计算机断层扫描观察MCA供血区脑梗死患者的研究表明,在脑梗死发病后至少3个月才能观察到梗死同侧丘脑轻度萎缩[28]。另一项研究利用功能性MRI观察前循环脑梗死患者的丘脑体积变化,发现在脑梗死后3个月时,与基线相比,丘脑体积明显减小[29]。本研究采用VBM方法,在发病1个月时即发现MCA供血区脑梗死患者同侧丘脑萎缩。这表明相比较上述两项常规影像学技术,VBM可能在早期观察脑梗死后远隔损害方面具有更大优势。既往有研究在前循环脑梗死患者发病第7天进行VBM检查,但并未观察到中脑有继发性萎缩的迹象[30],而本研究在发病1个月时发现梗死同侧丘脑体积缩小,且丘脑萎缩的位置主要位于背内侧核,这表明在发病1个月时采用VBM可敏感地观察到丘脑继发性萎缩,并准确定位萎缩位置。本研究发现丘脑体积缩小的位置主要位于背内侧核,这可能与本研究纳入的19例脑梗死患者中有12例患者梗死部位累及基底节区有关,基底节区核团多与丘脑背内侧核有纤维联系,在脑梗死后发生纤维逆行性损害可造成丘脑继发性萎缩[31],推测丘脑体积缩小部位主要位于丘脑背内侧核可能与原发梗死灶和丘脑背内侧核之间纤维联系发生继发性改变密切相关。
黑质位于中脑被盖和大脑脚底之间,是脑内合成多巴胺的主要核团,在正常生理状态下,是调节运动的重要中枢。既往研究表明,MCA闭塞患者中约50%可在病灶同侧黑质新出现T2和DWI高信号改变[18]。本研究通过VBM观察到明显的脑梗死后远隔黑质继发性萎缩,进一步印证了先前研究的发现。这可能是由于黑质与幕上脑组织存在大量联系,如大脑皮质纹状体和纹状体黑质通路相连,当这种联系发生逆行性损害时可能会引起黑质继发性损害。另外,戴旖等[19]发现纹状体梗死会导致同侧纹状体黑质通路的纤维束发生继发性损害,且这种继发损害至少在12周内持续存在,并可能延缓患者的神经功能恢复。因此黑质损害可能是由纹状体及大脑皮质缺血后的跨神经元变性所致。
本研究的局限性:①样本量较小;②本研究观察随访期较短,需要在以后的临床研究中进行更长时间的随访,以便探究脑梗死远隔损害的持续时间是否更久;③本研究收集的患者神经功能缺损偏轻,核心梗死体积偏小,这可能影响远隔部位继发性萎缩程度。尽管如此,本研究仍能利用VBM观察到脑梗死后远隔损害这一现象。综上所述,利用VBM技术能在脑梗死后1个月明显观察到MCA供血区脑梗死患者同侧丘脑和黑质继发性萎缩,而且VBM能精确定位萎缩位置,为脑梗死远隔丘脑和黑质损害提供早期影像学证据。
参考文献:
1. DATTA A, SARMAH D, KALIA K, et al. Advances in studies on stroke-induced secondary neurodegeneration (SND) and its treatment[J]. Curr Top Med Chem, 2020, 20(13): 1154-1168.
2. UCHIDA H, YOKOYAMA H, KIMOTO H, et al. Long-term changes in the ipsilateral substantia nigra after transient focal cerebral ischaemia in rats[J]. Int J Exp Pathol, 2010, 91(3): 256-266.
3. LIANG Z, ZENG J, LIU S, et al. A prospective study of secondary degeneration following subcortical infarction using diffusion tensor imaging[J]. J Neurol Neurosurg Psychiatry, 2007, 78(6): 581-586.
4. ASHBURNER J, FRISTON K J. Voxel-based morphometry--the methods[J]. Neuroimage, 2000, 11(6 Pt 1): 805-821.
5. ALEXANDROS LALOUSIS P, SCHMAAL L, WOOD S J, et al. Inflammatory subgroups of schizophrenia and their association with brain structure: A semi-supervised machine learning examination of heterogeneity[J]. Brain Behav Immun, 2023, 113: 166-175.
6. SCHULZ J, BRANDL F, GROTHE M J, et al. Basal-forebrain cholinergic nuclei alterations are associated with medication and cognitive deficits across the schizophrenia spectrum[J]. Schizophr Bull, 2023, 49(6): 1530-1541.
7. WOLF R C, RASHIDI M, SCHMITGEN M M, et al. Neurological soft signs predict auditory verbal hallucinations in patients with schizophrenia[J]. Schizophr Bull, 2021, 47(2): 433-443.
8. 李青, 冉娅, 魏巍, 等. 首发未治疗精神分裂症缺陷和非缺陷亚型脑结构磁共振研究[J]. 中国神经精神疾病杂志, 2022, 48(3): 139-143.
9. NEUHAUS E, BITZER F, HELD N R, et al. Volumetric gray matter findings in autonomic network regions of people with focal epilepsy[J]. J Neuroimaging, 2023, 34(1): 55-60.
10. 黄书蕾, 于云莉. 颞叶癫痫视空间工作记忆障碍皮质形态学研究进展[J]. 中国神经精神疾病杂志, 2021, 47(2): 117-120.
11. KOBAYASHI R, HAYASHI H, KAWAKATSU S, et al. Comparing medial temporal atrophy between early-onset semantic dementia and early-onset Alzheimer's disease using voxel-based morphometry: A multicenter MRI study[J]. Curr Alzheimer Res, 2022, 19(7): 503-510.
12. GUPTA Y, LEE K H, CHOI K Y, et al. Early diagnosis of Alzheimer's disease using combined features from voxel-based morphometry and cortical, subcortical, and hippocampus regions of MRI T1 brain images[J]. PLoS One, 2019, 14(10): e0222446.
13. LI M G, HE J F, LIU X Y, et al. Structural and functional thalamic changes in Parkinson's disease with mild cognitive impairment[J]. J Magn Reson Imaging, 2020, 52(4): 1207-1215.
14. LEE P, RYOO H, PARK J, et al. Morphological and microstructural changes of the hippocampus in early MCI: A study utilizing the Alzheimer's disease neuroimaging initiative database[J]. J Clin Neurol, 2017, 13(2): 144-154.
15. XU Y, YANG J, HU X, et al. Voxel-based meta-analysis of gray matter volume reductions associated with cognitive impairment in Parkinson's disease[J]. J Neurol, 2016, 263(6): 1178-1187.
16. CONRAD J, HABS M, BOEGLE R, et al. Global multisensory reorganization after vestibular brain stem stroke[J]. Ann Clin Transl Neurol, 2020, 7(10): 1788-1801.
17. CAO Z, HARVEY S S, BLISS T M, et al. Inflammatory responses in the secondary thalamic injury after cortical ischemic stroke[J]. Front Neurol, 2020, 11: 236.
18. 李蕃. 大脑中动脉供血区梗死后远隔部位损害的影像与临床特点分析[D]. 济南: 山东大学, 2012.
19. 戴旖, 秦超, 梁志坚, 等. 纹状体梗死后黑质继发性损害的弥散张量成像[J]. 中国神经精神疾病杂志, 2010, 36(8): 472-475.
20. BEIROWSKI B, ADALBERT R, WAGNER D, et al. The progressive nature of Wallerian degeneration in wild-type and slow Wallerian degeneration (WldS) nerves[J]. BMC Neurosci, 2005, 6: 6.
21. SEO J P, RYU H J. Neural injury of the dopaminergic pathways in patients with middle cerebral artery territory infarct: A diffusion tensor imaging study[J]. Brain Sci, 2023, 13(6): 927.
22. CAO Z, HARVEY S S, CHIANG T, et al. Unique subtype of microglia in degenerative thalamus after cortical stroke[J]. Stroke, 2021, 52(2): 687-698.
23. ZHANG Y, XING S, ZHANG J, et al. Reduction of β-amyloid deposits by γ-secretase inhibitor is associated with the attenuation of secondary damage in the ipsilateral thalamus and sensory functional improvement after focal cortical infarction in hypertensive rats[J]. J Cereb Blood Flow Metab, 2011, 31(2): 572-579.
24. ZUO X, HU S, TANG Y, et al. Attenuation of secondary damage and aβ deposits in the ipsilateral thalamus of dMCAO rats through reduction of cathepsin B by bis(propyl)-cognitin, a multifunctional dimer[J]. Neuropharmacology, 2020, 162: 107786.
25. WOLFF M, VANN S D. The cognitive thalamus as a gateway to mental representations[J]. J Neurosci, 2019, 39(1): 3-14.
26. TUTTLE C, BOTO J, MARTIN S, et al. Neuroimaging of acute and chronic unilateral and bilateral thalamic lesions[J]. Insights Imaging, 2019, 10(1): 24.
27. AHMED N, PARÉ D. The basolateral amygdala sends a mixed (gabaergic and glutamatergic) projection to the mediodorsal thalamic nucleus[J]. J Neurosci, 2023, 43(12): 2104-2115.
28. TAMURA A, TAHIRA Y, NAGASHIMA H, et al. Thalamic atrophy following cerebral infarction in the territory of the middle cerebral artery[J]. Stroke, 1991, 22(5): 615-618.
29. YASSI N, MALPAS C B, CAMPBELL B C, et al. Contralesional thalamic surface atrophy and functional disconnection 3 months after ischemic stroke[J]. Cerebrovasc Dis, 2015, 39(3-4): 232-241.
30. 黄婷. 应用磁共振弥散张量成像(DTI)及基于体素的形态学分析(VBM)探讨脑出血和脑梗死远隔损伤的研究[D]. 广州: 暨南大学, 2018.
31. NAKAJIMA M, INATOMI Y, OKIGAWA T, et al. Secondary signal change and an apparent diffusion coefficient decrease of the substantia nigra after striatal infarction[J]. Stroke, 2013, 44(1): 213-216.
【引用格式】陈丹霞,徐炳东,皮凤玲,等. 基于体素形态学分析探讨脑梗死远隔丘脑和黑质损害研究[J]. 中国神经精神疾病杂志,2024,50(4):215-220.
【Cite this article】CHEN D X,XU B D,PI F L,et al. Investigating the distant thalamic and substantia nigra damage in patients with cerebral infarction based on voxel morphology analysis[J]. Chin J Nervous Mental Dis,2024,50(4):215-220.
DOI:10.3969/j.issn.1002-0152.2024.04.003
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#脑梗死# #大脑中动脉# #丘脑# #体素形态学分析#
114