临床研究|慢性HBV感染者组织学免疫耐受状态无创诊断指标及相关模型的建立与评价
2025-01-02 临床肝胆病杂志 临床肝胆病杂志 发表于陕西省
本研究中,因考虑到ALT和AST的非特异性以及其易受许多非病毒学指标的影响,所以尝试以HBeAg阳性、高病毒复制、轻(无)炎症损伤为特征定义组织学意义上的“免疫耐受”状态。
HBV感染是慢性乙型肝炎(CHB)、肝硬化和肝细胞癌发生的主要致病因素。已知嗜肝性的HBV并不具有直接的致感染肝细胞病变效应,这意味着慢性HBV感染的肝损伤主要是宿主免疫系统控制清除感染病毒肝细胞造成的免疫病理损伤,即慢性HBV感染疾病进展及转归是病毒持续感染与宿主抗病毒免疫相互作用的结果。1985年,我国台湾学者发现,以母婴垂直传播为主要传播方式的慢性HBV感染者疾病进程早期多表现为高病毒复制和轻(无)肝脏炎症的特点,并据此引入了“宿主免疫”的概念,将慢性HBV感染自然进程划分为免疫耐受期(HBeAg阳性慢性感染)、免疫激活或免疫清除期(HBeAg阳性CHB)、免疫控制下的非活动携带期(HBeAg阴性慢性感染)和再活动期(HBeAg阴性CHB),并被各大指南沿用至今。
然而,值得注意的是,尽管自然史分期曾采用免疫学概念来描述,但一直缺乏直接的免疫学证据和指标来支持对各期的界定。现有的各大指南对于慢性HBV感染者的“免疫耐受期”的定义是以患者肝组织病理学界定的,即在HBeAg阳性患者中,肝组织无明显炎症坏死和纤维化,反映肝损伤的生化指标低于正常值且HBV DNA处于高水平状态。
真实的“免疫耐受”状态是否存在以及如何界定尚有争议。Kennedy等收集不同年龄“免疫耐受期”患者的T淋巴细胞,发现儿童和青少年具有更多的HBV特异性T淋巴细胞;Mason等的研究认为慢性HBV感染自然史中并不存在“免疫耐受期”,更倾向于描述为“高病毒复制,低炎症损伤”时相。因为处在“免疫耐受期”的慢性HBV感染者与HBeAg阳性CHB患者以及HBeAg阴性CHB患者一样,均能检测到肝脏炎症、HBV整合以及整合肝细胞克隆性细胞集落,同时伴随着HBV特异性细胞免疫反应及肝内免疫细胞浸润。本实验室前期研究也发现,HBsAg宫内暴露的小鼠对乙型肝炎疫苗刺激激活了更强的免疫应答且具有抗-HBs免疫记忆。从免疫学定义来讲,HBV“免疫耐受期”患者应不存在HBV特异性细胞免疫、体液免疫,甚至也不存在固有免疫识别反应,依照这一定义,CHB疾病进展中是否存在真正的“免疫耐受期”值得商榷。
然而,Milich等持不同意见,认为“高复制低炎症”是描述性的,“免疫耐受”解释了高复制低炎症的机制,且由于慢性HBV感染疾病的进展主要是HBV特异性免疫清除感染肝细胞导致的,因此在命名疾病的各个阶段时,仍有必要继续采用免疫学术语。Liaw等也认为,从临床角度看“免疫耐受”仍然是正确的。由于真正免疫耐受状态的慢性感染者肝组织往往没有明显的肝损伤,且通常对抗病毒治疗缺乏有效的应答,一般认为此时并不亟须启动抗病毒治疗。因此准确地甄别处于“免疫耐受”状态的患者仍有其临床意义。
实验室前期临床队列研究发现,在HBeAg阳性且HBV DNA>2×106 IU/mL的慢性HBV感染者中,其HBV病毒学指标如HBV DNA、qHBsAg及HBeAg定量(或半定量)水平与患者肝脏免疫介导的损伤程度呈负相关,显示此时宿主免疫耐受状态已被打破,并能够有效清除感染肝细胞和出现HBV DNA水平的下降。因此,应采用更高的HBV DNA水平来辅助界定免疫耐受状态。
ALT和AST虽可在一定程度上反映肝细胞损伤程度,但因其受多种因素影响,特异性差且各大指南正常范围标准不一,在我国《慢性乙型肝炎防治指南(2022年版)》中指出,慢性HBV感染者1年内连续随访3次且每次至少间隔3个月ALT/AST正常才能定义为ALT/AST持续正常。
本研究中,因考虑到ALT和AST的非特异性以及其易受许多非病毒学指标的影响,所以尝试以HBeAg阳性、高病毒复制、轻(无)炎症损伤为特征定义组织学意义上的“免疫耐受”状态,有助于鉴别肝组织学意义上的“免疫耐受”状态,实现此类患者的精准诊疗。
1资料与方法
1.1 研究对象
从实验室既往研究队列中纳入2010年1月—2022年12月中国人民解放军总医院第五医学中心、天津市第二人民医院、上海瑞金医院和浙江省台州医院HBeAg阳性、HBV DNA>2×106 IU/mL的慢性HBV感染者为研究对象。纳入标准:(1)年龄≥18周岁者;(2)HBsAg阳性≥6个月者;(3)未接受抗病毒治疗者;(4)接受肝组织穿刺检查有明确病理诊断者。排除标准:(1)合并有其他病毒性肝炎、自身免疫性肝炎、酒精性肝炎以及非酒精性脂肪性肝炎等导致肝损伤者;(2)合并心、脑、肾等其他重要脏器功能衰竭或者恶性肿瘤者;(3)女性妊娠、哺乳者。
1.2 血液生化、病毒学指标检测
收集入组患者性别、年龄等人口学资料;血液生化指标应用全自动生化分析仪进行检测;HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc定量应用化学发光法检测(ARCHITECTi2000SR),HBsAg检测下限为0.05 IU/mL;HBV DNA病毒载量使用COBAS Ampliprep/COBAS TaqMan48进行检测,检测下限为20 IU/mL。
1.3 肝组织活检病理检测
肝活检组织经4%甲醛液固定,石蜡包埋,连续5 μm组织切片,常规进行HE、Masson染色,显微镜下观察炎症、纤维化程度及病变特点,根据《慢性乙型肝炎防治指南(2022年版)》对肝组织炎症活动度(G0~G4)和纤维化程度(S0~S4)进行分级。显著肝损伤定义为经病理学诊断存在中度以上肝脏炎症(≥G2)和/或中度及以上纤维化(≥S2)。
2结果
2.1 一般资料
本研究共纳入4家医院577例符合入组条件的未经抗病毒治疗的慢性HBV感染者,其中HBV DNA>2×107 IU/mL有438例,HBV DNA>1×108 IU/mL有251例,HBV DNA>2×108 IU/mL有171例。577例患者中,男329例,女248例;平均年龄33岁。入组患者根据肝活检结果分为存在显著肝损伤组(n=369)和无显著肝损伤组(n=208),基本临床特征及病毒学指标分布情况见表1。已经打破免疫耐受的肝组织存在显著肝损伤(≥G2和/或≥S2)患者的ALT和AST水平显著高于无显著肝损伤患者,同时,病毒学指标显著低于无显著肝损伤的患者(P值均<0.05)。
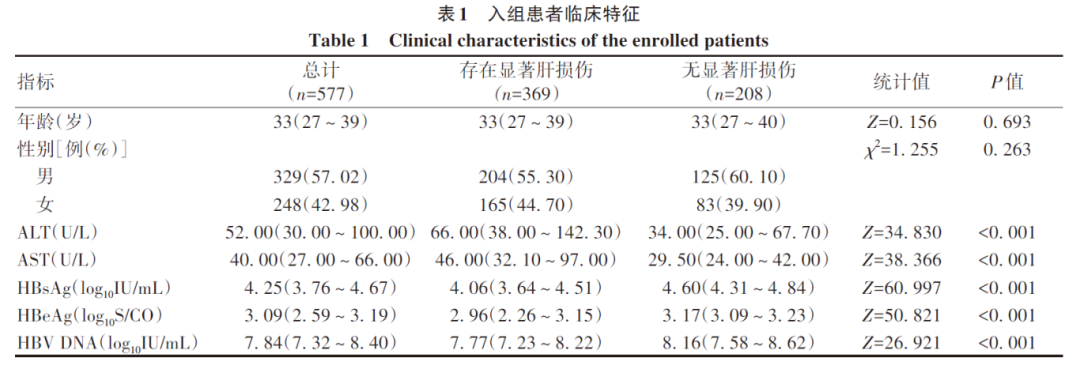
2.2 根据各大指南无创指标计算组织学免疫耐受期患者所占比例
本研究分析了除去ALT/AST之外的其他无创病毒学指标对组织学免疫耐受状态患者的诊断效能。表2是分别依据各大CHB防治指南病毒学无创指标所鉴定出的免疫耐受状态患者中符合本文定义的组织学免疫耐受状态的比例。结果显示,即使提高HBV DNA至108 IU/mL(Mason等2016年在Gastroenterology发表文章入组的免疫耐受期患者HBV DNA平均值为108 IU/mL),组织学免疫耐受状态患者所占比例(44.6%)也不超过50%。

2.3 确定与肝组织炎症活动度出现负相关性消失时的HBV DNA上限阈值
当HBeAg阳性患者血清HBV DNA水平升高至2×108 IU/mL时,其水平与肝炎活动程度相关性消失(r=-0.029,P=0.704)(表3),符合组织学免疫耐受状态的比例为52.0%(89/171),与HBV DNA高于2×106 IU/mL(36.0%,208/577)、2×107 IU/mL(47.0%,164/349)和1×108 IU/mL(44.6%,112/251)相比,仅略有升高。这可能是因为,在这些HBV DNA>2×108 IU/mL的患者中,其HBsAg,特别是HBeAg仍和肝脏炎症活跃度及反映肝脏炎症损伤的生化指标有着不同程度的有统计学意义的负相关性(表3),提示部分患者免疫耐受状态已被“打破”。
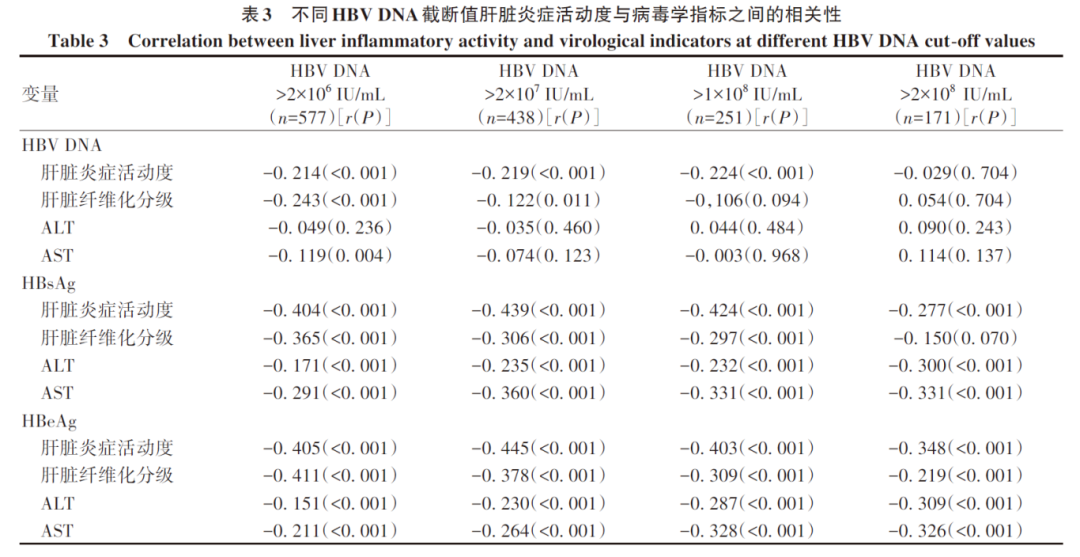
2.4 多指标联合寻找确定组织学免疫耐受状态患者的最佳诊断模型
考虑到即使将HBV DNA阈值升高至2×108 IU/mL,仍有相当比例(48.0%,82/171)的慢性HBV感染者已经存在明显的肝脏炎症损伤,因此,本研究试图在此基础上联合其他无创指标以提高组织学免疫耐受状态患者的诊断准确度。
在血清HBV DNA>1×108的HBeAg阳性患者队列(n=251)中,显著肝损伤组(n=140)与无显著肝损伤组(n=111)比较,ALT、AST、HBsAg、HBeAg、HBV DNA水平比较均存在统计学差异(P值均<0.05)(表4);进一步二元Logistic回归分析结果显示,AST、HBeAg、HBV DNA是影响患者组织学免疫耐受状态的独立影响因素(P值均<0.05)(表5)。考虑到HBeAg是半定量指标,且大部分临床医生重点关注的是HBeAg阴/阳性问题,故只将AST、HBV DNA纳入建立模型:logit(P)=-9.315-0.032×AST+1.236×log10 HBV DNA,AUC为0.800,通过约登指数得出的最佳临界值所对应的敏感度和特异度分别为94.3%、55.0%(图1)。
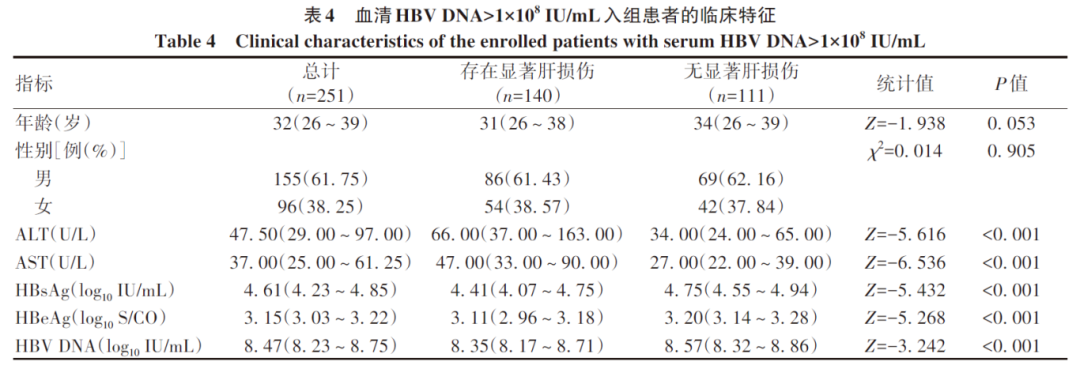
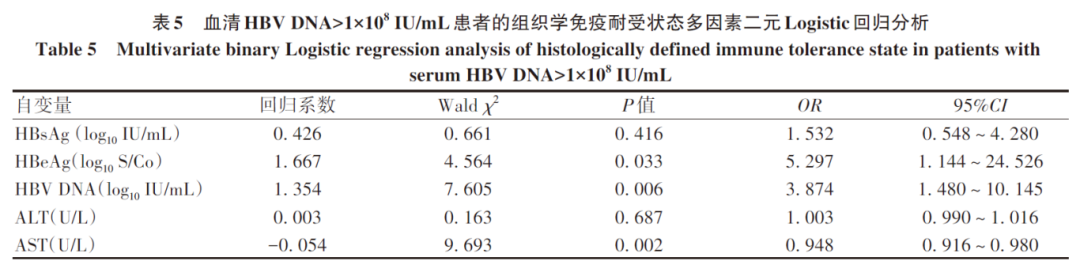
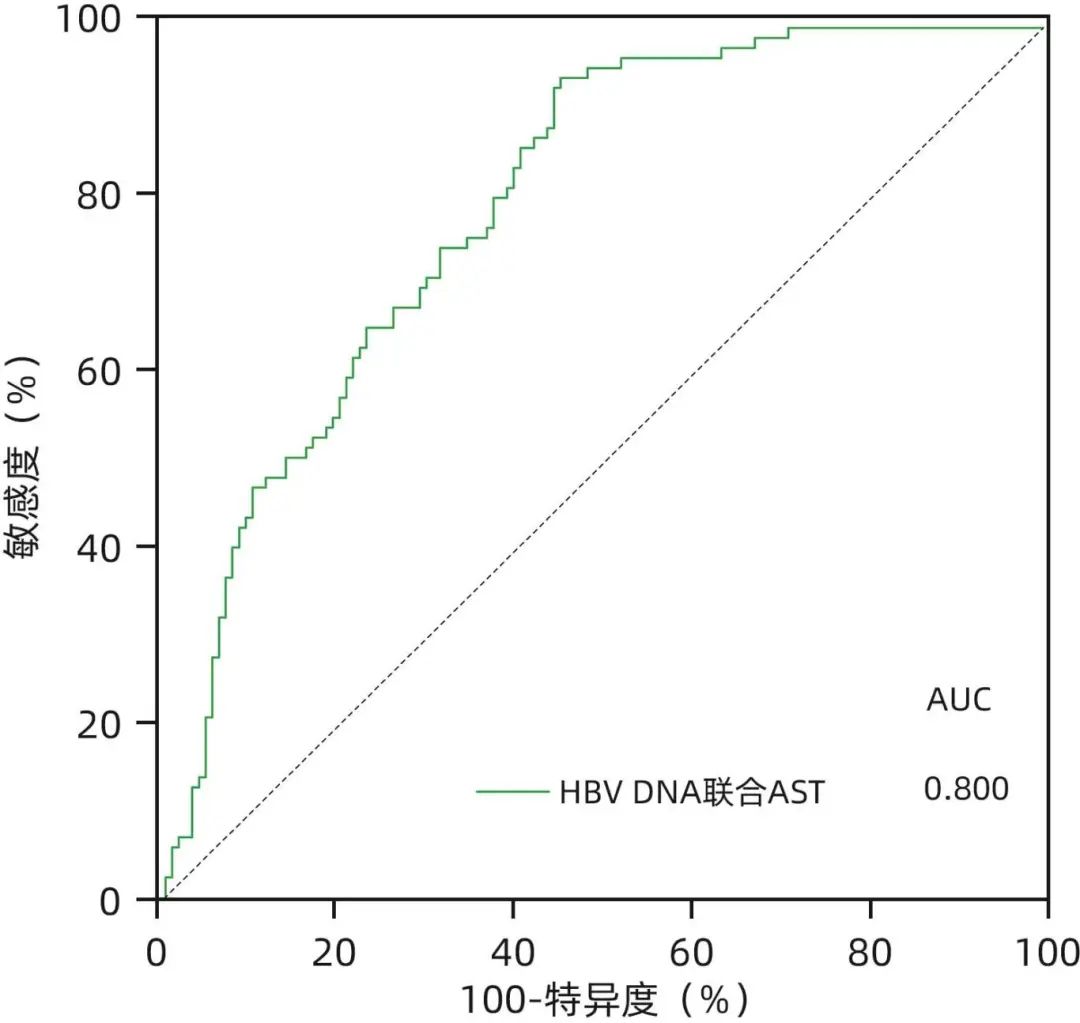
图1 血清HBV DNA>1×108 IU/mL患者的组织学免疫耐受状态ROC曲线
由于HBeAg阳性患者血清HBV DNA水平升高至2×108 IU/mL时,其水平与肝炎活动程度相关性消失(P=0.704),同时考虑到临床可操作性,在血清HBV DNA>2×108 IU/mL的患者中,将AST单独纳入二元Logistic回归分析,回归方程模型:logit(P)=1.424-0.028×AST,AUC为0.730(图2),模型预测效果良好,通过约登指数得出AST最佳临界值为30.5 U/L,敏感度和特异度分别为52.8%、84.1%。因此,在血清HBV DNA>2×108 IU/mL的HBeAg阳性患者中,若AST>30.5 U/L,应考虑患者的组织学免疫耐受状态已经被“打破”。
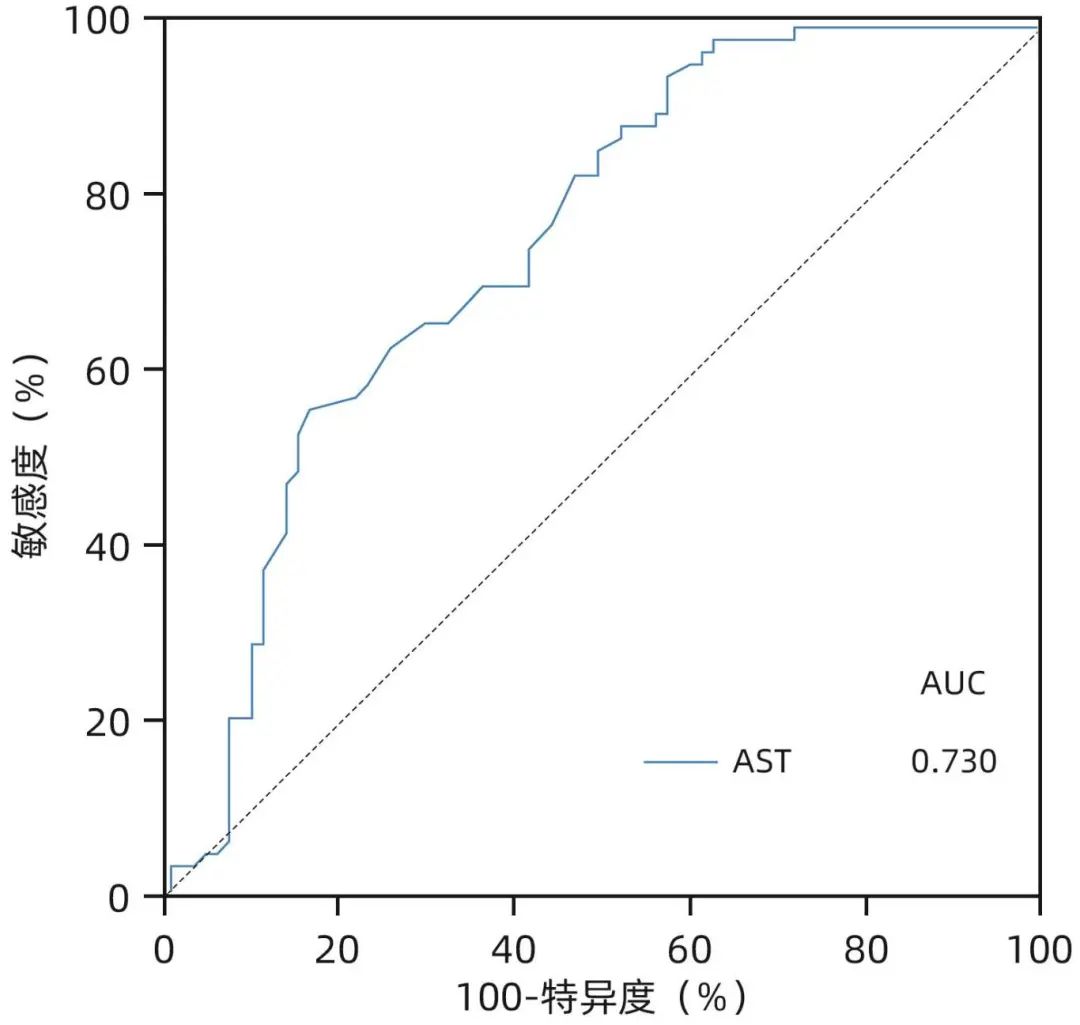
图2 血清HBV DNA>2×108 IU/mL患者的组织学免疫耐受状态ROC曲线
2.5 不同诊断模型预测效能的比较
目前针对免疫耐受期的无创诊断模型主要包括AST/ALT、FIB-4和APRI。进一步使用浙江省台州医院接受肝穿刺活检的238例成人慢性HBV感染者作为验证队列,在血清HBV DNA>2×108 IU/mL的HBeAg阳性患者中,将ALT/AST、FIB-4、APRI与本研究建立的诊断模型进行比较,结果显示,本研究建立的模型预测效能优于AST/ALT、FIB-4、APRI(AUC分别0.698、0.555、0.518、0.373,P值均<0.05)(图3)。
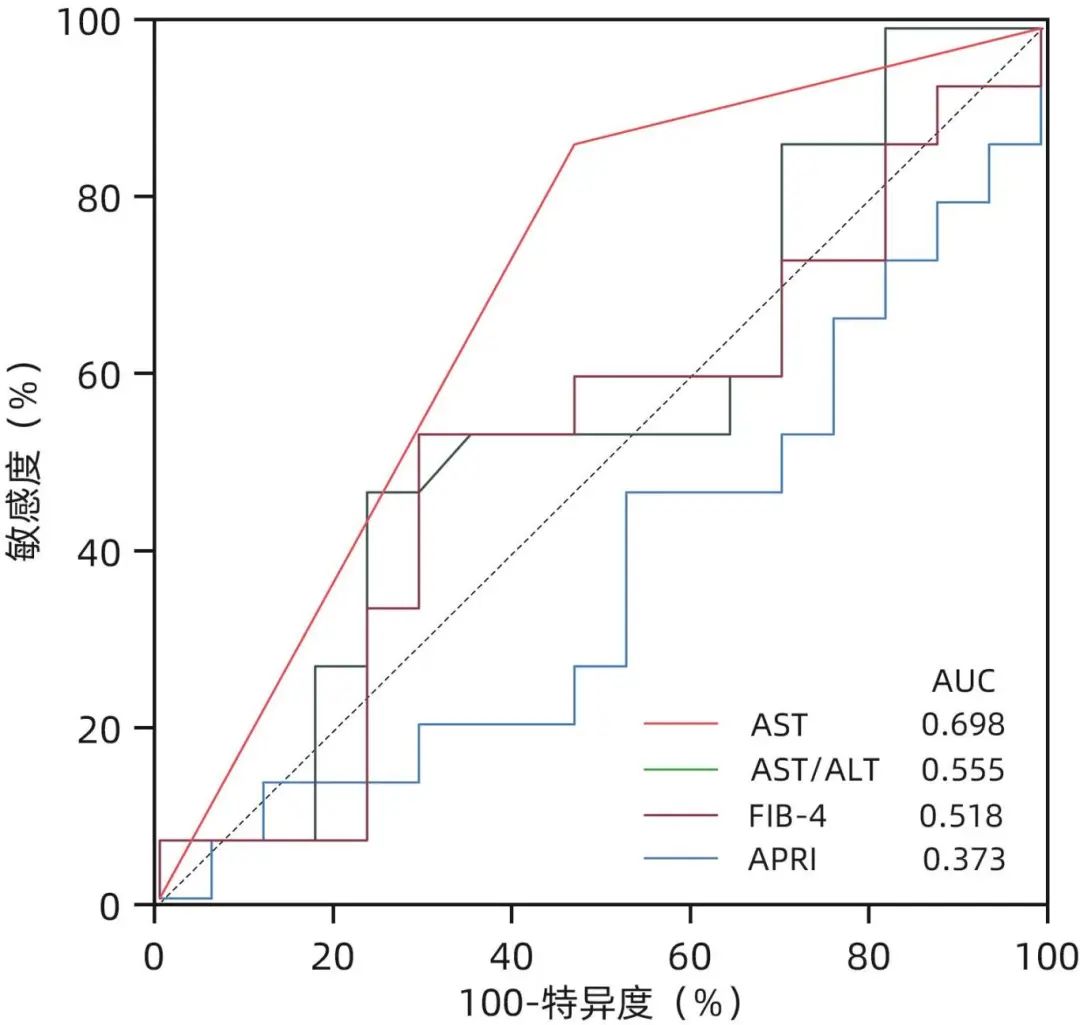
图3 多种无创模型诊断患者组织学免疫耐受状态的ROC曲线
3讨论
由于曾有采用配对肝活检的研究数据显示,免疫耐受期的患者5年内肝损伤的进展微乎其微。因此,现阶段各大指南对“免疫耐受期”患者的管理建议是对组织学诊断的真正“免疫耐受期”患者不推荐进行抗病毒治疗。但目前国际上对真正的免疫耐受期的定义尚未达成共识,也缺乏有效的鉴定手段。
本研究首先提出了“组织学免疫耐受状态”的建议,在现阶段缺乏有效的评判免疫状态的免疫学指标的现实下,在临床实践中定义患者是否处于“组织学免疫耐受状态”可能更加实用。因为一方面,真正的组织学免疫耐受阶段的患者疾病进展风险小,且即使开展抗病毒治疗,其病毒学应答也不令人满意;而另一方面,在Kennedy等和Mason等按现行的HBeAg阳性、高病毒复制且ALT水平正常等指标纳入其研究的免疫耐受期患者中,相当比例患者的肝组织已经存在显著肝损伤,不再是真正意义上的“免疫耐受期”。不仅如此,这些患者的肝组织往往有相当数量的、携带了HBV DNA整合片段的细胞克隆集落。其表达HBsAg的能力不仅使CHB难以实现临床治愈,伴随着增殖的突变积累也增加了患者未来肝细胞癌发生的风险。因此,进一步明确免疫耐受患者的定义,并尝试建立甄别符合真正免疫耐受状态的慢性HBV感染者的手段极为重要。
肝活检是评估免疫介导的肝损伤程度及是否启动抗病毒治疗的金标准,但因有创性难以常规开展。本研究在实验室前期工作的基础之上,尝试采用不同的无创指标在HBeAg阳性、HBV DNA>2×106 IU/mL的慢性HBV感染者中筛选出“组织学免疫耐受状态”的患者。然而,尽管发现当HBV DNA>2×108 IU/mL,免疫介导的肝损伤与HBV DNA相关性消失,但由于其与HBsAg/HBeAg的负相关性依然存在,以致由此定义的“组织学免疫耐受状态”者中存在明显肝组织学损伤的比例仍高达48%。因此有必要增加新的无创指标来进一步精准诊断。
本研究发现以AST异常升高(>30.5 U/L)辅助研判慢性HBV感染者的“组织学免疫耐受状态”是否被“打破”,可在HBeAg阳性、HBV DNA>2×108 IU/mL的慢性感染者中鉴别组织学免疫耐受状态的患者,这将有助于HBeAg阳性且HBV DNA高水平患者的临床管理。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH241208

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#HBV感染# #免疫耐受#
9