陈学思院士团队ACS Nano:多酶活性聚合物纳米反应器,可用于铁死亡-细胞凋亡协同抗癌治疗
2024-12-03 BioMed科技 BioMed科技 发表于陕西省
长春应化所制备 HPG@hemin-GOx 纳米反应器,具多酶活性,可诱导凋亡与铁死亡,通过系列评估证实其体外、体内抗癌效果佳,为肿瘤治疗提供新方法。
通过酶催化同时诱导铁死亡和凋亡是癌症治疗中一种有前景的模式。受DNA和G-四链体/血红素DNA酶的结构启发,长春应化所陈学思院士、肖春生、张鹏通过一步组装修饰了苯硼酸的透明质酸(HA-PBA)、鸟苷(G)、血红素和葡萄糖氧化酶(GOx),制备了一种无DNA的鸟苷基聚合物纳米反应器(HPG@hemin-GOx)作为铁死亡-凋亡诱导剂。HPG@hemin-GOx展现了葡萄糖氧化酶(GOx)、过氧化物酶(POD)类似活性、催化酶(CAT)类似活性以及谷胱甘肽过氧化物酶(GPX)类似活性。该纳米反应器的GOx活性能够在氧气存在下通过氧化葡萄糖增加细胞内过氧化氢(H2O2)水平。随后,HPG@hemin-GOx的POD类似活性可以利用生成的H2O2诱导羟基自由基的产生。同时,CAT类似活性产生的氧气能够促进GOx的耗氧性葡萄糖氧化过程,从而促进细胞内活性氧(ROS)的产生。此外,HPG@hemin-GOx的GPX类似活性能够消耗细胞内谷胱甘肽,从而下调GPX4的表达。因此,HPG@hemin-GOx通过ROS介导的核DNA和线粒体损伤以及GPX4耗竭诱导的脂质过氧化积累,诱导凋亡和铁死亡,从而在体外和体内均展现出强大的抗癌效果。这项工作提供了一种构建具有多酶活性的聚合物纳米反应器的方法,用于铁死亡-凋亡协同抗癌治疗。
该研究题为“Three-Dimensional Semiconductor Network as Regulators of Energy Metabolism Drives Angiogenesis in Bone Regeneration”发表在《ACS Nano》。
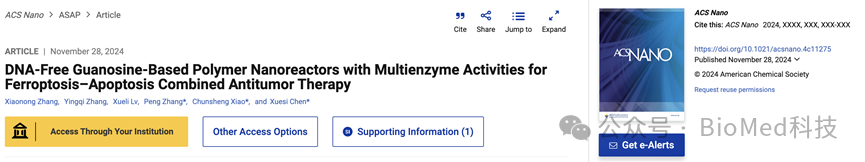
方案1展示了HPG@hemin-GOx纳米反应器的制备过程及其作为凋亡-铁死亡诱导剂在癌症治疗中的应用。该方案通过一步组装法将苯硼酸修饰的透明质酸(HA-PBA)、鸟苷(G)、血红素(hemin)和葡萄糖氧化酶(GOx)结合,形成具有多酶活性的纳米反应器。该纳米反应器能够通过级联反应提高细胞内活性氧(ROS)水平,损伤细胞核DNA和线粒体,触发肿瘤细胞凋亡;同时,通过消耗细胞内谷胱甘肽(GSH)下调谷胱甘肽过氧化物酶4(GPX4)的表达,增加脂质过氧化(LPO)积累,促进肿瘤细胞铁死亡,从而实现对肿瘤的协同治疗。
方案1. 3D钛白粉和铋氧化物半导体异质结网络(3D-NTBH)调控细胞能量代谢过程并诱导血管生成和骨整合
【HPG@hemin-GOx的制备与表征】
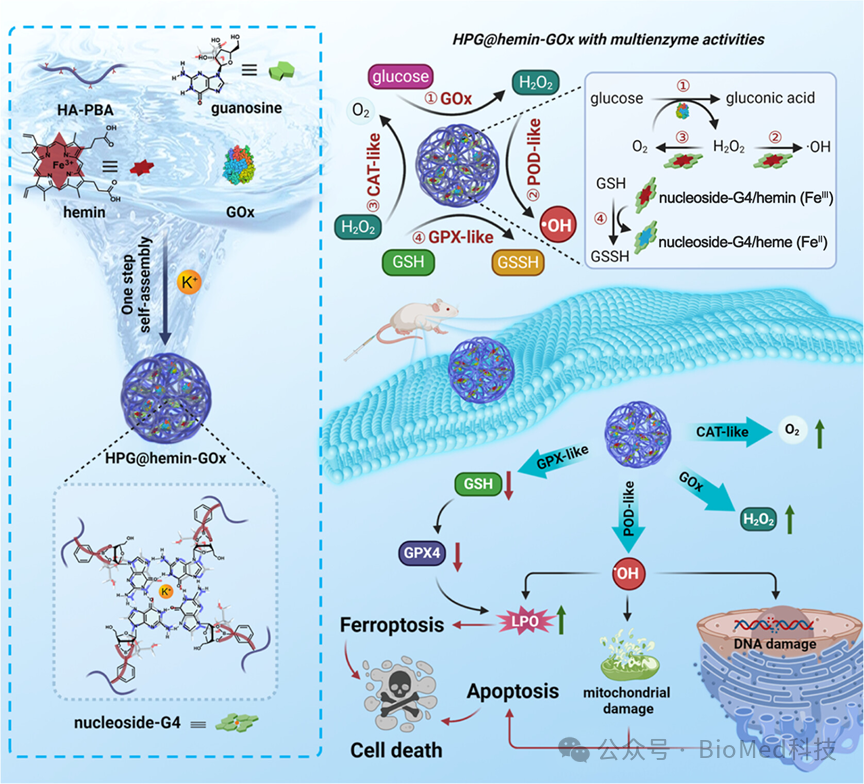
图1展示了DNA自由鸟苷基聚合物纳米反应器HPG@hemin-GOx的制备过程和特性表征,包括其合成方案、粒径分布、形态学特征以及傅里叶变换红外光谱(FTIR)、紫外-可见吸收光谱和荧光光谱等分析结果。这些结果证实了鸟苷与HA-PBA的成功结合、核苷-G4/血红素复合物的形成以及血红素和GOx在纳米反应器中的有效负载。结论表明,HPG@hemin-GOx具有预期的尺寸、形态和组成,显示出良好的生物稳定性和结构特征,为后续的多酶活性研究和抗肿瘤效果评估提供了基础。
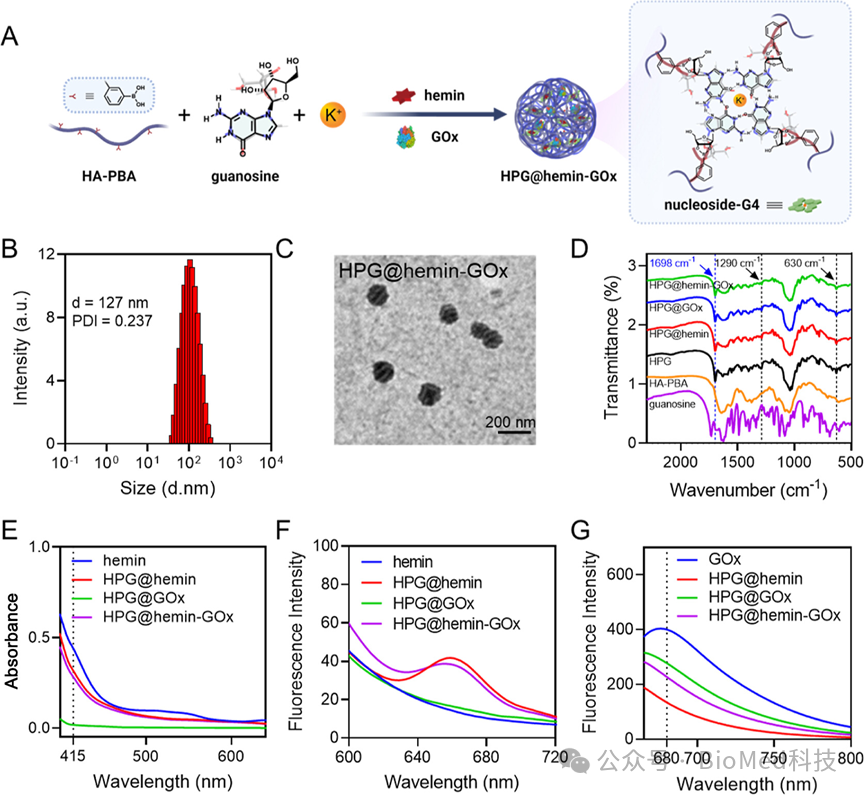
图1. HPG@hemin-GOx的制备与表征
【HPG@hemin-GOx的多酶活性评估】
图2详细展示了HPG@hemin-GOx纳米反应器的多酶活性,包括葡萄糖氧化酶(GOx)、过氧化物酶(POD)类似活性、催化酶(CAT)类似活性和谷胱甘肽过氧化物酶(GPX)类似活性。通过一系列实验,如Ti(SO4)2检测法、ABTS和TMB作为过氧化物酶底物的氧化实验、电子自旋共振(ESR)光谱法检测羟基自由基(·OH)的产生、溶解氧含量测定以及GSH耗竭实验,证实了HPG@hemin-GOx能够通过自供级联反应在肿瘤细胞内上调活性氧(ROS)水平和下调谷胱甘肽(GSH)水平,从而具备同时诱导细胞凋亡和铁死亡的潜力。结论表明,HPG@hemin-GOx的多酶活性使其成为一种有效的凋亡-铁死亡诱导剂,为癌症治疗提供了新的可能性。
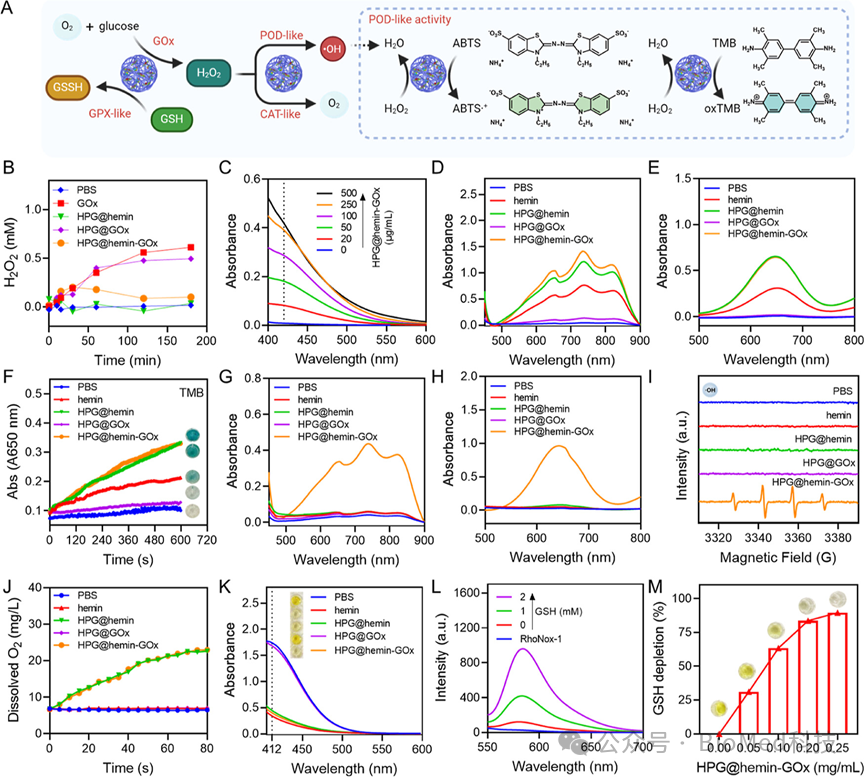
图2.HPG@hemin-GOx的多酶活性评估
【HPG@hemin-GOx的体外细胞毒性评估】
图3探讨了HPG@hemin-GOx纳米反应器在体外对4T1肿瘤细胞的细胞毒性。实验结果表明HPG@hemin-GOx能被肿瘤细胞有效摄取并从溶酶体中逃逸,通过其GPX样活性显著降低细胞内GSH水平,提高细胞内Fe2+含量,并通过CAT样活性改变细胞内氧气水平,最终通过产生大量ROS诱导肿瘤细胞凋亡。结论显示HPG@hemin-GOx具有较高的体外抗肿瘤效果,能够有效地杀死肿瘤细胞,为进一步的体内研究和临床应用提供了科学依据。
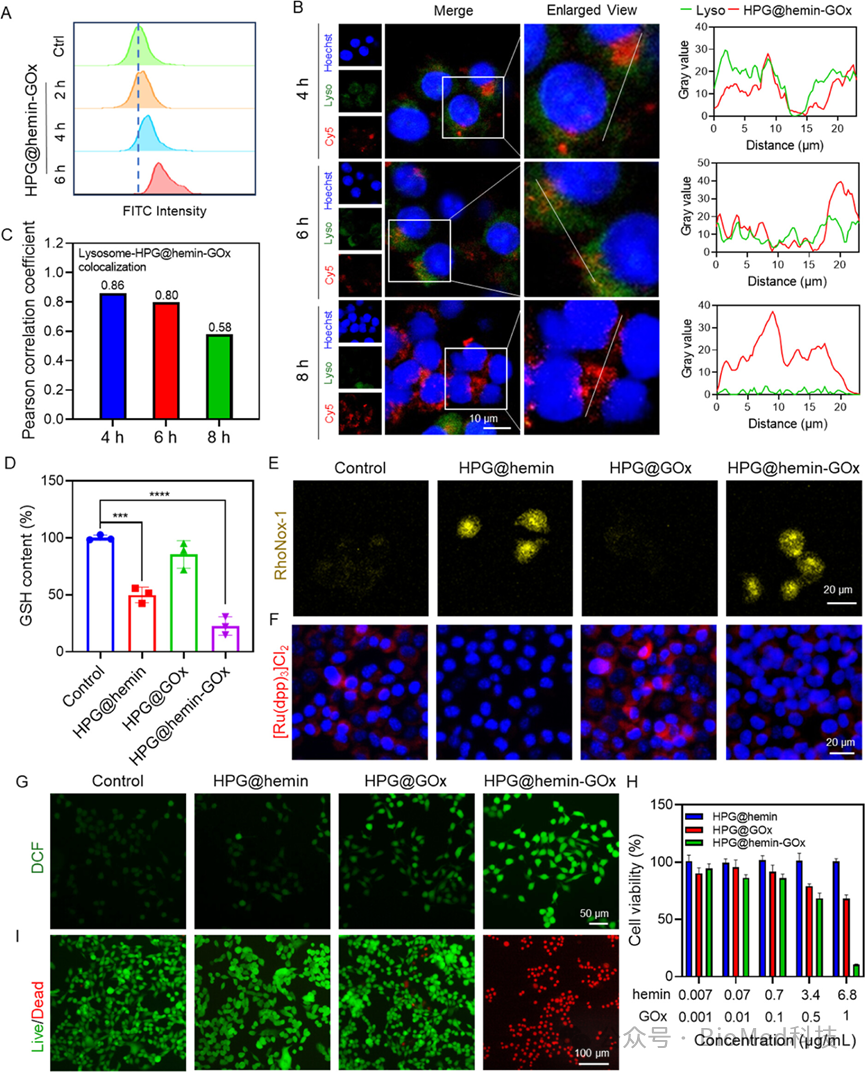
图3.HPG@hemin-GOx的体外细胞毒性评估
【HPG@hemin-GOx的细胞毒性机制】
图4阐述了HPG@hemin-GOx纳米反应器诱导肿瘤细胞凋亡和铁死亡的机制。通过检测细胞核DNA损伤(γ-H2AX表达)、线粒体膜电位(MMP,通过JC-1染色)、细胞凋亡率(通过Annexin V-FITC/PI双染色的流式细胞仪分析)、GPX4蛋白表达(Western blot分析)以及脂质过氧化(LPO,通过C11-BODIPY 581/591染色和MDA水平测定)的实验结果,揭示了HPG@hemin-GOx通过产生过量的活性氧(ROS)引起DNA损伤和线粒体损伤,进而诱导细胞凋亡;同时,通过降低GSH水平和GPX4表达,增加LPO积累,促进铁死亡。结论表明HPG@hemin-GOx能够有效触发4T1肿瘤细胞的凋亡和铁死亡,展现了其作为抗癌治疗剂的潜力。
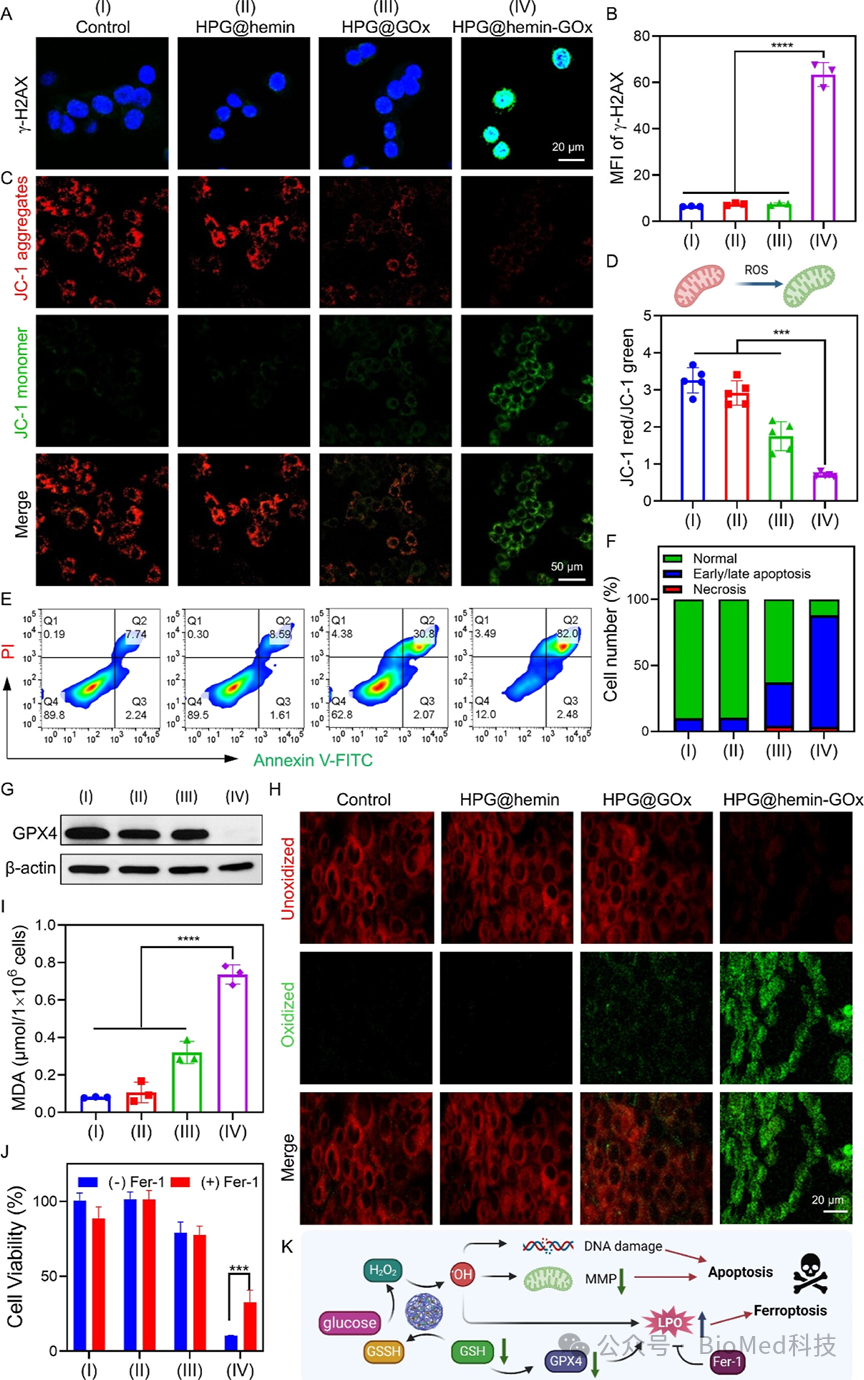
图4. HPG@hemin-GOx的细胞毒性机制
【HPG@hemin-GOx的体内抗肿瘤效果评估】
图5展示了HPG@hemin-GOx纳米反应器在体内抗肿瘤效果的评估。实验通过荧光成像观察到HPG@hemin-GOx在肿瘤组织中的高积累,通过监测肿瘤生长发现HPG@hemin-GOx处理组的肿瘤抑制效果最为显著,并通过组织学染色证实了其诱导肿瘤细胞凋亡和抑制肿瘤增殖的能力,以及下调GPX4和增加LPO的效果。结论表明HPG@hemin-GOx在体内能有效抑制肿瘤生长,通过诱导肿瘤细胞凋亡和铁死亡展现了显著的抗癌效果,并且具有良好的生物相容性。
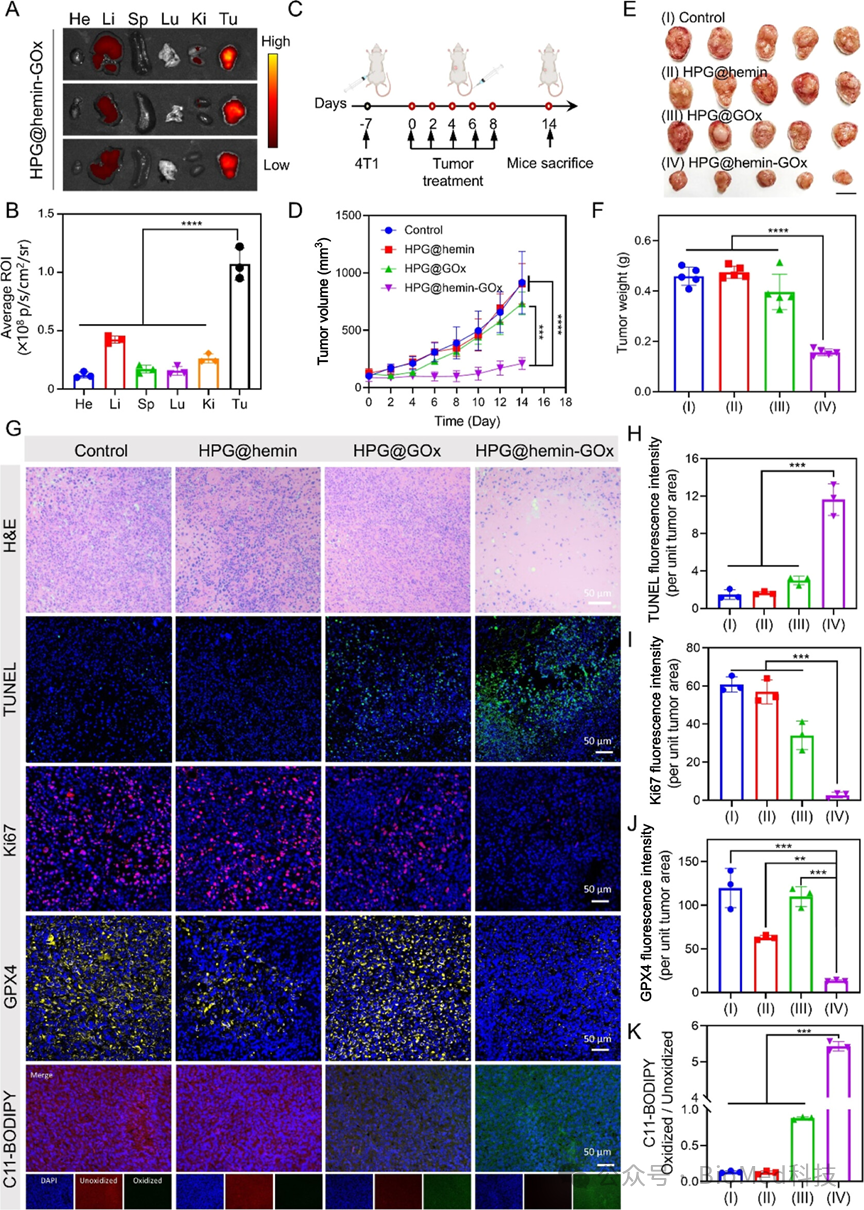
图5. HPG@hemin-GOx的体内抗肿瘤效果评估
【小结】
该研究通过一步组装透明质酸-苯硼酸(HA-PBA)、鸟苷(G)、血红素(hemin)和葡萄糖氧化酶(GOx)构建的无DNA鸟苷基聚合物纳米反应器HPG@hemin-GOx,展现了多酶活性,显著增加了细胞内活性氧(ROS)水平,导致肿瘤细胞核DNA和线粒体损伤,进而诱导肿瘤细胞凋亡;同时,HPG@hemin-GOx的类谷胱甘肽过氧化物酶(GPX)活性消耗了细胞内谷胱甘肽(GSH),下调了GPX4表达,增强了细胞内脂质过氧化(LPO)积累,促进了肿瘤细胞铁死亡,最终在体外和体内均显示出高效的抗癌效果,为铁死亡-凋亡诱导剂的制备提供了一种有效方法,有望推进肿瘤催化疗法的发展。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c11275#
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#癌症治疗# #铁死亡# #纳米反应器#
0