Circulation 复旦大学葛均波/戴宇翔/林金钟/龚惠教授团队证实经修饰的mRNA在临床前模型中有效治疗遗传性心肌病
2025-04-14 论道心血管 论道心血管
本研究首次在基因与蛋白质层面上实现了心脏结构与功能的恢复,通过对DSC2功能缺失的恢复,为以右心室扩张的心力衰竭治疗提供了一种切实可行、具备转化前景的新路径,填补了这一关键疾病治疗的空白。
2025年4月11日,复旦大学附属中山医院葛均波院士、戴宇翔主任医师、林金钟教授和龚惠教授合作在Circulation杂志上在线发表题为“Modified mRNA Treatment Restores Cardiac Function in Desmocollin-2–Deficient Mouse Models of Arrhythmogenic Right Ventricular Cardiomyopathy”的研究论文。此次突破聚焦于DSC2,一种锚定于细胞膜的桥粒蛋白,长期以来被认为是致心律失常性右心室心肌病(ARVC)发病的核心因素。尽管其致病性已获公认,但DSC2突变所致心肌病一直缺乏有效治疗方案。研究团队提出了一种高度靶向、非病毒、可重复给药的治疗策略。首次证实单次注射经修饰的mRNA即可在体内逆转心肌病、恢复右心室功能,并显著延长生存期。本研究首次在基因与蛋白质层面上实现了心脏结构与功能的恢复,通过对DSC2功能缺失的恢复,为以右心室扩张的心力衰竭治疗提供了一种切实可行、具备转化前景的新路径,填补了这一关键疾病治疗的空白。

精准基因编辑构建心肌病模型
研究团队通过临床诊断发现了一个近亲婚配导致ARVC的六代家系,并开展了系统性遗传分析。基于NCBI数据库已收录的1700余例临床基因突变记录,研究者发现了一处前所未见的纯合子移码突变:p.A138fsX26,该突变导致DSC2蛋白完全缺失,进而引发右心室收缩功能障碍、心室扩张及脂肪纤维化替代,临床呈现出ARVC的表征。
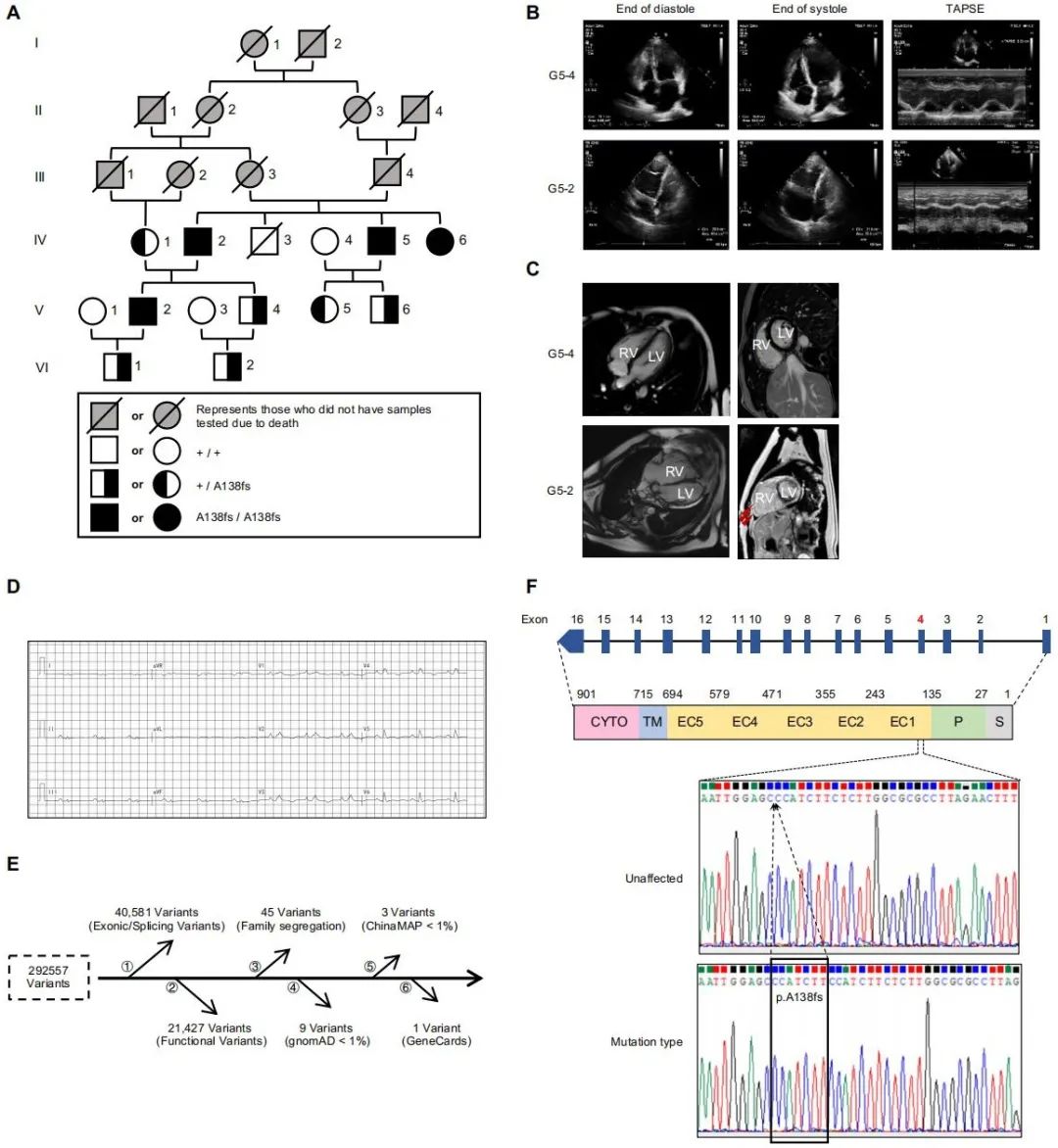
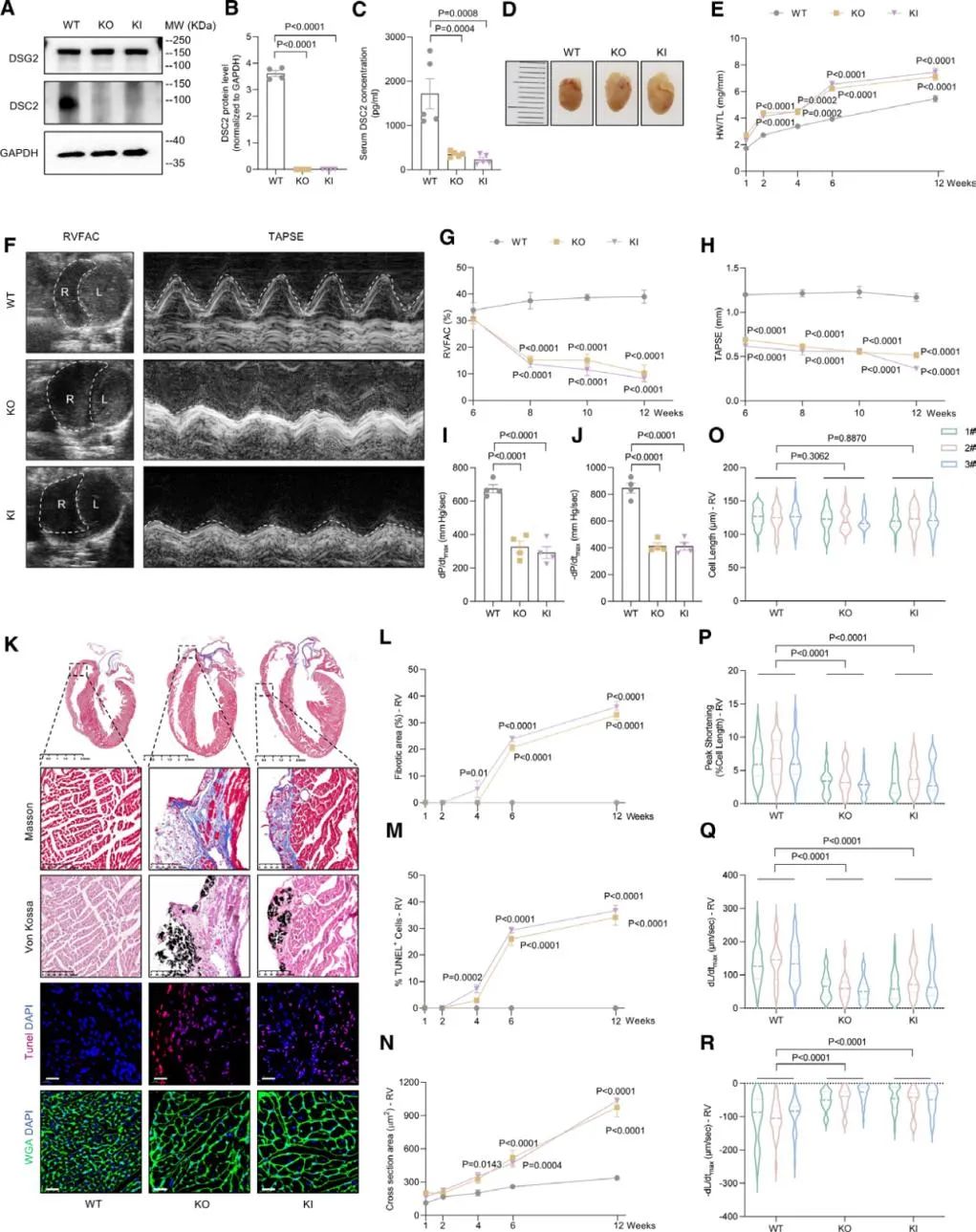
为深入研究其致病机制并探索干预策略,团队应用CRISPR-Cas9基因编辑技术,建立了携带该突变的敲入小鼠模型及Dsc2全基因敲除小鼠模型。两种模型均精准再现了人类ARVC的特征表现,包括心脏变大、右心室腔扩大、TAPSE下降、心室肌纤维化增加及早发性死亡等。上述两种自发型右心室心肌病小鼠模型确立了目前最为稳定、可控的桥粒基因缺陷型心肌病小动物平台。
此外,研究者还开发了适用于小动物右心功能监测的微型压力导丝系统,实现了右心室血流动力学的实时监测,为右心室收缩与舒张功能评估建立了高精度、标准化的研究工具,填补了右心室功能研究长期存在的技术空白。
从机制到治疗:揭示了DSC2–MLC2a的功能轴
既往研究认为,心室肌中主要富集的是Myl2 (MLC2v),而Myl7 (MLC2a)主要富集在心房肌中。研究人员通过转录组测序分析KO小鼠的右心室肌,首次发现DSC2的缺失可显著下调Myl7的表达,并证明了Myl7 (MLC2a)是维持右心室肌收缩功能的关键,通过引发心肌细胞收缩功能受损,最终导致右心扩大。
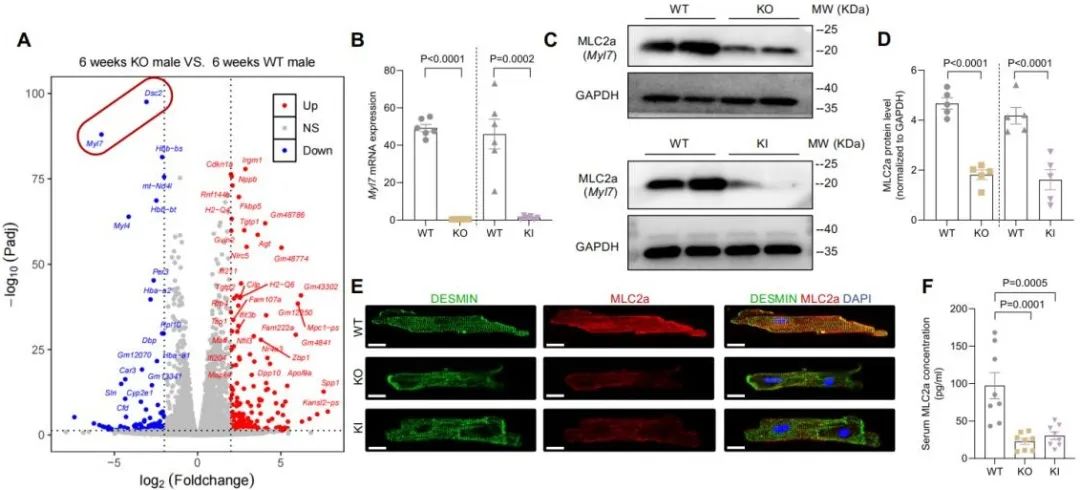
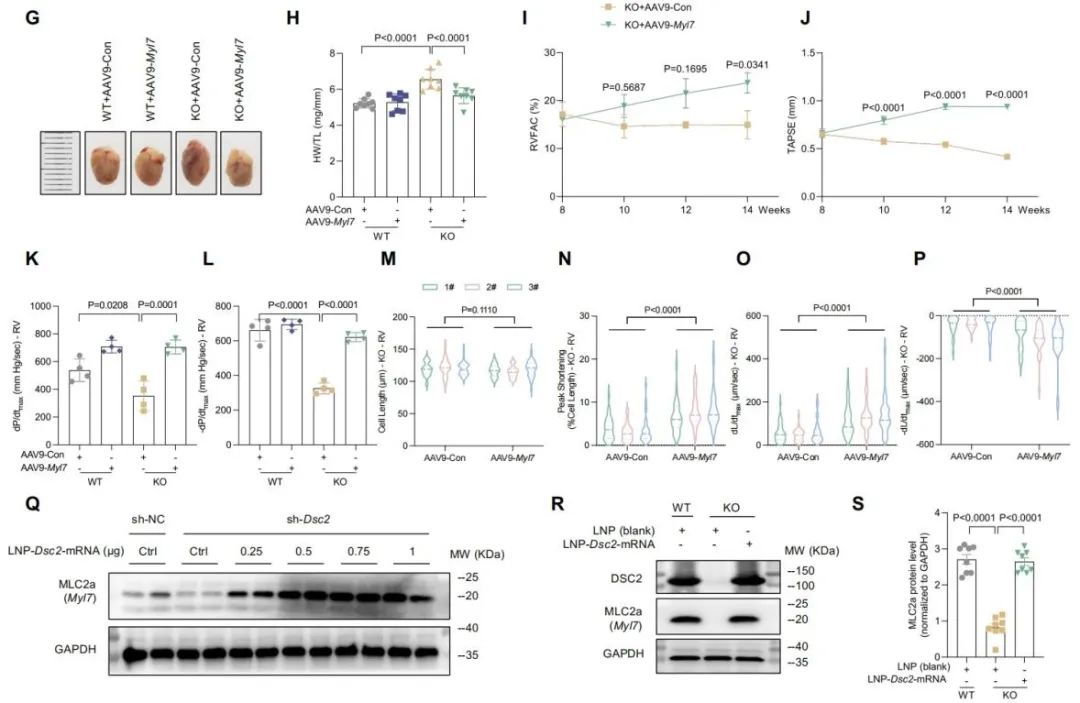
为了验证MLC2a在DSC2缺失心肌病中的关键作用,研究者通过AAV9-Myl7递送治疗,成功恢复了右心室收缩能力,明确了MLC2a作为治疗靶点的临床潜力。通过Dsc2-modified mRNA治疗,明确了MLC2a的有效恢复。首次建立起“DSC2 → MLC2a → 右心功能”这一功能调控通路,为干预右心功能障碍提供了新的分子靶标。
单次注射实现右心功能重建
研究团队的核心成果在于开发出一种经优化设计的修饰型Dsc2-mRNA,分别采用naked mRNA形式与脂质纳米颗粒(LNP)包裹mRNA形式将药物递送至心脏。通过心超引导下室间隔点注射mRNA药物精准治疗,单次10μg剂量即可快速诱导DSC2蛋白表达恢复。治疗后数周内,心超显示RVFAC与TAPSE恢复至正常水平;组织学检查显示右心室肌纤维化明显减少,右心室壁变薄得到有效抑制;KO小鼠的生存率显著提升。
令人瞩目的是,这些疗效不仅可以在疾病发生早期小鼠中得到有效治疗,在疾病发展中晚期老年小鼠中也有明显的治疗效果。研究还在疾病发展中晚期小鼠中实施重复给药,依然能够再度激活疗效并延长生存期,展示了mRNA平台长期可控的特性。相比AAV等传统基因治疗方式,该疗法既能快速翻译表达蛋白并且规避了病毒载体带来的免疫原性、基因整合等风险。研究表明,DSC2作为膜锚定结构蛋白,具有显著的体内稳定性,使其成为mRNA治疗中理想的高持续表达效能靶点。
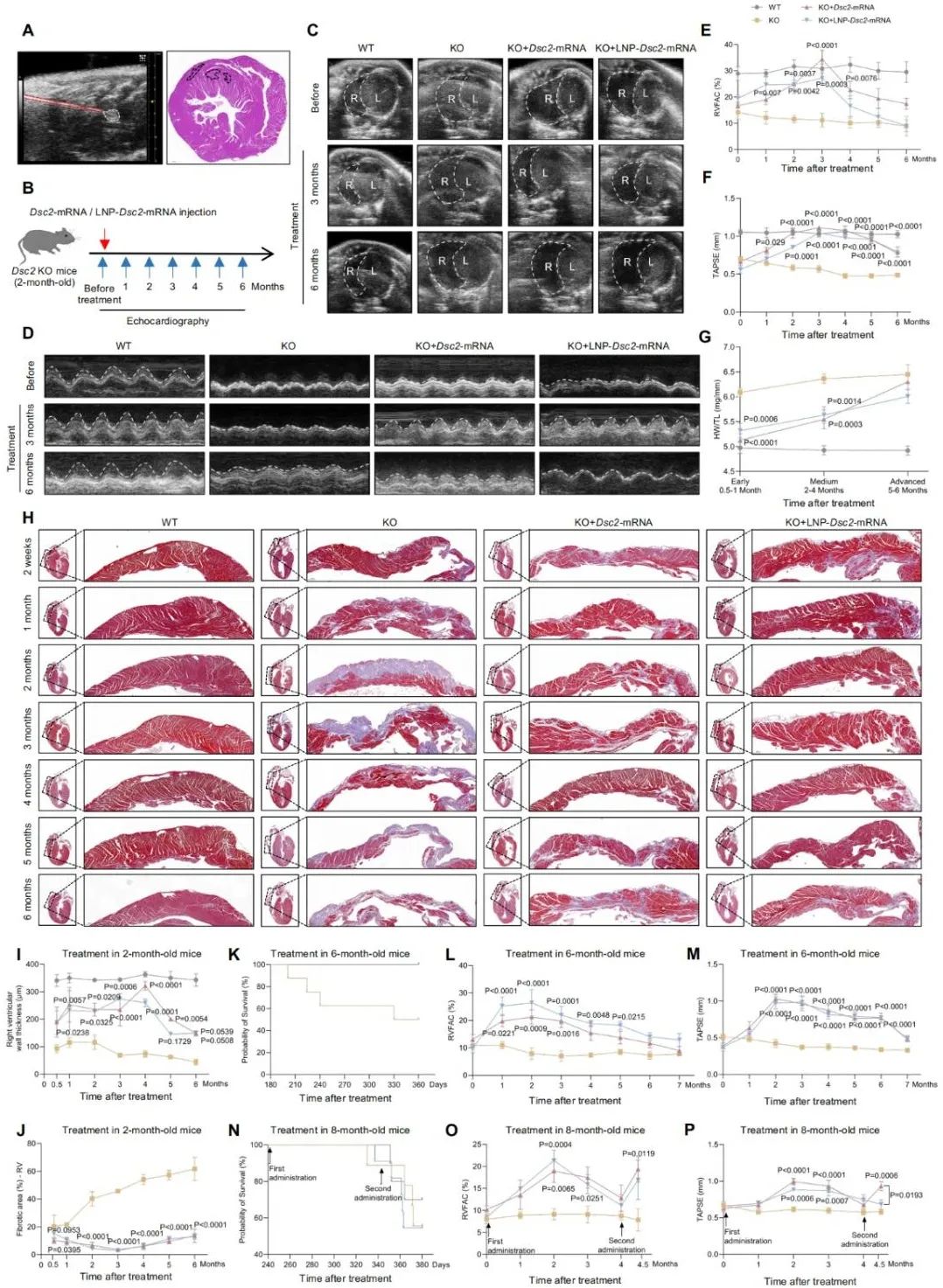
高度可转化的给药策略与精准功能评估
为评估临床可行性,团队首创经冠状动脉导管注射给药场景模拟的小动物模型,通过主动脉暂时夹闭实现mRNA的经血管定向递送。结果显示该方法的心肌摄取效率与心超引导下心肌点注射相当,右心功能亦获得全面恢复,此模型给药的验证为未来人类经导管mRNA给药的应用提供了现实路径。
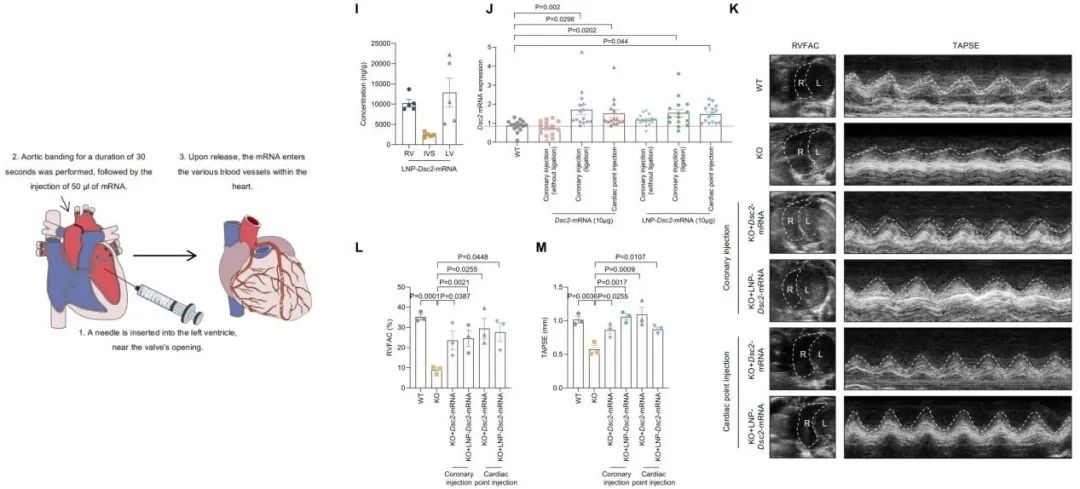
为了进一步拓展适应人群,团队将非缺血性扩张型心肌病患者疾病进行细分和筛选,在来自双心室扩张型心肌病患者的心肌和血清样本中发现DSC2及MLC2a水平下调,证实了该治疗策略对广泛心肌病患者的适用潜力,并揭示了遗传性与获得性右心功能障碍之间在分子层面存在共通的致病基础。
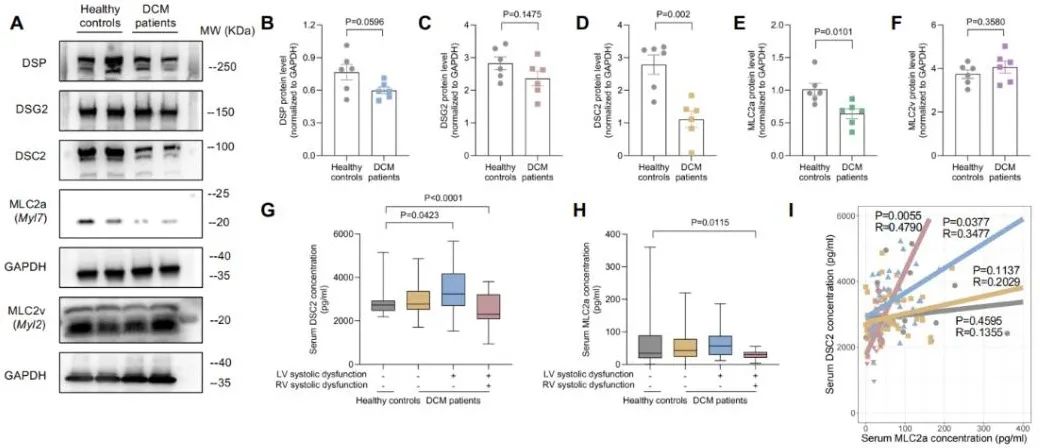
与此同时,团队在横向主动脉缩窄(TAC)所致的获得性右心衰竭模型中做了相应的疾病群体细分并验证了使用Dsc2-mRNA治疗的效果,结果再次显示RVFAC、TAPSE等均获得明显改善。
面向未来的心肌修复治疗平台
本研究的意义不仅在于首创modified mRNA治疗右心室心肌病的疗法,更在于构建了一个涵盖模型构建、机制验证、药物开发、靶点评估及给药路径在内的完整治疗体系。从基因编辑构建的ARVC动物模型、到新靶点Myl7的验证应用、再到mRNA制剂的设计与递送优化,乃至心功能评估技术的系统升级,所有核心工具均由研究团队自主开发,构成一套具有广泛适应性和深远转化价值的系统性解决方案。
研究所展现的不仅是对ARVC的疾病治疗,更是一种以蛋白恢复为核心、以机制导向为原则的创新干预方式。mRNA药物不再局限于疫苗或酶替代领域,而是在心脏病学中作为精准、可控、重复使用的治疗平台展现出广阔前景,其疗效可由DSC2与MLC2a等标志物动态评估,实现精准治疗与个体化调控。
尽管目前所有数据仍处于临床前阶段,但其所奠定的理论基础与技术路径已足以为未来的转化研究与临床试验提供清晰指引。这是机制层面上的探索,是蛋白水平上的功能重建,更是RNA医学在心脏疾病领域的一次重要飞跃。这项成果不仅推动了心脏基因治疗从概念走向现实,也展示了一种可扩展、可重复、机制明确的心脏修复愿景,为心肌病治疗树立了新的里程碑。
戴宇翔教授、林金钟教授、龚惠教授为共同通讯作者,邹妍博士、卢静博士、连智鹏硕士、贾剑国学士、沈娟硕士为共同第一作者。研究得到了国家自然科学基金、国家重点研发计划、上海市优秀学术带头人计划、上海市科委细胞与基因治疗专项、上海市临床重点专科建设项目和复旦大学附属中山医院科技创新基金的资助。
原文链接:
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.124.072340

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#右心室心肌病# #DSC2#
16