Chem Eng J 苏州大学沈振亚/陈维倩团队成功开发免疫抑制纳米囊泡:基于免疫检查点PD-L1的纳米颗粒促进心梗后心功能恢复
2025-04-15 论道心血管 论道心血管
该研究旨在深入探索免疫检查点在缺血性心脏病治疗中的潜力,为缺血性心脏病患者开辟新的治疗途径。
心肌梗死(Myocardial Infarction, MI)是常见的急性冠状动脉综合征,具有极高发病率和死亡率,给患者和社会带来了极大负担。心肌梗死后,CD8细胞毒性T淋巴细胞(Cytotoxic T-lymphocytes, CTLs)的活化和增殖加剧心肌炎症,导致心肌细胞死亡、心室重构和心脏功能恶化。T淋巴细胞通过免疫检查点(如PD-1/PD-L1)相互作用来维持自身耐受和避免自身免疫,这为开发基于T细胞活性的治疗策略提供了理论依据。
苏州大学心血管病研究所/苏州大学第一附属医院的沈振亚教授、陈维倩副教授在Chemical Engineering Journal (中科院1区)发表了题为“Room-temperature-stable immunosuppressive nanovesicles for mitigating immunopathology and streamlining cardioprotection post-infarction”的研究论文。该研究成功开发了一种免疫抑制纳米囊泡PD-L1@NV,揭示了PD-L1@NV通过PD-1/PD-L1通路阻断CD8 T细胞增殖发挥缺血心肌保护作用。该研究旨在深入探索免疫检查点在缺血性心脏病治疗中的潜力,为缺血性心脏病患者开辟新的治疗途径。

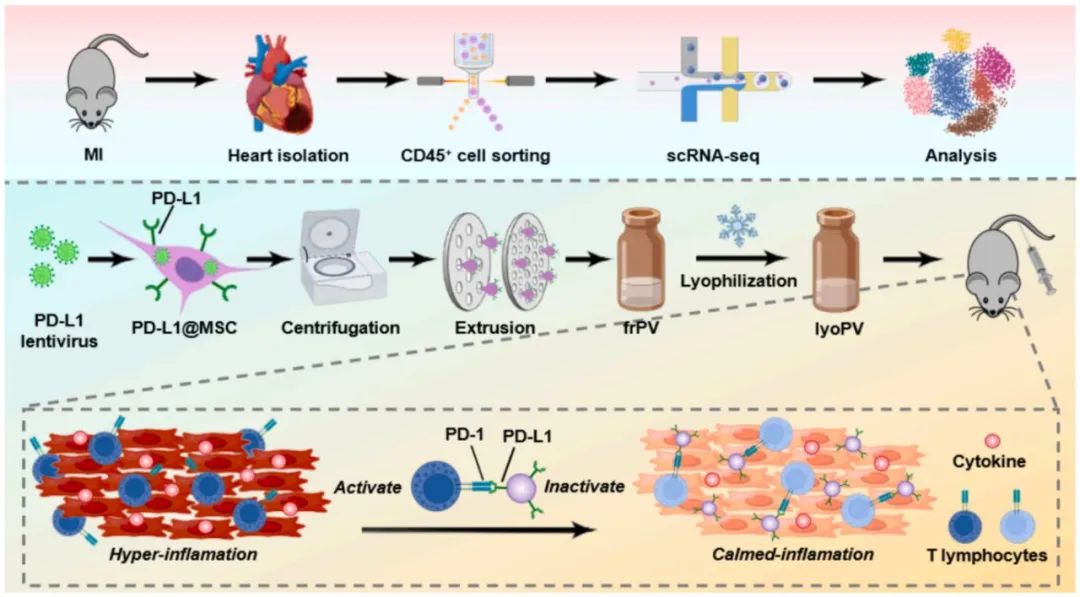
首先,研究团队借助单细胞数据库(GSE163465),针对梗死小鼠心脏的CD45+免疫细胞展开深度分析,揭示损伤后免疫微环境呈现动态演变。研究发现,T细胞在此过程中展现出显著异质性,团队进一步鉴定出六个功能各异的T细胞亚群。其中,CD8细胞毒性T细胞于损伤3天后出现持续增殖,转录组特征显示其细胞周期调控、增殖信号激活、炎症介质分泌及趋化相关基因显著改变,提示MI后CD8 T淋巴细胞增殖和激活增强,极有可能引发过度炎症反应。
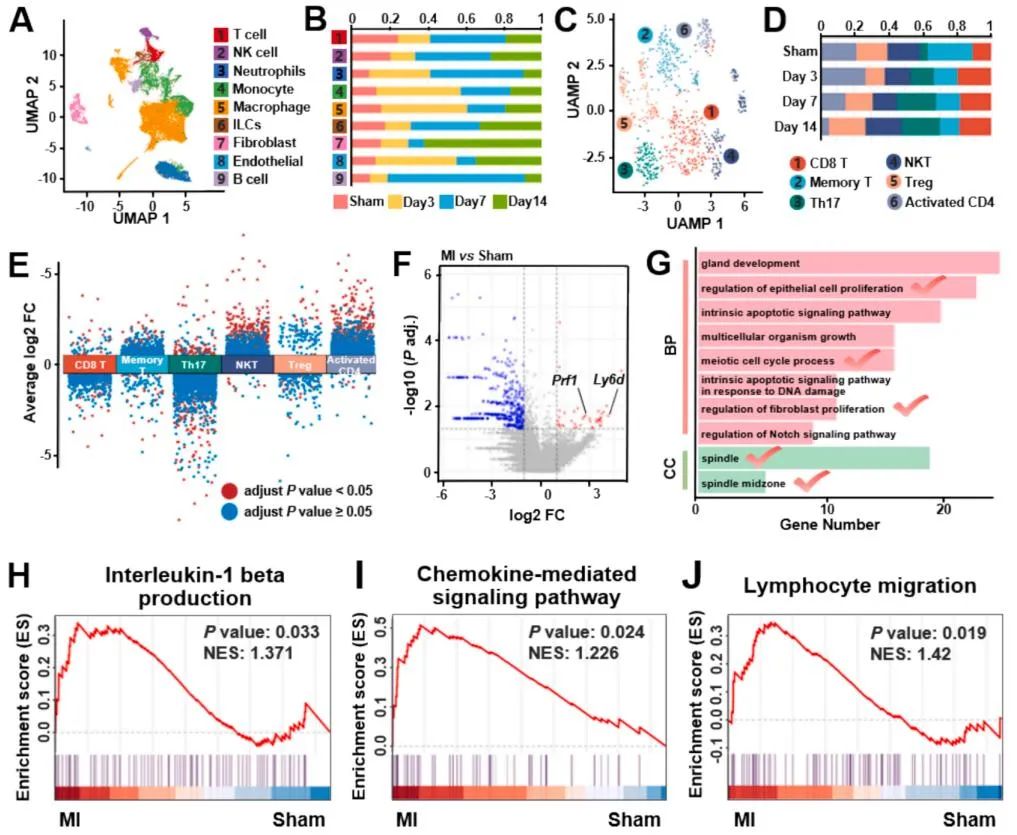
随后,该研究通过慢病毒构建稳定表达PD-L1-FLAG融合蛋白的PD-L1@MSC细胞系,结合超声破碎-连续挤压法及冻干工艺,成功获得具有良好室温稳定性的冻干纳米囊泡制剂(lyoPV)。表征分析证实,lyoPV在室温稳定,粒径分布、表面电荷及特征性膜蛋白表达与新鲜态(frPV)相似。
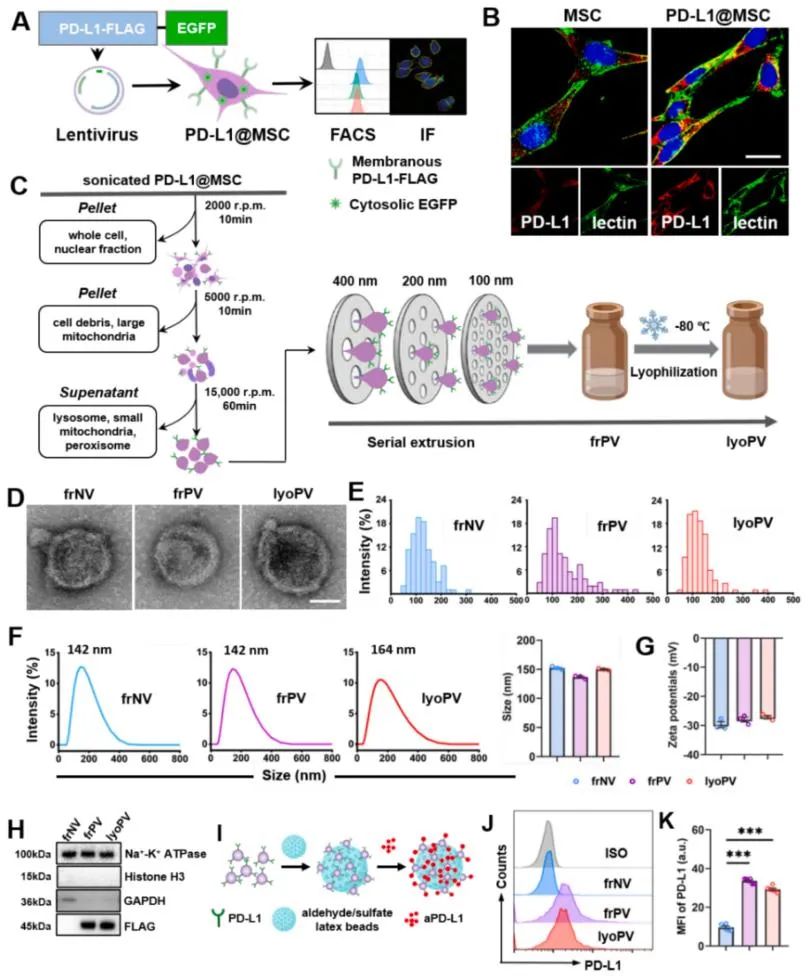
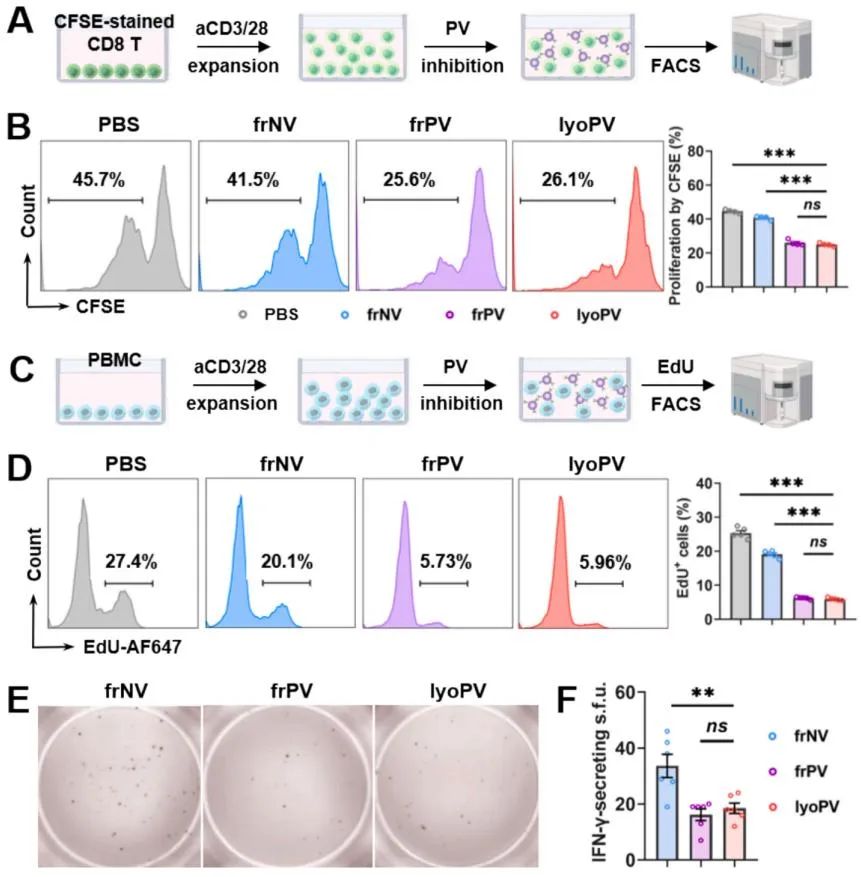
为系统评估lyoPV的免疫调节效应,该研究通过CFSE稀释法检测发现,frPV与lyoPV均可显著抑制小鼠CD8 T淋巴细胞增殖。该免疫抑制效应在人外周血单核细胞(PBMC)中通过EdU增殖实验得到跨物种验证。在功能激活方面,ELISPOT检测显示,两种制剂处理均能显著降低IFN-γ分泌斑点数,证实其对CD8 T淋巴细胞效应功能的抑制作用。上述结果表明,lyoPV在维持冻干制剂特性的同时,完整保留了新鲜态(frPV)的免疫调控功能,可有效抑制CD8 T淋巴细胞的增殖活化。
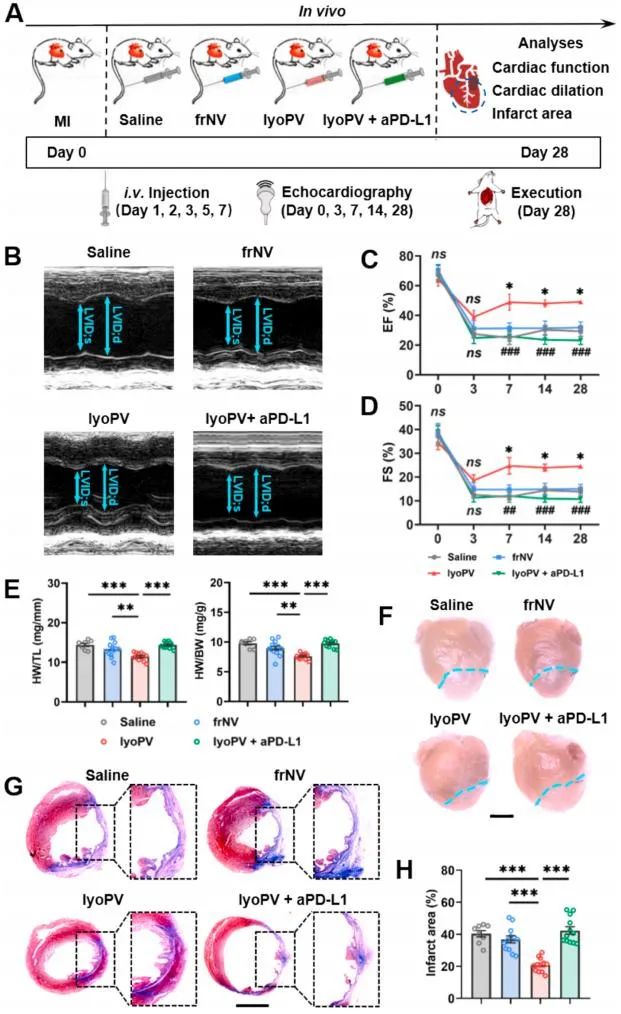
最后,该研究通过建立心肌梗死动物模型,系统解析了lyoPV的心脏保护作用。实验结果表明,lyoPV治疗显著改善心脏收缩功能(EF、FS值),同时有效减小心梗面积并抑制心室重构进程。值得注意的是,联合应用PD-L1中和抗体(aPD-L1)可拮抗上述治疗效果,验证了PD-1/PD-L1信号通路在其治疗机制中的核心作用。
综上,该研究开发了一种具有免疫调控功能的纳米囊泡制剂,其通过特异性阻断PD-1/PD-L1免疫检查点通路,有效抑制CD8 T淋巴细胞的活化与克隆扩增,从而减轻心肌缺血后的免疫病理损伤,促进心肌组织修复。
该论文的第一作者是苏州大学心血管病研究所硕士研究生汤青松、李梦婷和王胜楠;苏州大学心血管病研究所/苏州大学第一附属医院沈振亚教授、陈维倩副教授和山东大学齐鲁医院张文程教授为该论文共同通讯作者;苏州大学为第一作者单位。
原文链接:
https://doi.org/10.1016/j.cej.2024.157030

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#缺血性心脏病# #PD-L1#
14