Science:心脏发育暗藏的"生物光缆"如何颠覆医学认知?
昨天 生物探索 生物探索 发表于陕西省
研究发现胚胎心脏中,心肌细胞能伸出纳米级 TNTLs 穿透心胶质与心内膜细胞相连,调控心脏小梁形成,该发现或改写发育生物学认知,为再生医学带来曙光。
引言
胚胎在形成最初的心跳时,那些精密如瑞士钟表的心脏结构究竟是如何构建?传统理论认为,心肌层与心内膜层这两大心脏组织被300微米厚的"心胶质"永久隔绝,只能依靠飘散在基质中的信号分子隔空对话。但3月14日《Science》杂志的一项突破性研究“Tunneling nanotube–like structures regulate distant cellular interactions during heart formation”,揭开了生命真正的魔术——心肌细胞竟能伸出纳米级的"生物光缆",穿透看似不可逾越的屏障,与心内膜细胞建立物理连接!
研究团队通过基因编辑小鼠模型与冷冻电镜技术,首次捕捉到胚胎心脏中神秘莫测的隧道纳米管样结构(Tunneling Nanotube-Like Microstructures,TNTLs)。这些直径不足500纳米、相当于艾滋病毒大小的管状突起,承载着Notch、VEGF等关键信号分子,以每秒0.5微米的速度在细胞间精准投递生命指令。更惊人的是,当研究人员敲除调控细胞骨架的CDC42基因,这些"纳米光缆"便会集体断裂,导致胚胎心脏丧失标志性的小梁结构,宛如被抹平指纹的光滑镜面——这正是30%先天性心脏病患者的病理特征!
这项发现不仅解开了困扰发育生物学界50年的"心脏形态发生之谜",更揭示了细胞通讯的量子跃迁:在纳米尺度上,生命竟演化出堪比光纤网络的信号高速公路。想象未来医生通过修复这些微观管道治疗先天心脏病,或利用仿生纳米管实现心肌再生,此刻实验室里的小鼠心脏成像,或许正孕育着改写人类命运的技术革命。这束穿透心胶质的纳米之光,是否将照亮再生医学的新纪元?
生命最初的乐章:心脏如何编织精密网络?
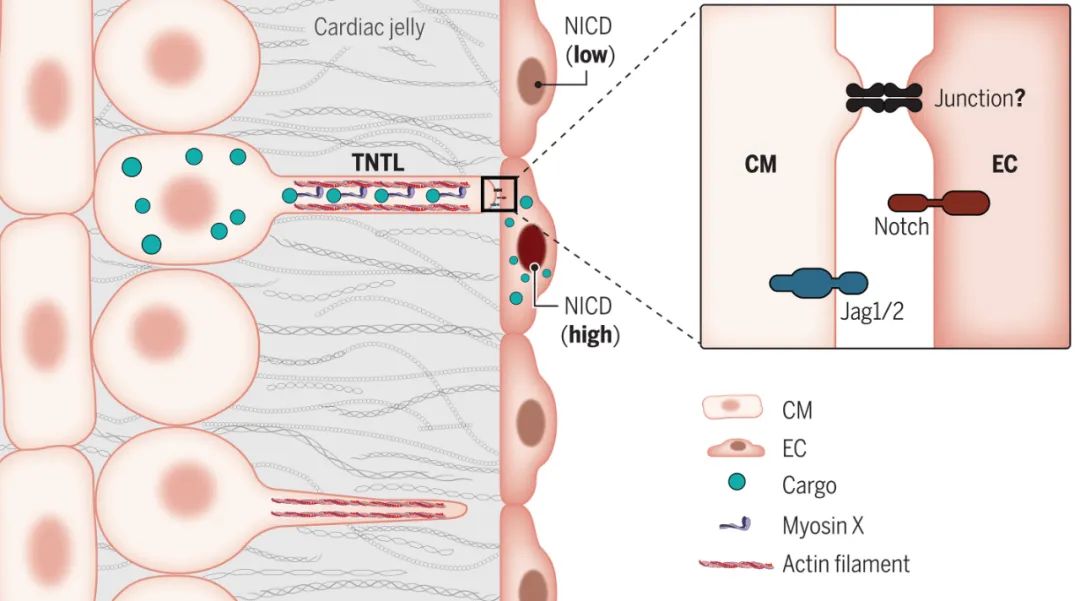
在胚胎发育的早期,心脏如同一首精妙的交响乐,每个细胞都精准地执行着命运指令。传统理论认为,心肌层(myocardium)与心内膜(endocardium)这两层心脏组织被一层名为"心胶质(cardiac jelly)"的无细胞基质物理隔开,只能通过分泌信号分子进行远距离交流。然而,《Science》发表的最新研究,彻底颠覆了这一认知——研究人员首次捕捉到连接心脏两层组织的纳米级"生物光缆",并将其命名为隧道纳米管样结构(Tunneling Nanotube-Like Microstructures, TNTLs)。
这项研究揭示了胚胎心脏中一个令人惊叹的微观世界:心肌细胞(cardiomyocytes, CMs)伸出比头发丝细千倍的管状结构,穿越心胶质的汪洋,直接与心内膜细胞(endocardial cells, ECs)建立物理连接。这些直径仅300-500纳米、长度可达10微米的"生命光缆",不仅承载着信号分子的运输,更直接决定了心脏小梁(trabeculae)的形成——那些像山脉般起伏的心室壁结构,正是人类心脏高效泵血的核心设计。
显微世界的震撼:3D成像捕捉"细胞触手"
研究团队运用遗传标记技术(genetic labeling)与成像手段,将小鼠胚胎心脏的发育过程转化为一场视觉盛宴。通过NKX2.5基因启动子驱动的荧光标记系统,研究人员在胚胎第8天(E8.0)就捕捉到心肌细胞伸出的管状突起。这些结构如同深海章鱼的触手,穿透富含透明质酸的心胶质,精准锚定在心内膜细胞表面。
更令人惊叹的是冷冻电子断层扫描(cryo-ET)呈现的纳米级细节:在三维重构图像中,TNTLs内部充满肌动蛋白(actin)纤维束,并携带运输囊泡。这种结构既不同于培养细胞中的隧道纳米管(TNTs),也不同于果蝇的细胞丝(cytonemes),而是展现出独特的生物学特征——它们不依赖基质支撑,却能跨越相当于细胞自身数倍的距离建立连接。
模式图(Credit: Science)
信号传递的量子跃迁:Notch通路如何被激活?
传统理论认为,Notch信号通路的激活需要细胞间直接接触。但研究数据给出了更精妙的答案:当心肌细胞通过TNTLs触碰心内膜细胞时,Notch配体(如Jag1/Jag2)像特快专递般沿管腔运输,触发心内膜细胞内的Notch1受体切割,释放出激活基因表达的N1ICD片段。实验显示,抑制TNTL形成会使Notch信号强度降低40%,而人工过表达肌动蛋白相关蛋白MyoX,则能让信号传递效率提升近3倍。
这种纳米级精准投递,解释了为何胚胎心脏能在极短时间内完成形态构建。当研究人员用药物CK-666阻断肌动蛋白聚合,胚胎心脏不仅失去小梁结构,连心室壁也变得光滑如镜——这正是多种先天性心脏病的典型特征。
基因剪刀下的心脏密码:Cdc42如何主宰形态发生?
为了验证TNTLs的功能,团队构建了心肌特异性敲除Cdc42基因的小鼠模型(MCKO)。这个编码细胞骨架调控蛋白的基因,被证明是TNTLs形成的"总工程师"。在胚胎第8.75天,正常心脏每100个心肌细胞能伸出19条TNTLs,而MCKO小鼠仅剩6条。更惊人的是,这些残缺的管状结构直径膨胀至600纳米,运输效率大幅下降。
基因层面的改变直接反映在宏观形态:MCKO小鼠胚胎的心脏小梁完全消失,心室壁薄如蝉翼。这一发现不仅印证了TNTLs的发育必需性,更揭示了约15%人类先天性心脏病可能与此通路相关——那些临床常见的"心室肌致密化不全"病例,或许正源于这些纳米管道的发育缺陷。
分子世界的快递网络:生命如何实现精准投递?
通过荧光漂白恢复技术(FRAP),研究人员首次捕捉到信号分子在TNTLs内的定向运输。当Jag1-eGFP标记的配体从心肌细胞端注入,荧光信号以每秒0.5微米的速度单向流动,整个过程如同微观世界的高速公路。更令人称奇的是,26kDa的LifeAct蛋白能通过TNTLs进入心内膜细胞,而268kDa的MyoX蛋白却始终驻留管道内部——这种分子量选择性运输,揭示了纳米管道存在精细的"海关系统"。
研究还发现,除了Notch信号,VEGF、NRG1、Angiopoietin等关键通路都依赖TNTLs进行信号放大。当这些"分子快递"同时受阻,心脏发育将陷入全面停滞——这解释了为何单一基因突变常引发多重心脏畸形。
改写教科书的启示:从胚胎学到再生医学
这项发现颠覆了发育生物学的三个传统认知:
远距离信号传递:细胞间无需直接接触,通过纳米管道即可实现膜受体-配体交互;
形态发生机制:心脏小梁并非单纯力学塑造,而是TNTLs引导的定向生长;
进化保守性:哺乳动物发展出不同于低等生物的独特细胞通讯策略。
更激动人心的是临床转化前景:通过调控TNTLs的形成,未来或能修复先天性心脏缺损,甚至增强心梗后的组织再生。研究团队已着手开发靶向CDC42的小分子激活剂,计划在大型动物模型中进行验证。
未解之谜与未来征途:生命科学的全新边疆
尽管取得突破性进展,TNTLs仍充满未解之谜:
这些纳米管道如何精准识别目标细胞?是否存在"分子邮政编码"系统?
囊泡运输的驱动力来自何种分子马达?
成年心脏是否保留TNTLs?它们在心脏修复中扮演何种角色?
生命系统的精妙远超想象。那些曾经被视作"细胞间质"的空白区域,实则充满动态的纳米级对话。研究人员掀开了细胞通讯世界的冰山一角。这些纳米级生命基建,或许将引领下一代生物技术的发展。
从心脏发育到癌症转移,从神经退行性疾病到免疫调控,TNTLs的发现为我们理解生命本质打开了全新维度。当我们凝视胚胎心脏跳动的荧光图像,看到的不仅是生命的起点,更是未来医学的璀璨星空。
参考文献
Miao L, Lu Y, Nusrat A, Fan G, Zhang S, Zhao L, Wu CL, Guo H, Huyen TLN, Zheng Y, Fan ZC, Shou W, Schwartz RJ, Liu Y, Kumar A, Sui H, Serysheva II, Burns AR, Wan LQ, Zhou B, Evans SM, Wu M. Tunneling nanotube-like structures regulate distant cellular interactions during heart formation. Science. 2025 Mar 14;387(6739):eadd3417. doi: 10.1126/science.add3417. Epub 2025 Mar 14. PMID: 40080583.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#胚胎心脏# #隧道纳米管样结构#
0