Cell Metab 空军军医大学付锋/高超/裴建明教授团队合作揭示代谢记忆引起心肌损伤的机制
2025-04-10 论道心血管 论道心血管 发表于四川省
该研究首次揭示,高血糖诱导的内皮细胞代谢记忆通过细胞外小囊泡(sEV) miRNA的持续释放,驱动糖尿病心脏病不可逆进展,为破解“血糖控制良好却仍发生心衰”的临床困境提供了答案。
糖尿病是心力衰竭的重要危险因素,临床数据显示,即使血糖控制良好的患者仍存在显著的心衰风险。这种现象可能与"代谢记忆"效应相关—即高血糖引发的病理改变在血糖正常化后仍持续存在。目前,代谢记忆导致心脏损伤的具体机制尚未阐明,临床上亦缺乏针对该过程的特异性干预策略。
2025年4月2日,空军军医大学基础医学院付锋、裴建明和西京医院高超合作在Cell Metabolism杂志发表了题为“O-GlcNAcylation-mediated endothelial metabolic memory contributes to cardiac damage via small extracellular vesicles”的研究论文。该研究首次揭示,高血糖诱导的内皮细胞代谢记忆通过细胞外小囊泡(sEV) miRNA的持续释放,驱动糖尿病心脏病不可逆进展,为破解“血糖控制良好却仍发生心衰”的临床困境提供了答案。

研究发现,即使通过胰岛素治疗使血糖恢复正常,糖尿病动物血浆中的小细胞外囊泡(sEV)仍会持续对心肌细胞产生有害影响。在链脲佐菌素诱导的糖尿病动物模型中,12周观察到心脏收缩功能显著下降,射血分数(EF)降低。分离自糖尿病动物血浆的sEV (DM-sEV)可诱导心肌细胞凋亡,并激活促凋亡蛋白caspase 3活性。值得注意的是,即使在后期进行胰岛素治疗使血糖正常化,这些sEV (DM+Ins-sEV)仍保留类似的损伤效应,表明高血糖诱导的代谢记忆通过sEV持续影响心脏功能。

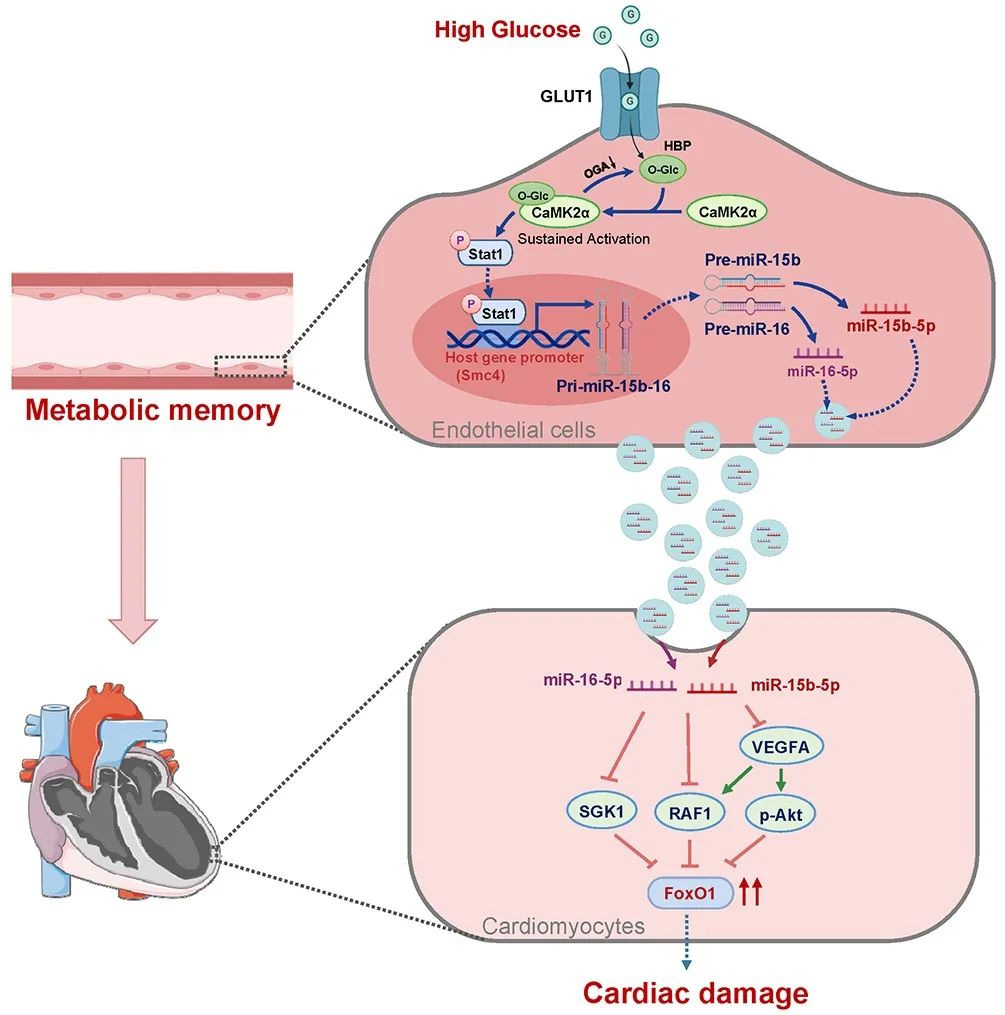
通过高通量RNA测序,研究团队在糖尿病sEV中筛选出显著升高的miR-15b-5p和miR-16-5p (统称miR-15-16)。实验表明,抑制这两种miRNA可显著减少心肌细胞凋亡,而模拟其表达则会增强caspase 3活性。进一步分析发现,miR-15-16通过靶向SGK1、RAF1和VEGFA等基因,抑制Akt磷酸化并激活FoxO1信号通路,从而促进心肌细胞凋亡。动物实验证实,将携带miR-15-16的sEV注射至健康小鼠体内,可诱导心脏功能下降和心肌凋亡。进一步的研究发现,动脉内皮细胞为sEV miR-15-16的主要来源。高糖会激活内皮细胞中的CaMK2a/O-GlcNAcylation正反馈环路,即使血糖恢复正常后,该通路仍维持活性,磷酸化激活Stat1,而Stat1磷酸化可驱动miR-15-16前体的转录,导致sEV miR-15-16持续释放。
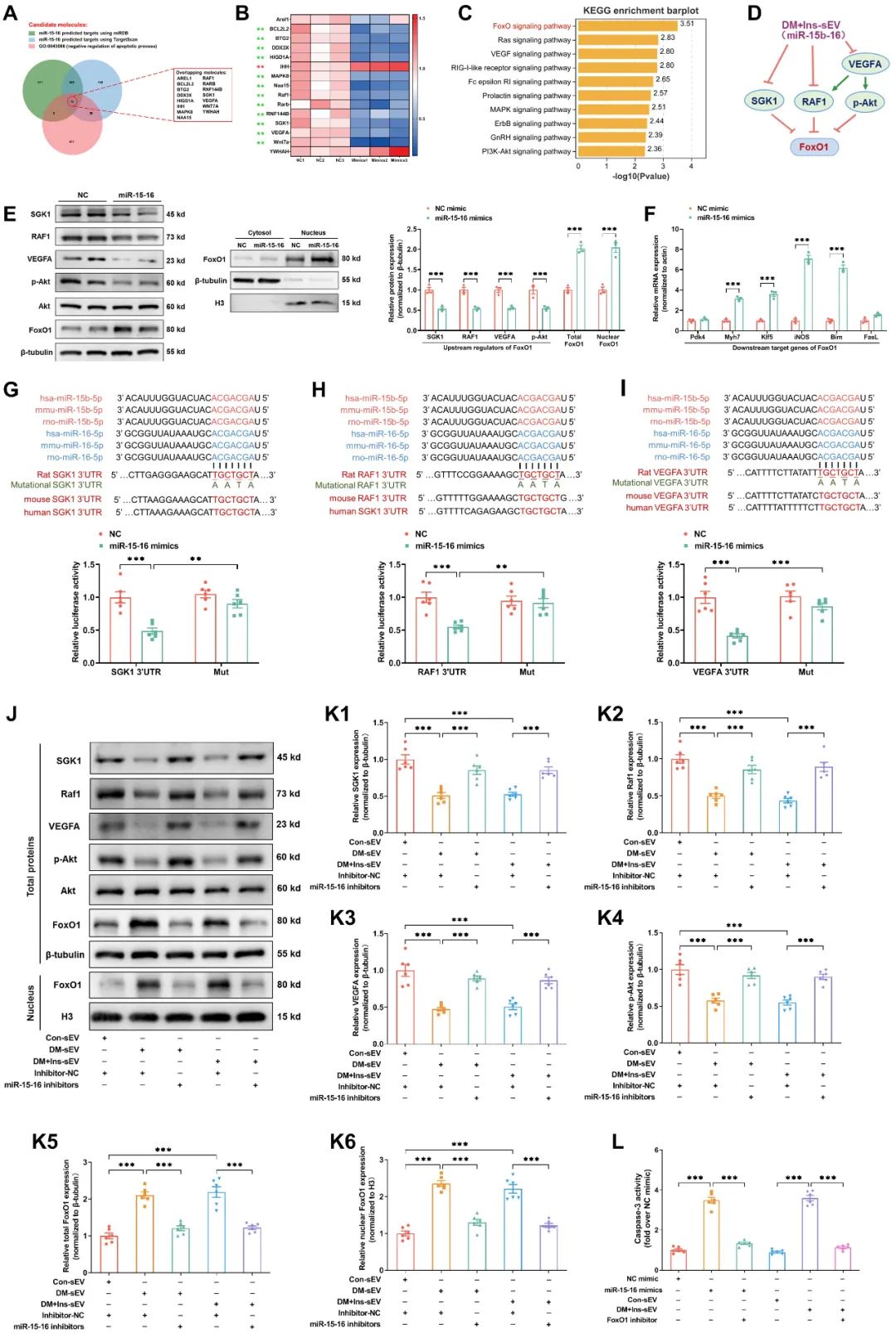
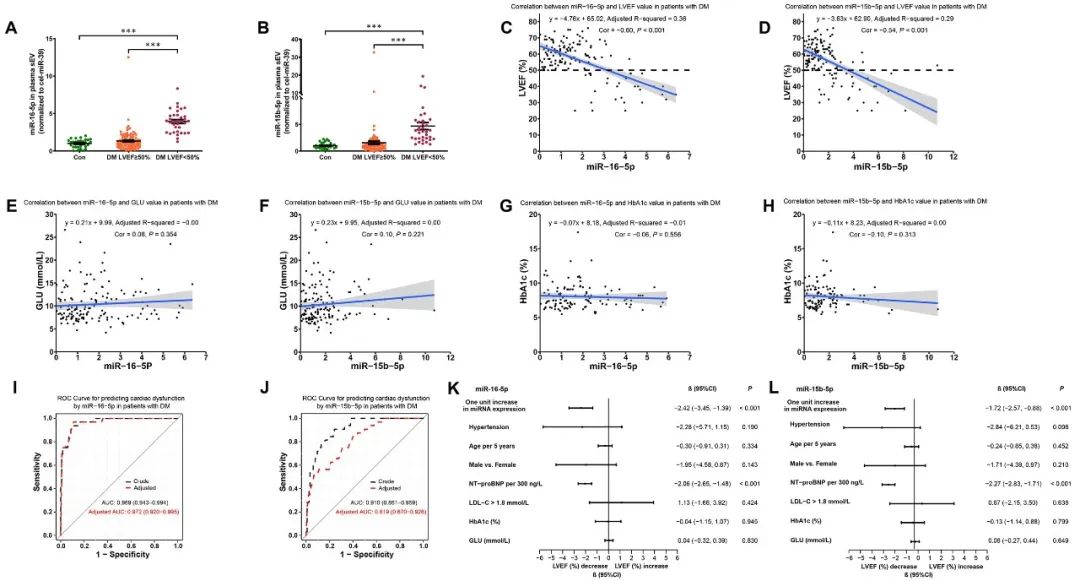
上述主要结论在糖尿病患者中得到证实。通过对糖尿病患者及健康志愿者血浆sEV的检测发现,左心室射血分数(LVEF)低于50%的糖尿病患者血浆sEV中miR-15-16水平显著升高,与LVEF呈显著负相关,而与血糖及糖化血红蛋白无显著相关性,表明糖尿病患者血浆sEV miR-15-16水平与心脏功能障碍独立相关,且不受血糖控制影响。
综上,该研究揭示了糖尿病代谢记忆通过内皮细胞sEV miR-15-16介导心脏损伤的核心机制。早期血糖控制可阻断CaMK2a/O-GlcNAcylation环路,而晚期降糖干预则因正反馈形成难以逆转相关通路。抑制miR-15-16释放或靶向FoxO1信号通路可能成为治疗新方向。这些发现拓展了代谢记忆的理论框架—从传统的表观遗传调控延伸至蛋白翻译后修饰与细胞间通讯,揭示sEV miR-15-16作为跨组织代谢记忆载体的生物学功能,为开发“代谢记忆擦除”的新型疗法奠定基础。
空军军医大学付锋、高超和裴建明教授为共同通讯作者,丁铭格、史睿、杜艳艳和常盼为该论文共同第一作者。该工作得到国家自然科学基金、陕西省重点研发计划、空军军医大学“雏鹰计划”项目资助。
原文链接:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(25)00109-3

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#糖尿病# #心力衰竭#
18