Cancer Res:南京医科大学董高超/蒋峰/许林合作研究发现cEMSY可以提高免疫肺腺癌治疗效果
2025-02-24 iNature iNature 发表于陕西省
该研究通过系统筛选多种细胞应激因子诱导的ICD模型,在肺腺癌中识别了一种保守的、与ICD相关的环状RNA——cEMSY。
免疫原性细胞死亡(ICD)能够引发主动的免疫反应。激活ICD是增强免疫治疗抗肿瘤活性的潜在方法,突显了需要识别有效且安全的ICD诱导剂。
2025年2月1日,南京医科大学董高超,蒋峰和许林共同通讯在Cancer Research在线发表题为“The circRNA cEMSY Induces Immunogenic Cell Death and Boosts Immunotherapy Efficacy in Lung Adenocarcinoma”的研究论文。该研究通过系统筛选多种细胞应激因子诱导的ICD模型,在肺腺癌中识别了一种保守的、与ICD相关的环状RNA——cEMSY。cEMSY在体外和体内均能诱导肺腺癌细胞发生ICD,导致损伤相关分子模式(DAMPs)的释放,并促进树突状细胞的T细胞交叉激活。
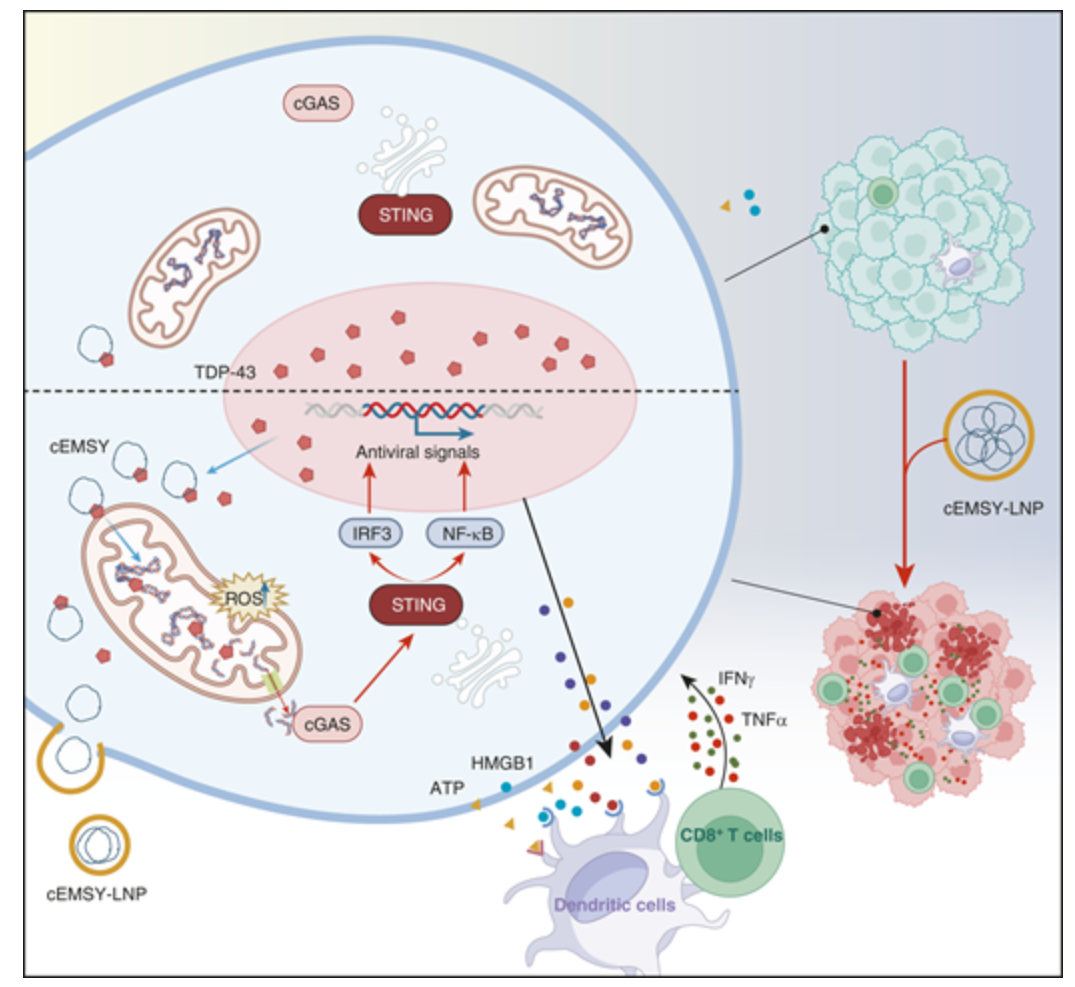
值得注意的是,脂质纳米粒子包封的cEMSY肿瘤内递送,在免疫抑制的肿瘤模型中诱导了强大的抗肿瘤免疫反应,并与PD-1阻断剂协同作用,促进了长期的抗肿瘤免疫,且未见明显毒性。机制上,cEMSY通过介导RNA结合蛋白TDP-43在线粒体的聚集,导致线粒体DNA的泄漏,从而刺激cGAS-STING通路,激活抗病毒免疫反应。在临床上,cEMSY的高表达与肺腺癌中树突状细胞和CD8+ T细胞的浸润增加及免疫治疗反应的改善相关。综合来看,这些发现支持cEMSY作为靶点和生物标志物的双重潜力,能够提高肺腺癌免疫检查点抑制剂治疗的反应。这项研究揭示了cEMSY在免疫治疗中的潜在应用,特别是在免疫抑制肿瘤环境中的作用,可能为肺腺癌的治疗提供新的方向。

免疫检查点抑制剂(ICI)靶向PD-1/PD-L1和CTLA4通路已彻底改变了治疗格局,在肺腺癌中取得了显著成功。然而,ICI的反应率仍然不理想;只有少数癌症患者能够从ICI中获益,且大多数应答患者最终会发展为耐药性。这种低反应率可能与大多数患者的“冷”肿瘤特征有关。通常,高免疫原性的“热”肿瘤会展现出抗肿瘤CD8+ T细胞反应的特征,这与更好的ICI临床反应相关。而在免疫抑制的“冷”肿瘤中,癌细胞通常表现出较低的免疫原性,缺乏癌症特异性或癌症相关抗原,或者存在抗原呈递机制的缺陷,从而阻碍了充分的肿瘤T细胞浸润。因此,越来越多的研究致力于开发创新的治疗策略或组合治疗,旨在将“冷”肿瘤转化为“热”肿瘤。在这一背景下,免疫原性细胞死亡(ICD)作为一种前景广阔的治疗方法,逐渐受到关注,它能够使肿瘤对免疫系统可见,并增强肿瘤对ICI的反应。
ICD是一种受调控的细胞死亡形式,特点是释放危险相关分子模式(DAMPs),包括钙网蛋白外排、ATP的产生、HMGB1的释放,以及I型干扰素和趋化因子的分泌。这些分子作为“吃我”和“找我”信号,促进树突状细胞(DC)的成熟和交叉呈递,最终诱导肿瘤特异性的T细胞介导的抗肿瘤免疫反应。临床研究表明,药物诱导的ICD与治疗反应和增强的抗肿瘤CD8+ T细胞免疫性反应呈正相关。至今,只有少数抗癌药物被认为是公认的ICD诱导剂。此外,大多数标准化疗方案,如顺铂(CDDP)和吉西他滨,被认为不是ICD诱导剂,因此需要辅助疗法来诱导ICD相关DAMPs的释放。因此,ICD如何提供保护性抗肿瘤免疫以及如何可靠地诱导ICD仍然未知。
模式机理图(图片源自Cancer Research )
环状RNA(circRNA)作为抗肿瘤免疫和免疫治疗的重要调节因子,已经崭露头角。例如,靶向circATXN7可改善转移性KRAS突变肿瘤中肿瘤反应性细胞毒性T淋巴细胞的抗肿瘤活性。此外,靶向circMGA/HNRNPL复合物可促进前列腺癌中CD8+ T淋巴细胞的浸润,并通过减少CCL5分泌来提高抗PD-1疗效。最近,circRNA的显著抗肿瘤潜力扩展了其在RNA治疗领域的应用,其中相较于传统的mRNA疗法,circRNA具有更好的稳定性和持久的抗原呈递,因此被视为下一代RNA疗法的有前途的候选者。有报道指出,靶向SARS-CoV-2的circRNA疫苗诱导了稳定的中和抗体和细胞免疫反应,且毒性最小。近期研究表明,使用载体封装的circRNA编码抗原作为治疗性癌症疫苗,成功清除了B16黑色素瘤。然而,目前尚未有研究报道circRNA作为免疫原性增强剂来增强癌症免疫治疗。
在本研究中,作者进行了系统筛选,发现了一种保守的环状RNA——cEMSY,它是肺腺癌中新型的ICD相关circRNA。cEMSY在肺腺癌中表现出下调,其在肿瘤中的表达水平低于正常组织。此外,cEMSY在肺腺癌中的作用与正常细胞不同,它的表达并不影响正常细胞的活力。在肺腺癌的背景下,cEMSY能够在体外和体内诱导ICD。此外,肿瘤内递送脂质纳米粒子(LNP)包封的体外转录cEMSY(cEMSY-LNP)增强了肺腺癌细胞对抗PD-1治疗的敏感性。
在机制上,cEMSY通过其RRM1结构域与RNA结合蛋白TDP-43相互作用,诱导其在线粒体中聚集,导致线粒体DNA(mtDNA)泄漏,激活细胞质DNA感知的cGAS-STING通路,并产生随之而来的抗病毒免疫反应。临床上,作者观察到,肺腺癌患者中高表达cEMSY的患者,树突状细胞和CD8+ T细胞的浸润增加,且免疫检查点抑制治疗的无进展生存期和疗效得到了改善。总之,作者的研究揭示了circRNA cEMSY作为潜在的ICD诱导因子,为circRNA基础的策略增强癌症免疫治疗提供了新的前景。这项研究表明cEMSY不仅是ICD诱导剂,还可能作为增强癌症免疫治疗反应的有力工具。
原文链接:
https://doi.org/10.1158/0008-5472.CAN-24-1484
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#肺腺癌# #cEMSY#
9