J Nanobiotechnology 苏州大学惠杰/沈振亚/陈维倩/蒋璇发现基于细胞外囊泡递送的序贯方案可高效治疗缺血性疾病
2025-04-15 论道心血管 论道心血管
该课题组创新性地提出“预耗竭-逃逸”序贯给药策略,旨在诱导肝脾单核-巨噬系统耗竭,进而阻断治疗性药物非靶截留。
缺血性疾病因其广泛流行特征及远期致残致死风险,已成为全球性公共卫生重大挑战。其病理级联反应不仅造成组织局部缺血缺氧损伤,还经系统性炎症及内皮功能紊乱引发多脏器并发症。值得关注的是,细胞外囊泡(Extracellular Vesicles, EVs)作为内源性纳米级信号载体,在缺血性疾病的精准干预中展现出独特治疗优势。然而,外源EVs在临床应用时面临药代动力学限制,其易被肝脾单核-巨噬系统快速清除,直接造成外周血有效浓度不足。
鉴于此,苏州大学附属第一医院惠杰/沈振亚/陈维倩/蒋璇心血管科研团队在Journal of Nanobiotechnology (中科院1区)上发表了题为“An integrated “Engage & Evasion” approach for mononuclear phagocyte system escape and efficient extracellular vesicle therapy”的研究论文。该课题组创新性地提出“预耗竭-逃逸”序贯给药策略,旨在诱导肝脾单核-巨噬系统耗竭,进而阻断治疗性药物非靶截留。在这一策略中,第一阶段注射树突状细胞来源囊泡(DV)作为"预耗竭"元件,诱导单核-巨噬系统短暂耗竭,降低其清除能力;第二阶段则构建跨膜蛋白CD47修饰囊泡(MV47)作为“逃逸”元件,实现药物载体长效循环。CD47能够与单核/巨噬细胞表面SIRPα形成高亲和力复合物,从而抑制细胞吞噬作用。

为验证“预耗竭-逃逸”序贯给药策略的体内免疫逃逸效果,研究团队通过尾静脉依次注射DV与DiR标记的MV47,并利用小动物活体成像系统对离体器官进行荧光强度分析。结果显示,序贯治疗组小鼠肝脾部位的DiR荧光强度显著降低。进一步转录组测序分析表明,经DV处理后的Kupffer细胞中吞噬相关通路的基因集表达显著下调,表明DV能够诱导Kupffer细胞吞噬功能耗竭,进而重编程其递送微环境(图1)。
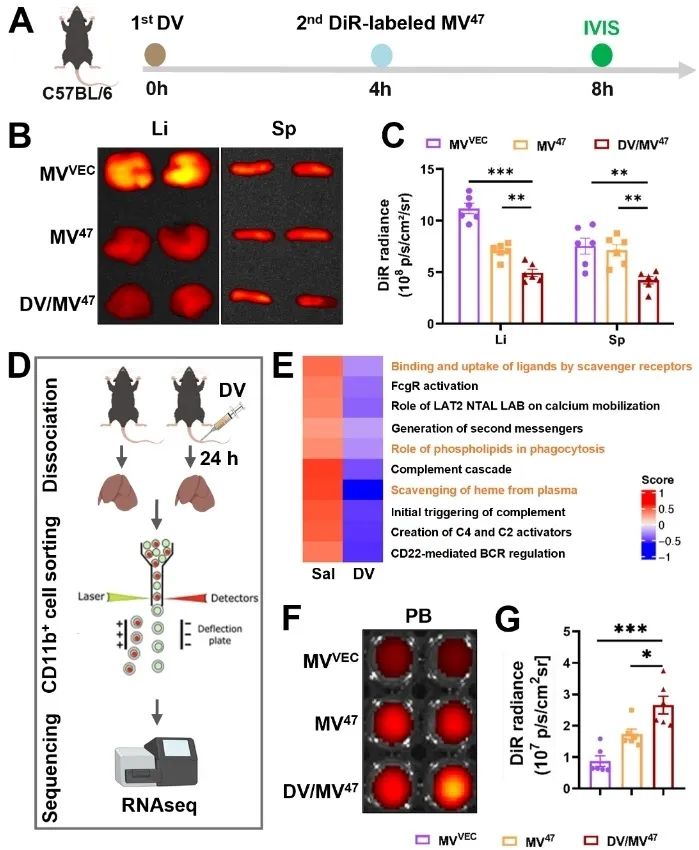
图1. “预耗竭-逃逸”序贯给药策略显著提升血液药物浓度
为评估序贯治疗策略对缺血疾病的治疗效果,该研究构建小鼠心肌梗死模型。结果显示,序贯治疗组心功能显著改善,梗死面积明显减小,同时,微血管新生数量显著增加(图2),表明序贯治疗策略通过血管新生有效推动缺血心肌功能恢复。
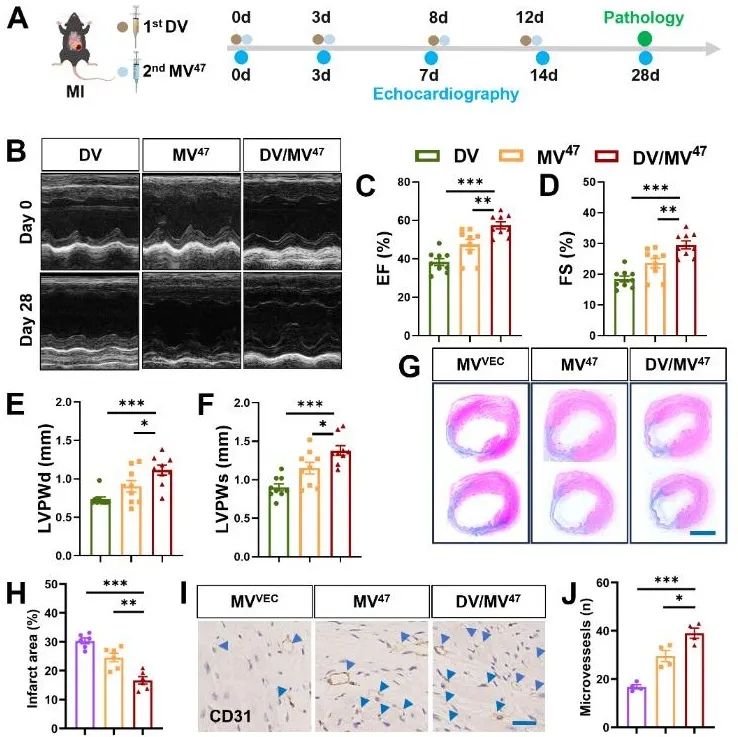
图2. “预耗竭-逃逸”序贯给药策略显著改善心梗后心功能重构
综上所述,该研究创新性提出“预耗竭-逃逸”序贯给药策略,通过诱导肝脾单核-巨噬系统特异性耗竭,有效减少治疗药物的非靶截留。机制研究证实,该策略高效阻断肝脾单核-巨噬系统“自我识别”信号轴,成功实现免疫逃逸。该策略显著延长治疗性药物的循环时间,大幅提升药物在靶组织中的蓄积量,为缺血性疾病的临床治疗带来新的突破与变革。
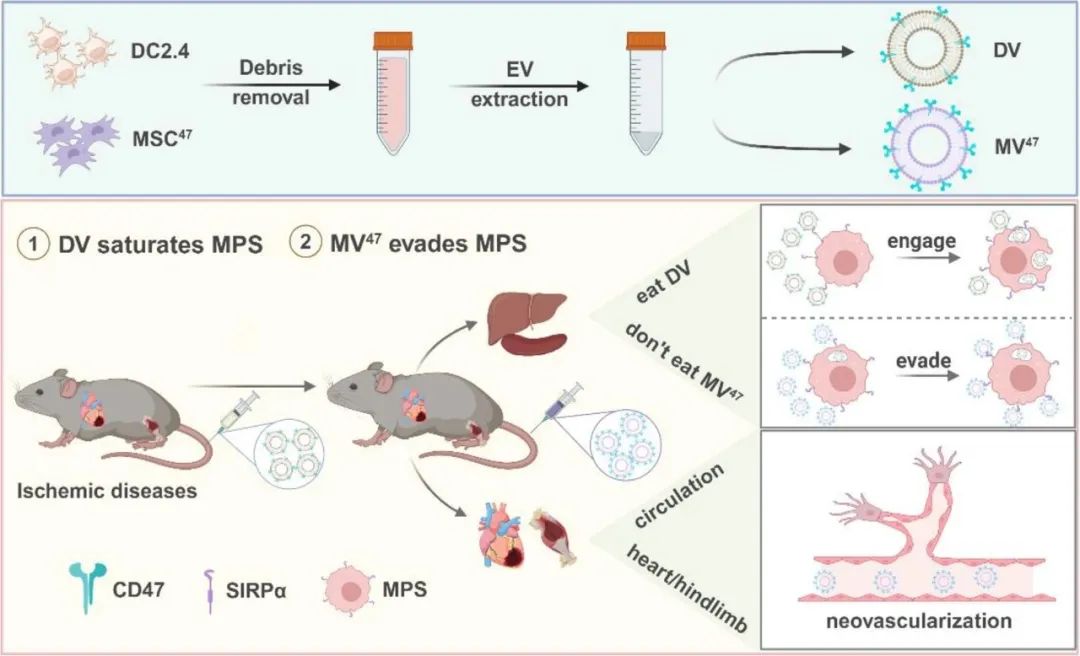
图3. “预耗竭-逃逸”序贯给药策略的双模块递送示意图
苏州大学附属第一医院惠杰教授、沈振亚教授、陈维倩副教授和中山大学蒋璇副教授为共同通讯作者;泰安市中心医院刘洪满、向兵和苏州大学心血管病研究所李梦婷、杨秭莹为共同第一作者;苏州大学为第一作者单位。
原文链接:
https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-024-03032-z

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#缺血性疾病# #细胞外囊泡递#
11