ATVB 南通大学刘东教授团队基于活体成像解码糖尿病微血管并发症内皮细胞行为
2025-02-02 论道心血管 论道心血管 发表于陕西省
南通大学刘东教授团队建立高糖损伤微血管内皮动物模型,发现高糖通过 foxo1a - klf2a 途径诱导斑马鱼微血管内皮细胞核聚集和细胞异常迁移,为糖尿病微血管病变机制及药物研发提供新视角与模型。
糖尿病微血管并发症一直是困扰医学界的难题,像糖尿病视网膜病变、肾病和糖尿病足等,严重影响患者的健康和生活质量[1]。在糖尿病血管病变的发展过程中,高血糖是 “罪魁祸首”,高糖环境会对血管内皮细胞造成直接损伤[2]。血管内皮细胞是血管内壁,高糖会使它们的功能异常,变得不再紧密,导致血管壁的通透性增加,血液中的有害物质更容易进入血管壁,引发炎症反应和氧化应激[3, 4]。目前,虽然对糖尿病血管并发症的机制研究不断积累,但基于目前认知的现有药物却不能有效缓解相关症状。
糖尿病微血管病变至少包括:1、血管闭塞;2、过度血管新生;3、微动脉瘤等。目前已经发表的论文中的高糖诱导微血管病变模型鲜有包含这三种表型的。为了探索高糖损伤微血管内皮细胞的新机制,南通大学刘东教授团队建立了可用于高分辨率活体成像的高糖损伤微血管内皮的动物模型。该模型具有多种微血管并发症表型,高度重现了糖尿病病人微血管病变中的临床表征,微血管闭塞的表型发表于2024年的Cardiovascular Research;微血管过度新生的表型发表于2024年ELife (图1, 图2) [5, 6].
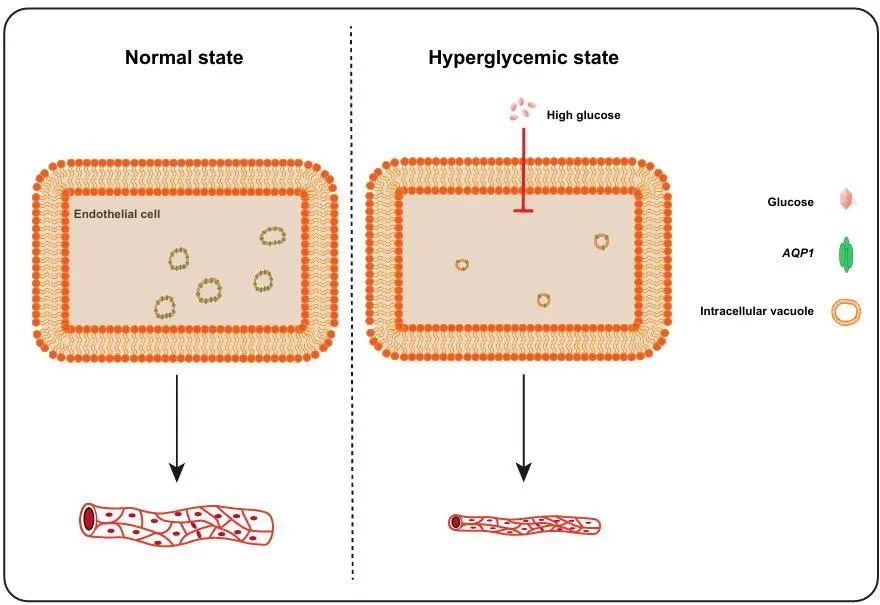
图1. 高糖导致微血管管腔狭窄[6]
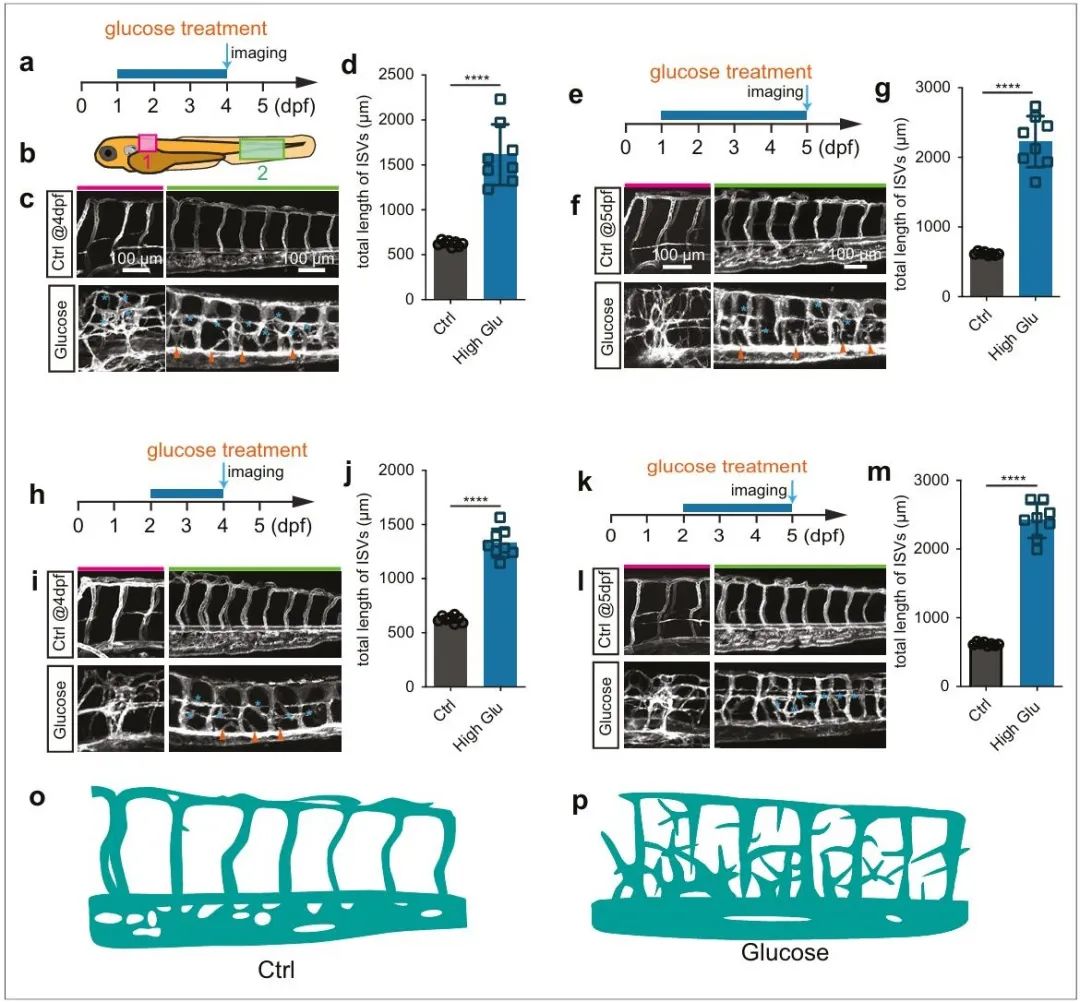
图2. 高糖处理导致斑马鱼微血管过度新生[5]
2025年1月30日,该团队在美国心脏学会(AHA)杂志Arteriosclerosis, Thrombosis, and Vascular Biology在线发表了题为“High glucose treatment induces nuclei aggregation of microvascular endothelial cells via foxo1a-klf2a pathway”的研究论文。在之前模型的基础上,研究人员通过高分辨率和延时成像分析内皮细胞的行为发现:高糖处理会导致斑马鱼胚胎节间血管中的内皮细胞核发生聚集,与微动脉瘤中堆积在一起的细胞核高度相似。不仅如此,高糖处理的胚胎中微血管内皮细胞还出现了异常迁移,而这可能就是导致内皮细胞核聚集的原因之一(图3, 图4)。
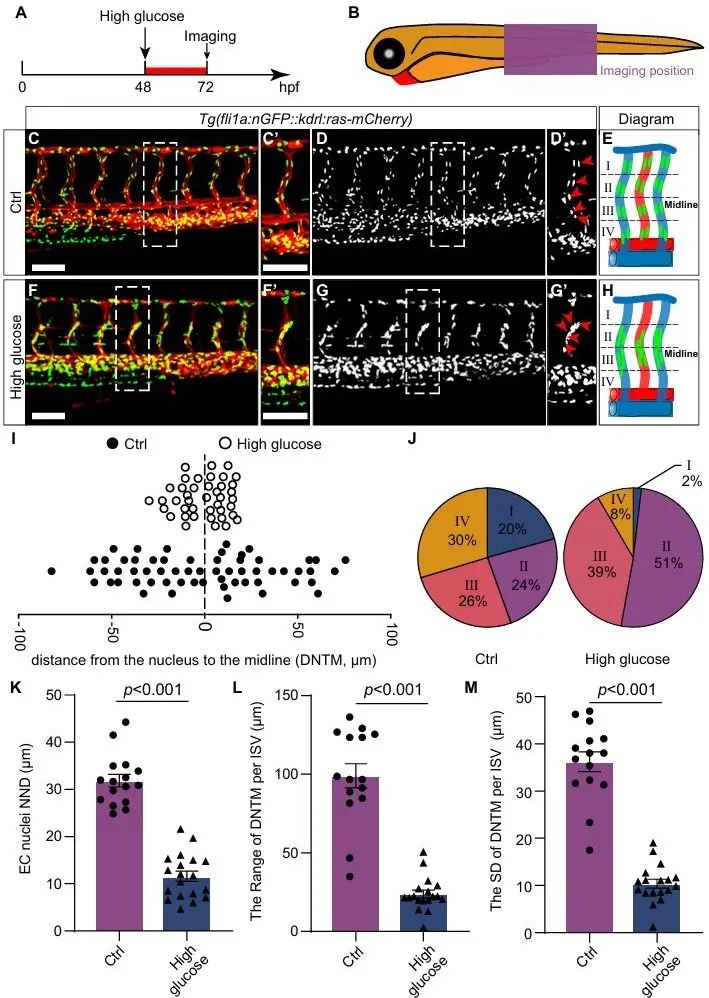
图3. 高糖处理导致斑马鱼微血管内皮细胞核聚集
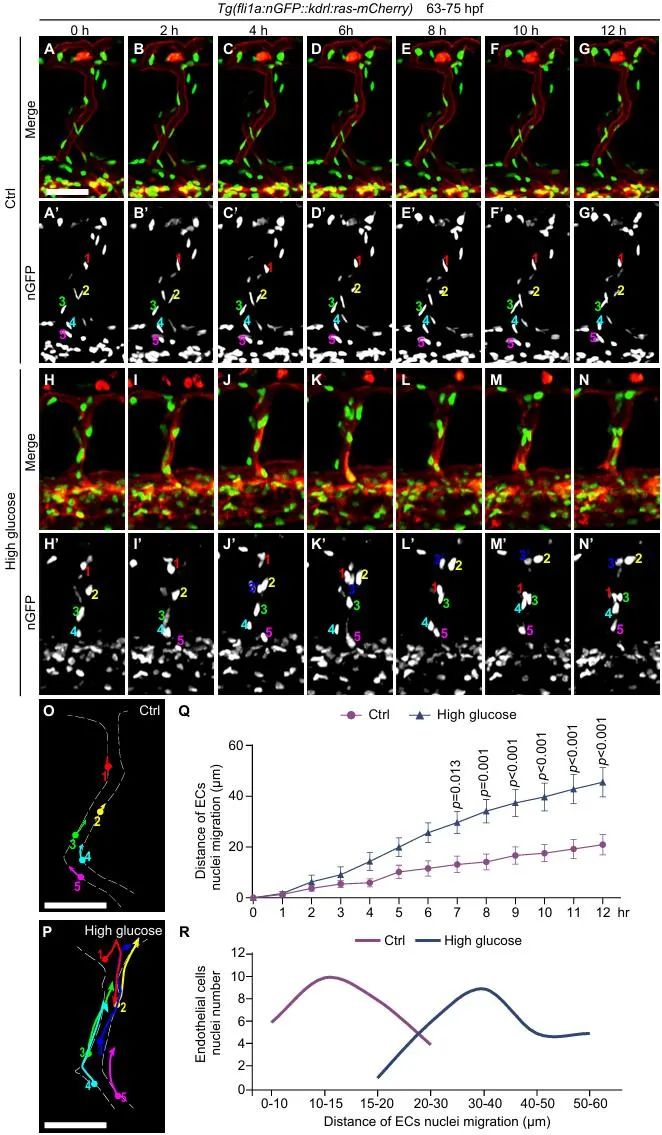
图4. 高糖处理导致斑马鱼微血管内皮细胞核异常迁移
进一步通过单细胞RNA测序分析发现,高糖处理会导致foxo1a的表达下降,而foxo1a表达降低又会使得其直接下游效应因子klf2a的表达增加,最终导致血管内皮细胞核的异常迁移和聚集。为了验证这一机制,研究人员首先利用AS1842856来抑制Foxo1功能,结果显示,抑制剂处理后,斑马鱼胚胎节间血管的内皮细胞核出现了聚集,和高糖处理后的表型相似,而在胚胎中过表达foxo1a则能减轻高糖诱导的内皮细胞核聚集。接着,研究人员发现高糖处理后,动脉和毛细血管内皮细胞中Foxo1的下游Klf2a显著上调,在斑马鱼胚胎中过表达klf2a同样会导致内皮细胞核聚集和异常迁移,抑制klf2a则能部分恢复内皮细胞核的表型(图5, 图6)。
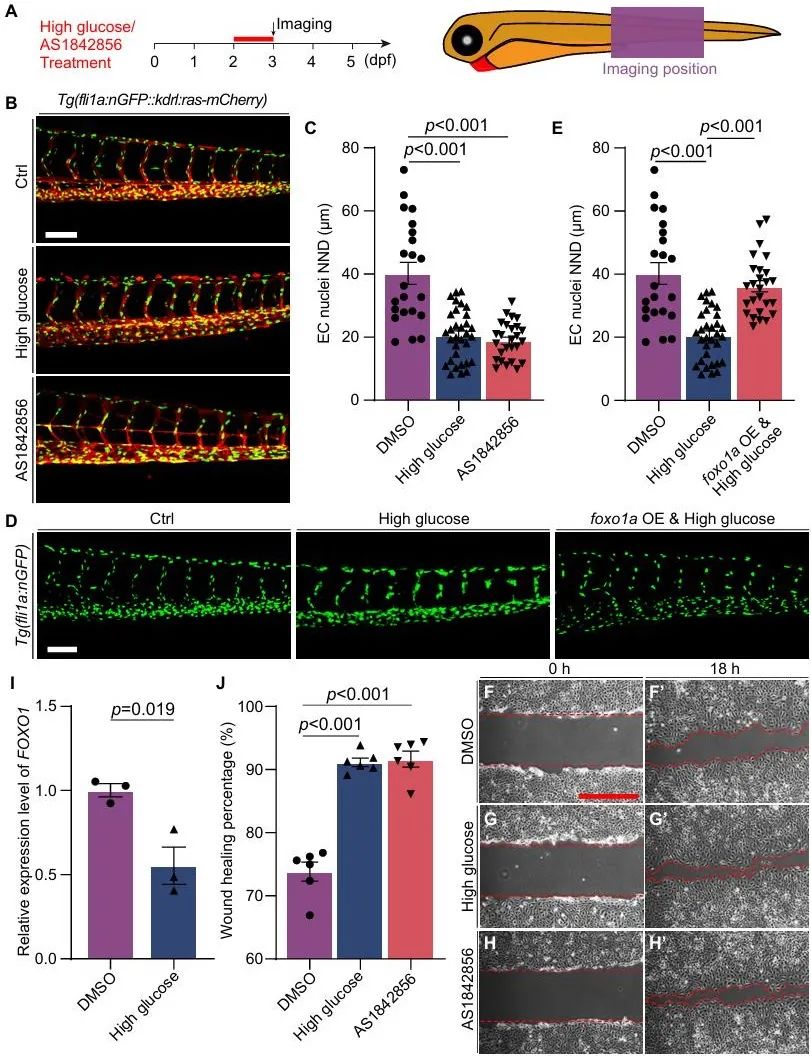
图5. Foxo1a参与高糖导致的微血管内皮细胞异常迁移和内皮细胞核聚集
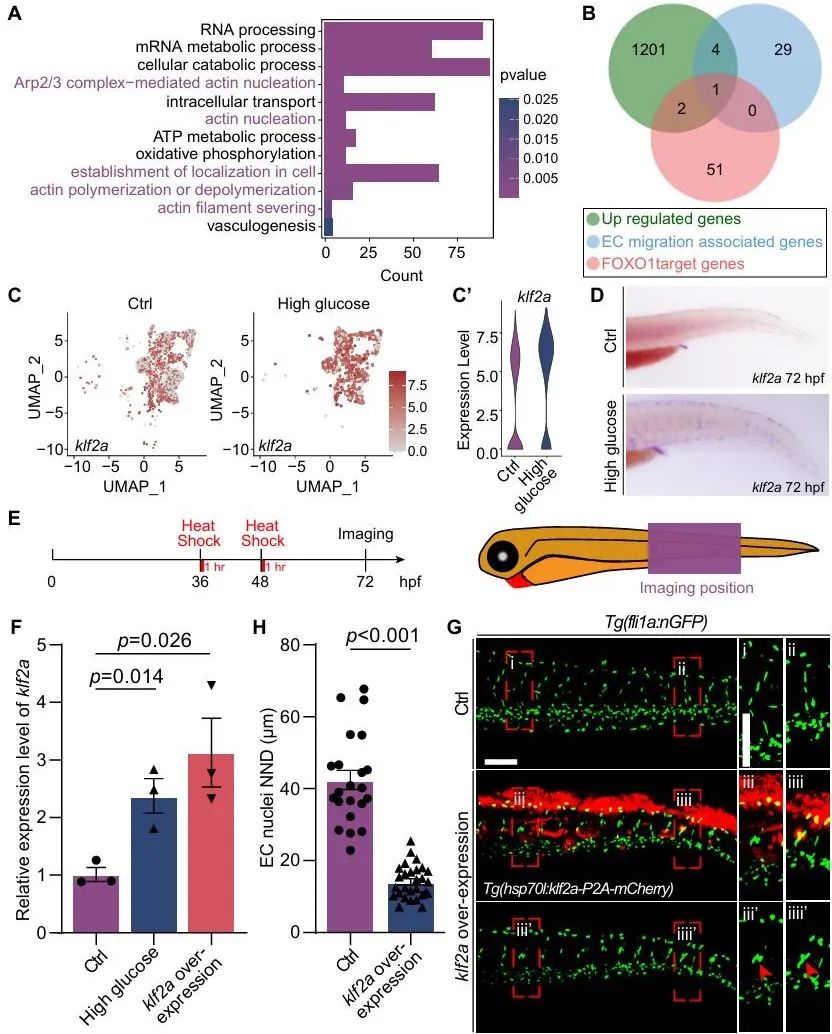
图6. Klf2a参与高糖导致的微血管内皮细胞核聚集
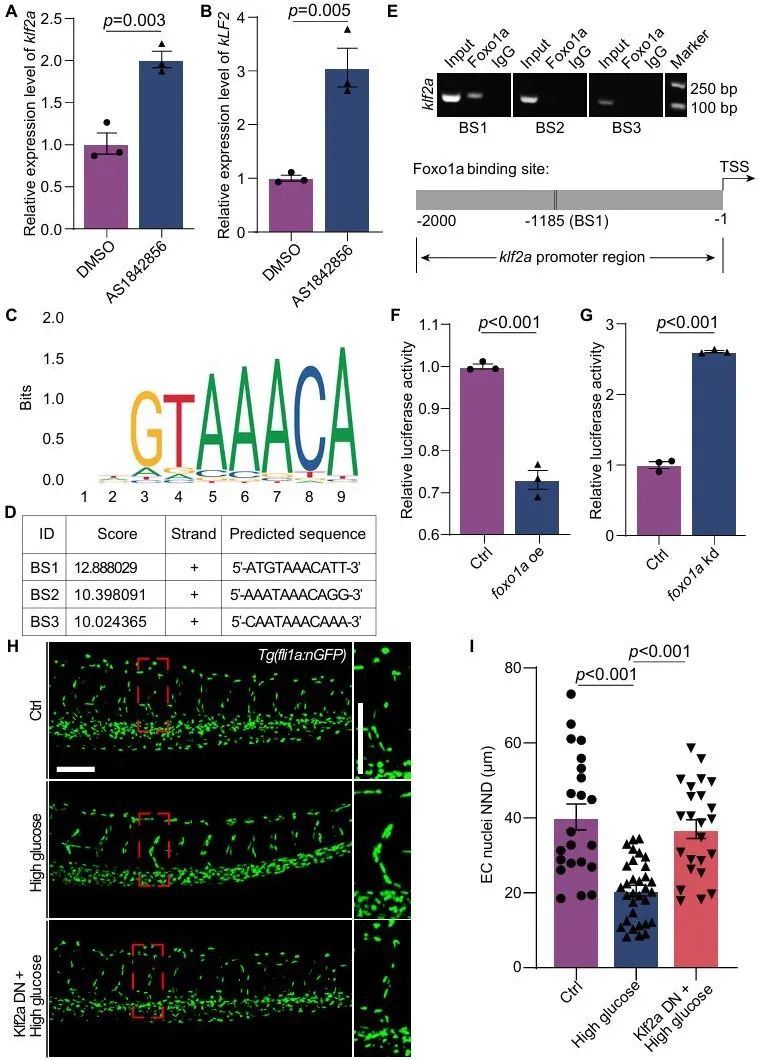
图7. Foxo1a-klf2a调控高糖处理导致的微血管内皮细胞核聚集
综上,这项研究为糖尿病微血管病变提供了一个良好的疾病模型,同时首次揭示了高糖在体内诱导内皮细胞核聚集和内皮细胞异常迁移,并且明确了这种表型是由 foxo1a-klf2a介导的(图7)。这一发现为高血糖引发微血管并发症的机制提供了全新的视角,让我们对糖尿病微血管并发症的发病机制有了更深入的理解。该团队提供的系列糖尿病微血管病变模型为未来靶向微血管并发症的药物研发提供了新的选择。
南通大学附属医院王晓宁博士、附属第二医院康心怡为论文第一作者,南通大学生命科学学院刘东教授、陈昌盛博士、附属第二医院陈丽萍主任为论文通讯作者,南通大学为论文唯一通讯单位。
参考文献:
1. Vithian, K. and S. Hurel, Microvascular complications: pathophysiology and management. Clin Med (Lond), 2010. 10(5): p. 505-509.
2. Sena, C.M., A.M. Pereira, and R. Seiça, Endothelial dysfunction - a major mediator of diabetic vascular disease. Biochim Biophys Acta, 2013. 1832(12): p. 2216-2231.
3. Paneni, F., S. Costantino, and F. Cosentino, Role of oxidative stress in endothelial insulin resistance. World J Diabetes, 2015. 6(2): p. 326-332.
4. Zhao, D., et al., Monocytes Release Pro-Cathepsin D to Drive Blood-to-Brain Transcytosis in Diabetes. Circ Res, 2024. 134(7): p. e17-e33.
5. Wang, X., et al., Noncaloric monosaccharides induce excessive sprouting angiogenesis in zebrafish via foxo1a-marcksl1a signal. Elife, 2024. 13: p. RP95427.
6. Chen, C., et al., Aquaporins enriched in endothelial vacuole membrane regulate the diameters of microvasculature in hyperglycaemia. Cardiovasc Res, 2024. 120(9): p. 1065-1080.
原文链接:
https://www.ahajournals.org/doi/10.1161/ATVBAHA.124.321719
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#内皮细胞# #糖尿病微血管并发症#
19