警惕!ICI治疗可能隐藏的肝损害风险
2024-12-11 肝癌在线 肝癌在线 发表于陕西省
近期,北京大学第一医院侯凤琴教授作“免疫检查点抑制剂(ICI)肝损害”学术分享,肝癌在线特将精彩内容整理成文,以飨读者。
随着免疫检查点抑制剂(ICI)在各类恶性肿瘤的治疗中被广泛应用,ICI相关肝损害值得引起临床医生的足够重视。近期,北京大学第一医院侯凤琴教授作“免疫检查点抑制剂(ICI)肝损害”学术分享,肝癌在线特将精彩内容整理成文,以飨读者。
一、ICI及肝损害发生概况
T细胞的免疫主要涉及抗原提呈细胞(APC)、TCR及T细胞免疫三联复合体。正常情况下,要激活CD8+T细胞,必须存在第二共刺激信号,TCR才与MHC提呈的肽结合。CD28是最重要的共刺激信号,与APC的B7-1结合。共刺激过程受APC和T细胞上的“激动”分子与抑制信号严格调节,这些分子常被统称为“免疫检查点”分子。
其中涉及到比较重要的免疫检查点分子主要是两个。
(1)CTLA 4:正常情况下,CTLA-4(CD152)-CD86(B7-2)结合,在抗原递呈后激活T细胞阶段抑制T细胞过度活化,起到生理性“刹车”作用。而抗CTLA-4单抗能够促进T细胞活化,提高抗肿瘤作用。
(2)PD-1/PD-L1:正常生理情况下,PD-1 / PD-L1结合能够促进效应T细胞耗竭及促进效应T细胞转变成Treg细胞。而抗PD-1、抗PD-L1单抗可以在T细胞效应阶段增加T细胞数量及活性。
因此,ICI是一把双刃剑,有利的一面在于可以有效打破肿瘤的免疫逃逸,而不利的一面在于它会打破机体免疫耐受状态。免疫检查点的存在是对机体的一种保护机制,对于维持免疫耐受和预防自身免疫至关重要。一旦这种免疫耐受保护机制被打破,会引起全身多系统的免疫性损害。
ICI相关肝损的发病率并没有那么高,最早上市的抗CTLA 4单抗伊匹木单抗(3mg/kg)肝损发生率约3.8%,且与剂量相关,增至10mg/kg后肝损发生率为24.4%;后续抗PD-1单抗纳武利尤单抗、帕博利珠单抗肝损发生率约为3.4%和1%左右;抗CTLA4和PD-1单抗联合应用后,肝损发病率显著增加至33%,且与剂量密切相关。
抗PD-L1单抗阿维单抗、阿替利珠单抗、度伐利尤单抗肝损的发病率更低,约在1%以内。在肝癌治疗中,单用阿替利珠单抗肝损发生率和3级及以上肝损发生率分别为17.4%、5.4%;而一旦联合应用贝伐珠单抗后,两个率分别为33.4%和10.6%;同时,抗PD-1联合TKI(酪氨酸激酶抑制剂)治疗,两个率分别为27%和13%。总体来说,肝损发生率排序,抗PD-1单抗<抗PD-L1单抗<抗CTLA 4单抗。
ICI最致命的并发症是心肌炎。ICI相关肝损的危险因素主要包括:ICI的类型及剂量、是否联合治疗、潜在的肝脏疾病、基础的自身免疫性疾病、肿瘤类型。也有发现,有代谢相关脂肪性肝病的患者,ICI相关肝损发生的概率更高,是独立的危险因素。
二、ICI肝损害发生机制
ICI相关免疫损伤(irAEs)发生的主要机制是基于自我耐受和T细胞介导的免疫系统的改变,但确切机制不清,主要包括以下四方面。
(1)活化的T细胞攻击正常组织:抗原表位扩散是导致irAEs机制之一。从最初的、靶向的、表位特异性的反应,到对其他蛋白质和自身抗原不加区分的免疫反应。肿瘤细胞的裂解导致大量蛋白质和宿主抗原(可能是新抗原)的释放。以前的研究发现,类似的T细胞浸润在肿瘤和组织中,两者之间的T细胞抗原重叠,进一步支持这种脱靶效应在易感患者中启动irAEs。
(2)炎症性细胞因子的增加:促炎细胞因子增加,ICls影响T辅助细胞群的组成,包括Th1,Th2,Th17,T滤泡辅助细胞。Th1和Th17细胞的激活,分泌促炎细胞因子,如IL-12,IL-17,IFN-γ和TNF;抗CTLA-4已被证明可以诱导Th1细胞的膨胀,增加促炎细胞因子(IL-2,IFN-γ,TNF)的产生水平,进一步激活CTL及先天免疫细胞,如巨噬细胞和NK细胞。
(3)自身抗体的增加:抗原增加,主要是肿瘤释放的抗原增加,自身抗原与肿瘤释放的抗原类似,可出现自身抗体增加;Th2细胞的活化,可以辅助B淋巴细胞产生抗体增加。
(4)补体介导的炎症反应增强。
三、ICI肝损害临床表现及诊断
ICI肝损害潜伏期不等,可以是6-12周或早8天或晚治疗结束后数月;临床类型包括肝细胞型、淤胆型、混合型;临床表现可无症状或乏力、纳差、尿黄等。
目前依据不良事件通用术语标准(CTCAE)对肝脏免疫相关不良事件的严重程度分为4级:
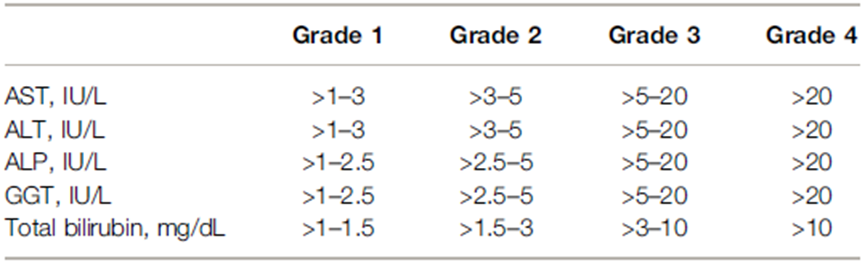
ICI肝损害的诊断主要是一个排他性诊断,需要排除其他常见肝损因素才可诊断。
四、ICI肝损害处理
CSCO指南对肝损伤的处理原则如下:
G1:无症状(AST/ALT>ULN至3倍ULN和/或总胆红素>ULN至1.5倍ULN)。
· 继续ICI并密切监测;考虑其他病因。
· 考虑每周监测实验室指标1-2次。
· 通过支持治疗进行症状控制管理。
G2:无症状(3倍ULN<AST/ALT≤5倍ULN和/或1.5倍ULN<总胆红素≤3倍ULN)。
· 暂时停用ICI。
· 应建议患者停用不必要的药物和任何已知有肝毒性的药物,暂时停用其他潜在肝毒性肿瘤药物。
· 对于2级肝毒性,如果3-5天后未见改善,可给予类固醇(0.5-1mg/kg/d泼尼松)或等效药。
· 增加监测频率至每3天一次。
· 如果3天后没有完全缓解,考虑加用吗替麦考酚酯。
· 当症状改善至≤G1时,可减量类固醇,当类固醇≤10mg/d时,可恢复ICI治疗。减量期至少持续1个月。
· 考虑对G2及以上进行肝病会诊。
· 如果接受泼尼松≤10mg/d后恢复至≤G1,则可恢复ICI治疗。
G3:AST/ALT为ULN的5-20倍和/或总胆红素为ULN的3-10倍,或有肝功能障碍症状;活检纤维化;代偿性肝硬化;慢性肝炎复发。
遵循列出的G2建议,G3增加以下内容:
· 无论有无症状,永久停用ICI治疗。
· 立即开始类固醇1-2mg/kg甲泼尼龙或等效药治疗。
· 如果是类固醇难治性疾病,考虑肝活检以排除NASH、肿瘤、淤胆型肝损伤、其他药物相关肝脏炎症、感染或其他自身免疫性疾病,如果排除了感染原因,则考虑加用硫唑嘌呤或麦考酚酯。
· 每天或每隔一天进行实验室检查;考虑对AST/ALT>8倍ULN和/或总胆红升高>3倍ULN的患者进行住院监测。
· 如果类固醇或ICI联合新药、标准CTX或靶向治疗未获得改善,则转科至肝病专家进行进一步肝炎病理学评估。
· 当≤G1时,可尝试在4-6周左右逐渐减少类固醇剂量,如有需要,可重新递增剂量,最佳持续时间尚不清楚。
· 必要时考虑转诊至三级医疗机构。
G4:AST/ALT>20倍ULN和/或总胆红素>10倍ULN或肝功能代偿失调(如腹水、凝血障碍、脑病和昏迷)。
遵循列出的G3建议,G4增加以下内容:给予2mg/kg/d甲泼尼龙或等效药。
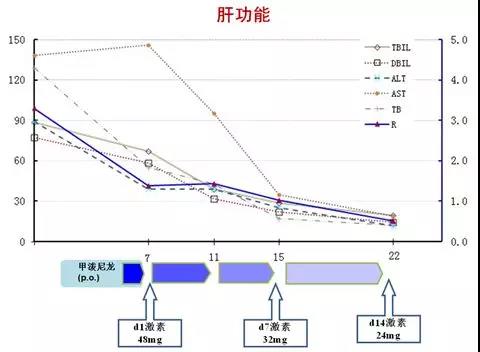
理论上肝损3级或4级以上的患者需要永久停用ICI。但最近一项研究对23例Grade3或4级肝损害患者再次ICls治疗,高达15例(65%)未再出现肝损害,仅8例(35%)再次出现肝损害。
23例中19例(82.6%)接受激素治疗,12例强的松,7例甲基强的松,只有2例(8.7%)加用霉酚酸酯;再次治疗时,8例(34.8%)服用5-10mg强的松。肝损害到ICls再治疗中位时间为10周,18例(78.3%)采取相同的ICl,其中17例anti-PD1/anti-PD-L1、1例anti-PD1+anti-CTLA-4,5例肿瘤进展改变方案。
结果提示:肝炎复发的严重程度往往与第一次肝损害相似。再次出现肝损害的患者往往有潜在的肝脏疾病,ANA大于1:80,有基础的自身免疫性疾病病史。再次出现肝损害的患者,肿瘤治疗效果好于未再出现肝损害的患者。
胆管损伤型患者糖皮质激素治疗效果往往不佳,大多数患者胆酶可不同程度降低,但难以降至正常水平。有报道18个月后仍未恢复正常,需要加熊去氧胆酸联合治疗。
参考文献
1. Martins F, Sofiya L, Sykiotis GP, Lamine F, Maillard M, Fraga M, Shabafrouz K, Ribi C, Cairoli A, Guex-Crosier Y, Kuntzer T, Michielin O, Peters S, Coukos G, Spertini F, Thompson JA, Obeid M. Adverse effects of immune-checkpoint inhibitors: epidemiology, management and surveillance. Nat Rev Clin Oncol. 2019 Sep;16(9):563-580.
2. Remash D, Prince DS, McKenzie C, Strasser SI, Kao S, Liu K. Immune checkpoint inhibitor-related hepatotoxicity: A review. World J Gastroenterol. 2021 Aug 28;27(32):5376-5391.
3. Delire B, De Martin E, Meunier L, Larrey D, Horsmans Y. Immunotherapy and Gene Therapy: New Challenges in the Diagnosis and Management of Drug-Induced Liver Injury. Front Pharmacol. 2022 Jan 19;12:786174.
4. Sawada K, Hayashi H, Nakajima S, Hasebe T, Fujiya M, Okumura T. Non-alcoholic fatty liver disease is a potential risk factor for liver injury caused by immune checkpoint inhibitor. J Gastroenterol Hepatol. 2020 Jun;35(6):1042-1048.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#肝损害# #免疫检查点抑制剂#
8