特别关注|滤泡辅助性T淋巴细胞在自身免疫性肝炎中的作用机制
2024-08-16 临床肝胆病杂志 临床肝胆病杂志 发表于上海
本文将重点探讨Tfh在AIH中的致病机制相关研究进展,以期为AIH的临床治疗提供新的思路和策略。
自身免疫性肝炎(AIH)是一种由肝脏自身抗原免疫耐受降低引起的慢性炎症性肝病,主要表现为高球蛋白血症、自身抗体阳性和组织学上界面性肝炎及汇管区浆细胞浸润等。随着人类生活环境的改变、诊疗水平的提高以及生物制剂的广泛使用,AIH的发病率在全球范围呈逐年上升趋势,严重危害人民健康。目前,AIH的一线治疗方案为糖皮质激素+硫唑嘌呤,其目的是改善患者症状及控制炎症,达到生化缓解。此外,霉酚酸酯、他克莫司和环孢素也通常用于AIH的治疗,但停药后易复发。因此,有必要深入研究AIH的发病机制,为AIH的诊断和治疗提供依据。与其他自身免疫性疾病类似,AIH的特征是自身反应性T淋巴细胞激活,B淋巴细胞过度活跃,自身抗体产生增加等。滤泡辅助性T淋巴细胞(Tfh)作为一种特殊的CD4+T淋巴细胞亚群,主要分泌促炎因子,引起肝组织炎症和损伤。因此,本文将重点探讨Tfh在AIH中的致病机制相关研究进展,以期为AIH的临床治疗提供新的思路和策略。
1Tfh概述
1.1 Tfh的分化
Tfh是CD4+T淋巴细胞的一个特殊亚群,主要分布于次级淋巴器官的生发中心(GC)内,具有诱导B淋巴细胞分化和成熟的功能,并驱动高亲和力抗体的产生。Tfh按其定位可分为淋巴器官的GC-Tfh和外周血循环Tfh(cTfh)。Tfh特征性表达CXC趋化因子受体5(CXCR5),诱导共刺激分子(ICOS)、B淋巴细胞淋巴瘤6(Bcl-6)和程序性死亡受体1(PD-1)。
Tfh的分化是一个多阶段的过程,受到不同因素的调控,其中Bcl-6、IL-21和IL-6是Tfh分化的重要因素。Bcl-6是Tfh分化所需的主转录因子,在促进Tfh分化、B淋巴细胞活化和GC形成中发挥关键作用。研究表明,Bcl-6在Tfh分化中的表达和活性显著上升,其缺失可导致Tfh分化受阻。Bcl-6能够抑制PD-1和IL-2表达,提高Tfh对B淋巴细胞的辅助作用。此外,Bcl-6还能够抑制Tfh向其他T淋巴细胞亚群转化的能力,从而确保Tfh的纯度和稳定性。因此,Bcl-6在Tfh分化和功能上发挥着至关重要的作用。Bcl-6也可通过下调Blimp-1(B淋巴细胞诱导成熟蛋白1)的表达,进而抑制转录因子T-bet对辅助性T淋巴细胞1(Th1)的作用。
IL-21是Tfh产生的主要细胞因子,也是调节Tfh分化的重要因子,IL-21可诱导Tfh的分化,并与B淋巴细胞IL-21R结合,直接调控B淋巴细胞的增殖、成熟和分化。IL-21-信号传导转录激活因子3(STAT3)通路可通过诱导Bcl-6表达和拮抗IL-2信号促进GC-Tfh分化。IL-6作为一种诱导剂,可通过诱导STAT3磷酸化促进IL-21表达和GC-Tfh分化。IL-21、IL-6作为Tfh分化的正向因子,可通过激活STAT3信号通路下调叉头转录因子p3(Foxp3)、TGF-β的表达,抑制滤泡调节性T淋巴细胞(Tfr)的发育。
ICOS和IL-6具有协同作用,在Tfh分化和迁移中具有重要作用,ICOS还通过c-Maf调节IL-21的产生,而IL-21和c-Maf反过来调节Tfh的分化。PD-1抑制ICOS信号表达,进而抑制Tfh功能。IFN-γ在Tfh分化中发挥积极作用,促进Tfh的发育和增殖。其中IL-2作为调节性T淋巴细胞(Treg)分化的正向因子和Tfh分化的负向因子,可以通过上调Foxp3和Bcl-6的表达促进Tfr的发育。
1.2 Tfh的功能
成熟的Tfh迁移至GC,GC与Tfh细胞表面的CD40L/CD40发生作用产生细胞因子IL-21或IL-4,促进B淋巴细胞增殖和体细胞高频突变,使B淋巴细胞分化为高亲和力浆细胞或记忆B淋巴细胞。研究表明,IL-9可驱动GC记忆B淋巴细胞的发展,GC-Tfh中IL-9缺失可导致记忆B淋巴细胞形成受损。除了Tfh驱动的共刺激信号和细胞因子外,Tfh产生大量多巴胺,导致细胞内可诱导共刺激分子配体(ICOSL)快速转位至B淋巴细胞表面,ICOSL/ICOS相互作用可增强CD40L和嗜铬粒B颗粒在Tfh突触的积累,增加了突触面积,促进Tfh与GC的结合,从而加速了记忆B淋巴细胞的形成与积累。
CD40L对于GC的发展和维持以及与B淋巴细胞亲和力成熟、免疫球蛋白类别转换和长寿浆细胞分化相关的过程至关重要。研究发现,CD40L从Tfh转移至B淋巴细胞需要持续的CD40信号,并使抗原提呈B淋巴细胞在GC中存活和增殖。CD40L从T淋巴细胞转移至B淋巴细胞的机制可能包括:(1)蛋白水解脱落或膜转移。CD40作为同型三聚体Ⅱ型跨膜蛋白,是肿瘤坏死因子超家族分子的成员。CD40L以18 kD片段的形式从细胞中释放出来,具有充分的生物活性,并被B淋巴细胞接收。(2)CD40L可能在携带相关效应分子的外泌体中释放,通过膜融合或靶细胞的内化发挥生物学效应。外泌体是纳米级的细胞外囊泡(直径30~150 nm),在来自血小板、肥大细胞和淋巴母细胞的外泌体中可观察到CD40,T淋巴细胞释放含有CD40L的外泌体。实验表明,T淋巴细胞来源的细胞外囊泡的转移可诱导GC反应和抗体产生,这些反应依赖于受限的外泌体微小RNA(miR)分子,包括miR-20a-5p、miR-25-3p和miR-155-3p。因此,Tfh很可能通过释放含有CD40L或其他功能分子的外泌体帮助B淋巴细胞。
2Tfh在AIH中的作用
2.1 Tfh在AIH发病中的作用
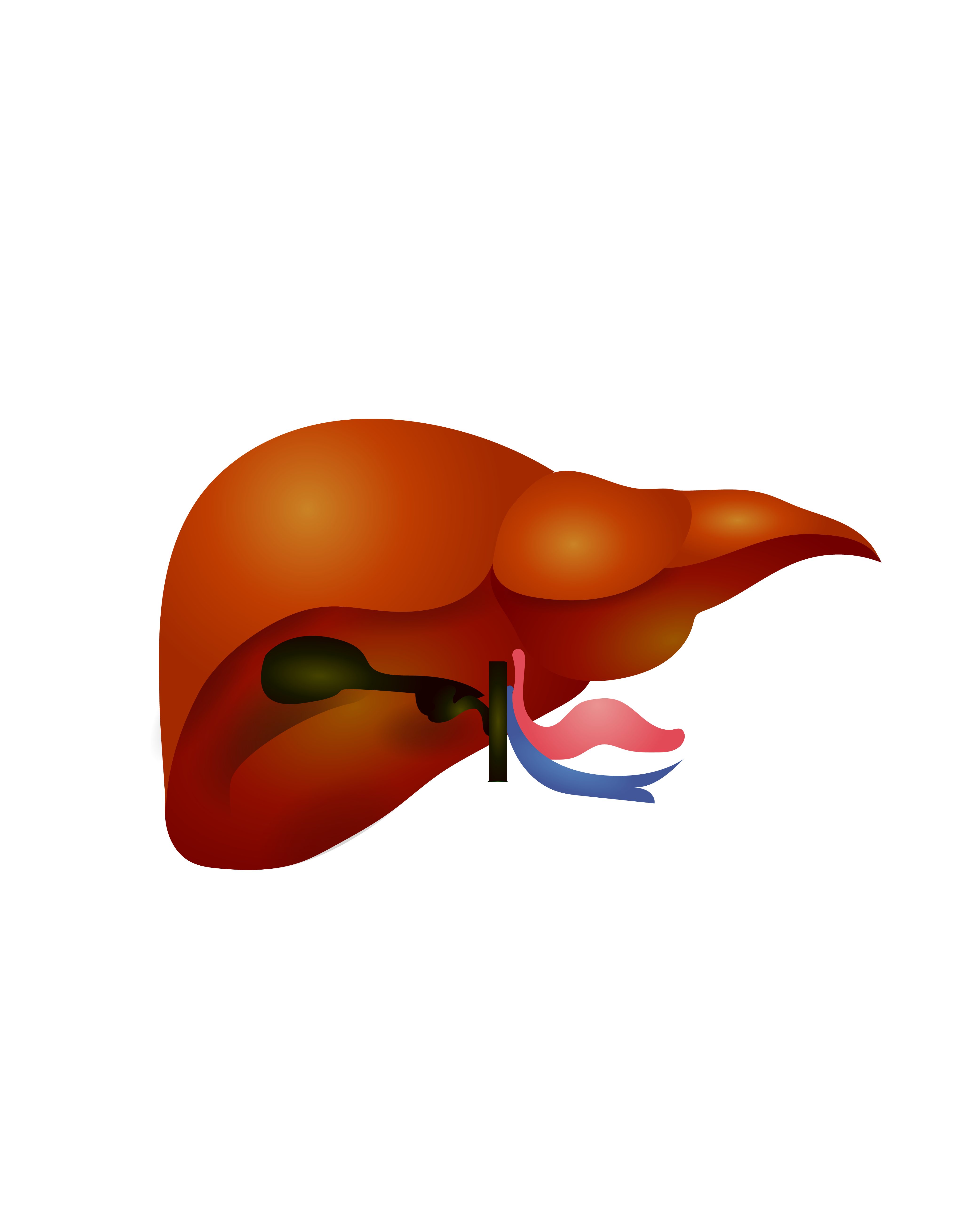
在AIH发展过程中,Tfh为GC区B淋巴细胞提供产生自身抗体的关键信号(图1)。Tfh和IL-21与AIH密切相关。Ma等发现AIH患者血清IL-21水平较高,同时伴有浆细胞、活化B淋巴细胞、Tfh和血清免疫球蛋白,并证实Tfh通过分泌IL-21参与AIH自身免疫。Morita等利用共培养实验报道,Tfh通过分泌IL-21诱导新生B淋巴细胞产生免疫球蛋白。同时,在AIH小鼠模型中,阻断IL-21的分泌能有效抑制Tfh的产生,阻止小鼠AIH的发生。Abe等发现AIH患者血清IL-21水平明显高于非严重肝病患者,这种增加与坏死性炎症活性呈正相关,血清IL-21水平有望成为预测肝组织中坏死性炎症活动演变的指标,为AIH的诊断提供重要依据。Ma等发现强的松+乳酸菌可显著改善AIH患者外周血单核细胞IL-21和Tfh水平,降低小鼠肝脏IL-21、Bcl-6和CXCR5 mRNA表达,表明乳酸菌可增强强的松对AIH患者和实验性AIH小鼠的治疗作用。
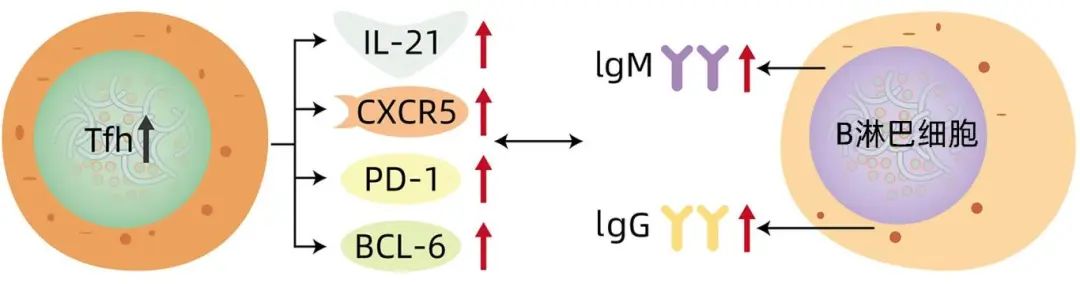
图1 AIH中Tfh与B淋巴细胞相互作用机制
过表达的Tfh可导致GC的过度反应,如自我反应性B淋巴细胞增殖紊乱,长寿浆细胞过度分化,大量分泌高亲和力致病性自身抗体。在AIH小鼠模型中,与健康对照组相比,血清ALT、AST、Tfh均显著增加,并参与AIH的发生和发展。在AIH患者中,Tfh的数量和功能均明显增强,并与患者体内抗体水平的升高密切相关。Tfh表面受体PD-1通过与其配体——程序性死亡配体(PD-L1)或PD-L2结合,抑制适应性免疫反应。趋化因子受体7(CCR7)的作用与PD-1相反,可促进多种适应性免疫功能。研究发现,AIH患者外周血中存在CCR7-PD-1+Tfh亚型,AIH患者外周血CCR7-PD-1+Tfh定量检测可用于AIH的辅助诊断。CXCR5、Bcl-6和ICOS也可能控制Tfh的转录,然而Tfh是否通过CXCR5和ICOS参与AIH的发病机制尚未得到证实,还需更多基础研究验证。综上所述,Tfh通过转录因子及分泌细胞因子和配体等参与AIH的发病过程,其可作为AIH进展和治疗的指标。
2.2 Tfr/Tfh失衡与AIH的关系
Tfr为GC-B淋巴细胞提供自身抗体产生的关键信号,其过度激活与高γ-球蛋白血症密切相关,高γ-球蛋白血症可加速AIH的免疫病理发病过程。Tfr在识别共受体细胞毒性T淋巴细胞相关蛋白4(CTLA-4)时,间接抑制Tfh的激活,从而减少自身抗体的产生。因此,Tfr/Tfh失衡可导致免疫稳态被破坏,使自身抗体分泌过多,参与AIH的免疫病理过程。
Tfr起源于胸腺Foxp3+Treg前体,其可作为一种防止自身反应性B淋巴细胞生成和调节正常GC反应的细胞。Tfr同时表达Treg主调控因子Foxp3和其他Treg相关分子,如CD25和CTLA-4。Tfr表达异常可能导致免疫耐受的破坏,进而诱导自身免疫性疾病的免疫发病机制。
研究发现,Tfr和Tfh之间的失调参与AIH的免疫病理过程。在实验性小鼠和AIH患者中观察到较多Tfh,与Tfr数量呈负相关;在AIH患者中,PD-1+Tfr和ICOS+Tfr水平显著升高,表明激活的Tfr可能提供负信号抑制异常B淋巴细胞的激活和分化,且Tfr中CTLA-4的表达减少,提示CTLA-4作为一种抑制分子维持免疫自我耐受和免疫稳态的重要调节剂,Tfr上CTLA-4的耗竭可能导致对自身免疫反应抑制性缺陷。因此,Tfr上CTLA-4分子表达的减少和PD-1/ICOS的增加可能通过调节B淋巴细胞反应参与AIH的发病过程。最近研究表明,肠道菌群失调有助于AIH的发展,通过粪便微生物移植可控制实验性AIH小鼠的肝炎进展,其机制可能与调节Tfr/Tfh免疫失衡、恢复肠道菌群成分有关。
3小结
随着对AIH的深入研究,Tfh被证实与AIH发病有密切联系。Tfh参与B淋巴细胞分化过程中的信息传递,协助激活B淋巴细胞,促进GC的形成和免疫球蛋白的类别转换,维持长时间体液免疫应答。Tfh的过度表达可能是包括AIH在内的免疫性疾病发生的重要原因之一,其具体免疫学机制仍有待进一步阐明。深入阐述Tfh表型、功能及相关免疫学因素与AIH发生发展的内在联系,将为AIH更有针对性的靶点治疗提供新的思路和理论依据。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240727

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













感谢您的分享
60
认真学习了
61
#自身免疫性肝炎# #滤泡辅助性T淋巴细胞#
80