Cancer Discovery:儿童急性T淋巴细胞白血病的临床特征与高危突变
2024-12-06 儿童肿瘤前沿 儿童肿瘤前沿 发表于陕西省
本研究首次全面探讨了儿童γδ T-ALL的临床特征和基因分型,并揭示了高危突变的致病机制及潜在的治疗策略。
急性T淋巴细胞白血病(T-ALL)是儿童最常见的血液系统肿瘤之一。其中γδ T-ALL是一个较少研究的亚型,其肿瘤细胞表面表达由γ链和δ链组成的T细胞受体(TCR),约占全部T-ALL病例的10%。既往研究提示,该亚型可能面临更差的治疗效果和更高的复发风险。
由于缺乏大规模针对γδ T-ALL的研究,其临床特征和发病机制仍不清楚。虽然近年来通过基因组学研究取得了一些进展,但这些研究纳入的γδ T-ALL病例较少,且缺乏对非编码区等基因组特征的分析,因此亟需进行更全面、深入的研究。
近日,以圣裘德儿童研究医院 Charles G. Mullighan 和 Hiroto Inaba 团队牵头的多国联合团队在 Cancer Discovery 发表了题为 Biologic and Clinical Analysis of Childhood Gamma Delta T-ALL Identifies LMO2/STAG2 Rearrangements as Extremely High Risk 的文章。该研究基于200例γδ T-ALL的临床和基因组数据,揭示了发病年龄<3岁、诱导治疗后MRD≥1%和STAG2/LMO2突变是儿童γδ T-ALL的高危因素,进而筛选了针对此类患者有效的治疗策略。

本研究纳入了由13项临床研究组成的多国合作组的200例25岁以下的γδ T-ALL患者,以及1,067例根据治疗方案匹配的非γδ T-ALL对照病例。研究发现,γδ T-ALL患者总体上表现出较差的预后,诊断年龄更小,且治疗后的应答更差,表现为在诱导治疗和巩固治疗后都有更高的微小残留病变(measurable residual disease,MRD)水平,需要进行造血干细胞移植的比例更高,且原发病或治疗副作用造成的死亡率更高。
诊断年龄小于3岁的γδ T-ALL患者,其5年无事件生存率(event-free survival,EFS)仅为33%,总生存率(overall survival,OS)仅为49%,显著低于诊断年龄≥3岁的γδ T-ALL患者或非γδ T-ALL患者。此外,诱导治疗结束时(end of induction,EOI),MRD≥1%的患者在所有年龄段的生存率均显著低于MRD<1%的患者。这些数据表明诊断年龄 <3岁和 EOI 时 MRD≥1% 是提示 γδ T-ALL 患儿不良预后的高危因素,因此这些高风险患者可能需要优化的治疗方案。
此外,研究发现,γδ T-ALL患者的复发主要局限于骨髓(骨髓复发率高达91.3%),而非γδ T-ALL患者中枢神经系统复发更常见。
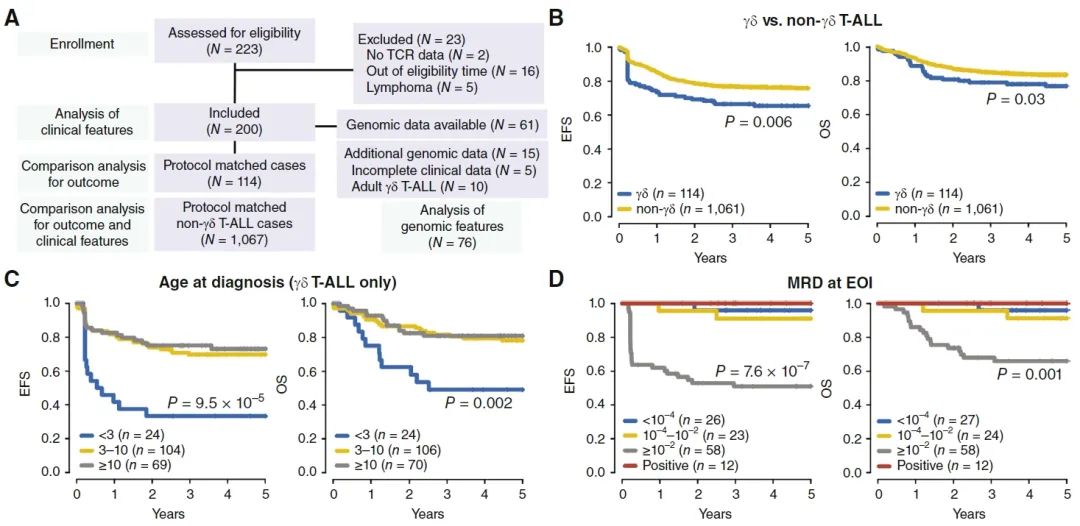
研究设计和患者临床结局:(A)研究方案,(B)γδ T-ALL患者与非γδ T-ALL患者的生存率对比,(C/D)γδ T-ALL患者中诊断年龄和EOI时MRD水平对生存率的影响
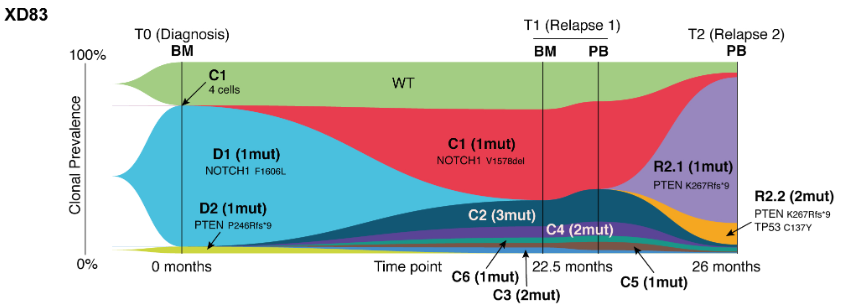
结合全基因组测序(whole genome sequencing,WGS)、RNA测序和HiChIP等技术,研究者对γδ T-ALL患者的基因变异进行了分型,并解析了突变导致的疾病机制。γδ T-ALL患者与非γδ T-ALL患者相比具有独特的基因型分布。STAG2/LMO2双突变是γδ T-ALL患者特征性变异之一,所有纳入研究的该亚型γδ T-ALL患儿的诊断年龄都小于3岁,且与其他类型患者相比生存期显著较短。
进一步研究表明STAG2/LMO2双突变患者中最常见的变异类型是LMO2::STAG2重排,导致STAG2失活和LMO2过度激活。STAG2是黏着复合物(cohesin complex)的重要组分,参与染色质空间折叠以形成拓扑相关结构域(topologically associating domain,TAD),进而通过增强子-启动子相互作用调控基因正常表达。通过构建STAG2缺失和过表达的细胞模型,并进行RNA-seq和H3K27ac ChIP-seq分析,研究者证明了STAG2失活将导致TAD结构异常,严重破坏T细胞分化相关基因表达,导致白血病的发生。
此外,研究还发现了其他γδ T-ALL特异性基因分型,如LMO2-γδ样、超二倍体T-ALL伴重现性染色体增加、TLX3重排和PICALM::MLLT10融合等,这些亚型γδ T-ALL患者具有各自不同的临床特征。
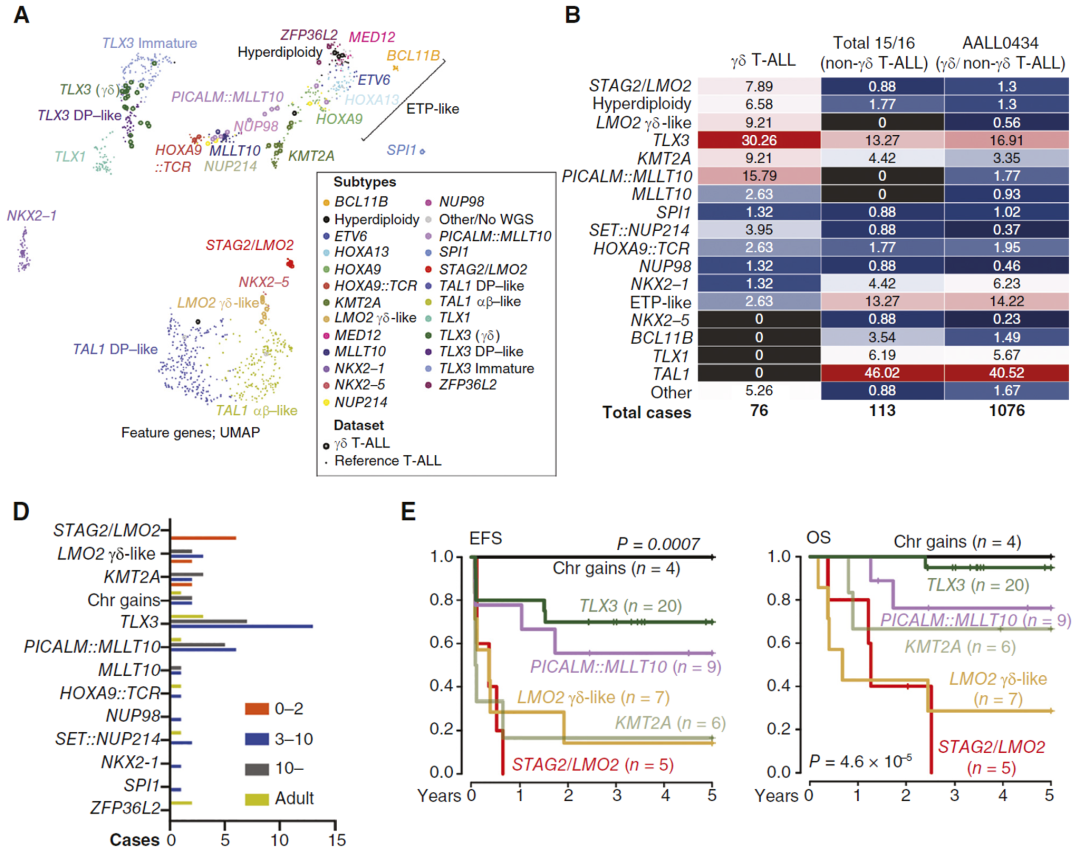
γδ T-ALL基因分型和临床特征:(A)参考所有T-ALL基因组数据对γδ T-ALL进行基因分型,(B)不同基因型在γδ T-ALL与非γδ T-ALL患者中的分布,(D)γδ T-ALL患者不同基因型与诊断年龄的关系,(E)不同基因型γδ T-ALL患者的生存曲线
最后,研究者通过高通量药物筛选探索了潜在的治疗策略。PARP抑制剂talazoparib和组蛋白去乙酰化酶抑制剂vorinostat是对STAG2/LMO2 γδT-ALL细胞具有显著杀伤作用的药物,其中PARP抑制剂靶向STAG2失活造成的DNA复制缺陷,使双链DNA断裂积累并诱导细胞死亡。在患者来源的异种移植模型(PDX)中,talazoparib 和 vorinostat 都可以有效地抵抗肿瘤生长。
其他有效的药物包括nelarabine和L-门冬酰胺酶等,这些药物都已经被用于T-ALL或其他肿瘤的临床研究或治疗。此发现为高风险的γδ T-ALL患儿提供了一种潜在的精准治疗策略。
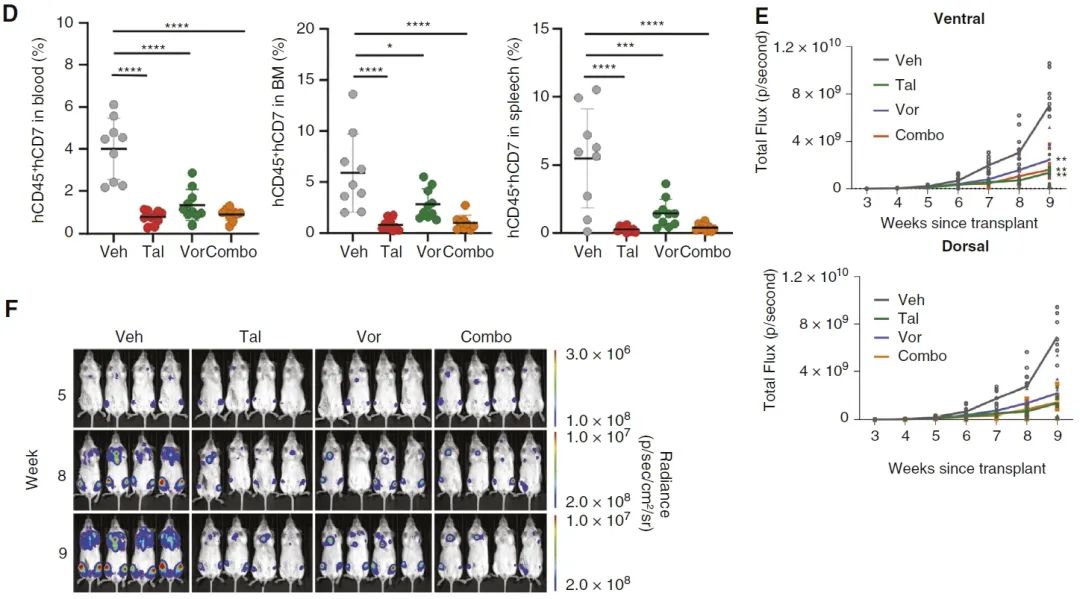
针对talazoparib(Tal)和vorinostat(Vor)的临床前试验表明两种药物均能够显著抑制PDX肿瘤细胞的生长
总之,本研究首次全面探讨了儿童γδ T-ALL的临床特征和基因分型,并揭示了高危突变的致病机制及潜在的治疗策略。研究明确了诊断年龄和MRD水平对患者预后的关键作用,并揭示了高危患儿STAG2失活对染色质结构和基因表达具有深远影响。
更重要的是,本研究提出了 PARP 抑制剂等可做为靶向 STAG2/LMO2 亚型的潜在治疗策略,这些成果加深了对儿童γδ T-ALL的认识,也为未来γδ T-ALL患儿的风险分层和个体化治疗开发提供了重要参考。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#T-ALL# #急性T淋巴细胞白血病#
12