Nature Medicine:CAR T治疗T细胞急淋白血病显现希望!
2024-11-26 儿童肿瘤前沿 儿童肿瘤前沿 发表于陕西省
新加坡和意大利团队开发抗CD7蛋白表达阻断剂,用于制造CART细胞治疗T-ALL。研究报告17例患者治疗情况,安全性和有效性与B-ALL的CART治疗相当,为治疗T-ALL带来希望。
T细胞急性淋巴细胞白血病(T-ALL)是儿童中最常见的癌症——急性淋巴细胞白血病(ALL)的一个亚型。T-ALL起源于T细胞前体的致癌转化,占儿童ALL病例的约10%,以及青少年和年轻成人病例的25-30%。与B细胞ALL相比,T-ALL具有更高比例的预后不良特征,并且在大多数治疗方案下效果较差。复发或难治性B细胞ALL患者的治疗因靶向B细胞标志物CD19的嵌合抗原受体(CAR)的开发而出现了革命性变化,这种疗法将T淋巴细胞转变为强大的抗白血病武器,也就是CAR T细胞,已经成为B-ALL的有效治疗方案。然而,由于T-ALL通常缺乏B-ALL里CD19或CD22这些标志性抗原的表达,针对T-ALL的细胞治疗发展相对滞后。
CD7是一种的I型跨膜糖蛋白,在几乎所有T-ALL病例中均有高度表达。然而,CD7也在正常T淋巴细胞中表达,包括CAR T细胞。因此,抗CD7 CAR的表达会触发自身细胞毒性(即自相残杀),这生产可靠CAR T细胞的关键障碍。为解决这一问题,一个新加坡和意大利科学家组成的联合研究团队开发了一种抗CD7蛋白表达阻断剂(PEBL),它允许合成CD7,但将其保留在细胞内,防止其在细胞膜上表达,从而避免自相残杀。抗CD7 PEBL消除了CD7的表面表达,但对T细胞功能没有明显影响。
近期,该研究团队在 Nature Medicine 上发表了题为 Fratricide-resistant CD7-CAR T cells in T-ALL 的论文,报告了17例接受自体抗CD7 PEBL-CAR T细胞治疗的T-ALL患者的结果。研究人员将抗CD7 PEBL-CAR T细胞的特性与为20例B细胞ALL患者制造的抗CD19 CAR T细胞进行了比较,发现这种CAR T治疗在T-ALL患者中安全性、有效性与B-ALL的CAR T治疗相当,显示了未来治疗复发/耐药型T-ALL的希望。

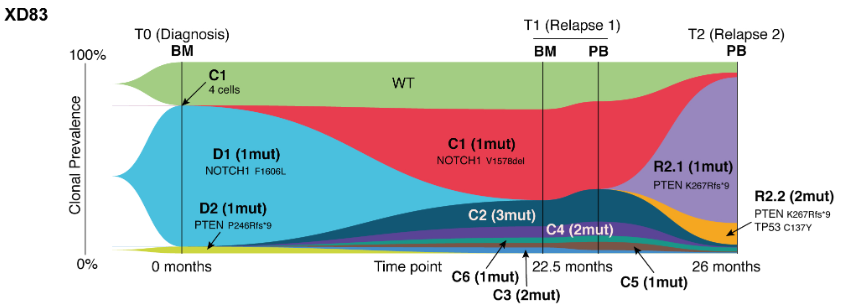
从2019年4月24日至2023年10月6日,研究人员筛选了20例复发或难治性T-ALL患者以评估其是否适合接受抗CD7 PEBL-CAR T细胞治疗。其中两名患者(18岁和7岁)通过化疗实现了微小残留病(MRD)阴性的完全缓解(CR),随后接受了造血干细胞移植(HSCT);另一名患者(16岁)在接受CAR T细胞输注前因病情进展死亡。这篇论文报告了其余接受抗CD7 PEBL-CAR T细胞治疗的17例患者的病例。
研究人员通过一个双顺反子伽玛逆转录病毒载体同时表达抗CD7 PEBL和抗CD7 4-1BB–CD3ζ CAR基因,产生的CAR T细胞比例中位数为96.7%(89.1%-99.1%)。该比例显著高于使用类似载体为B细胞ALL患者制造的20个抗CD19 CAR T细胞产品。两组患者的T细胞扩增相似,表明非转导的CD7+ T细胞的清除与CAR驱动的T细胞增殖共同促进了抗CD7 PEBL-CAR T细胞的富集。所有17个起始细胞产品中均含有白血病细胞(0.01%-60.3%;中位数1.35%),但在生产好的CAR T细胞成品里均未检测到可存活的白血病细胞。
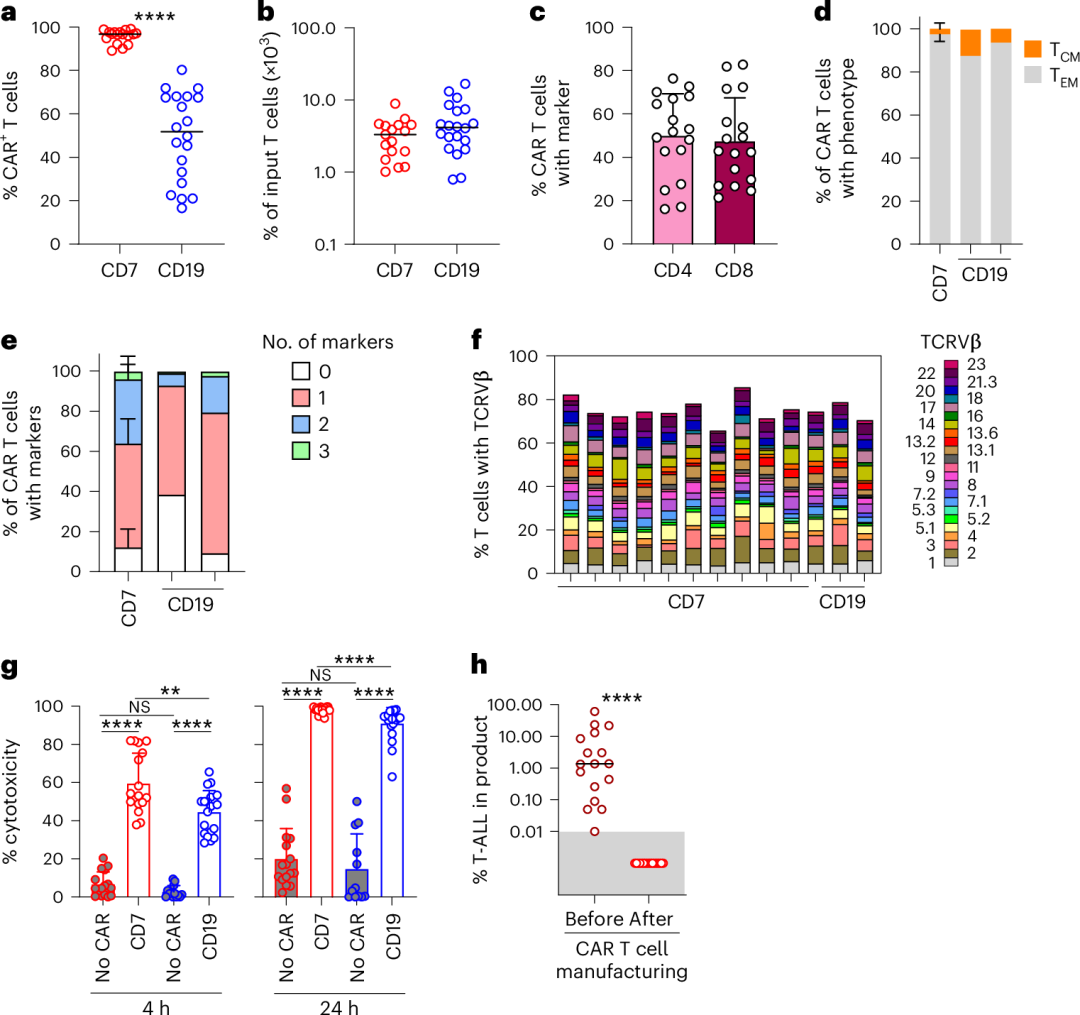
附图. CAR T细胞的特征分析
输注CAR T细胞后,所有17名患者的外周血中均能检测到输注的细胞。输注后1个月,CD8+ CAR T细胞通常占主导地位。其中一名患者的CD4和CD8表达在多个时间点被检测,持续时间最长达220天,但CD8表达始终占主导地位。
该病例系列的首位患者中,CAR T细胞的长期持续性评估最长达输注后48个月(该患者未接受HSCT巩固)。流式细胞术显示CAR T细胞可持续检测至18个月,但在24个月和48个月的两次外周血样本中未再检测到。ddPCR的结果与流式细胞术一致,但在24个月时仍可检测到信号,48个月时消失。总体而言,该患者中CAR T细胞的长期持续性与B细胞ALL组中的抗CD19 CAR T细胞相当。
17名患者均未出现3级或更高级的细胞因子释放综合征(CRS);10名患者发生了1级CRS,3名患者发生了2级CRS。CRS的中位发生时间为5天(范围3-8天),中位持续时间为2天(范围1-7天)。仅两名患者出现了1级的免疫效应细胞相关神经毒性综合征(ICANS)。所有患者在输注后30天内均出现了2级或更高级的免疫效应细胞相关血液毒性(ICAHT),但无一需要转入重症监护。总体而言,CD7 PEBL-CAR T细胞的治疗相关毒性与CD19 CAR T类似。
输注前16名患者的骨髓中检测到白血病细胞(中位数14.1%;范围0.01%-77.9%),外周血中也有检测(中位数5.0%;范围0.03%-84.1%)。另1名患者在桥接化疗后为MRD阴性,但PET-CT显示纵隔仍有残余病变。在输注CAR T后的一个月内,16名患者在骨髓和外周血中均达到MRD阴性(CR),且影像学检查显示缓解。
与CD19 CAR T治疗相比,虽然该研究中T-ALL患者们病情更严重,但CD7 PEBL-CAR T获得的MRD响应率类似。
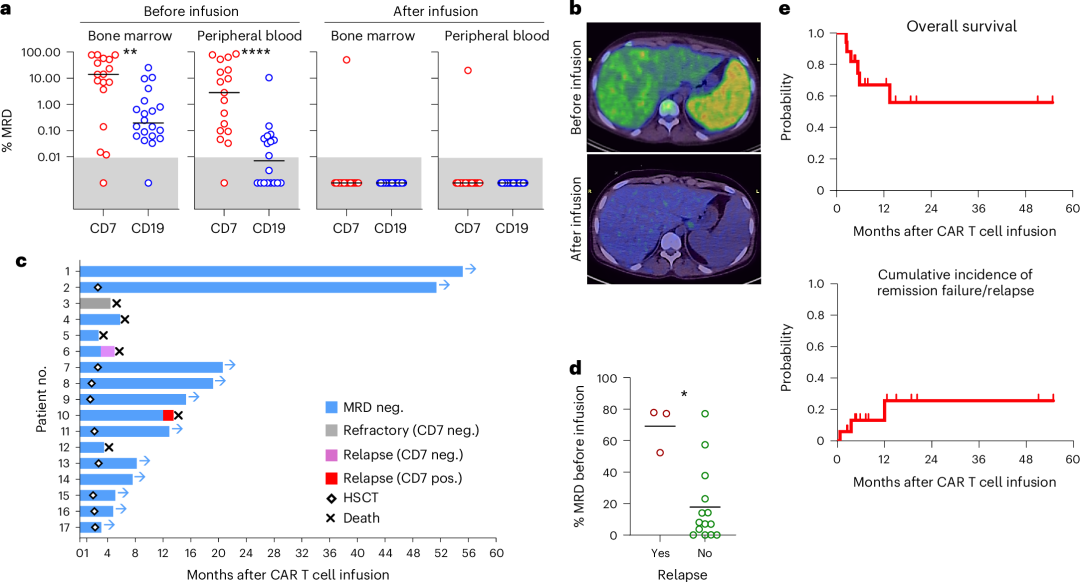
附图. CD7 PEBL-CAR T细胞治疗的效果
截至2024年3月15日,CAR T细胞输注后3-55个月(中位数15个月),11名患者仍存活且无白血病。与未接受CAR T细胞治疗的复发或难治性T-ALL患者的历史队列相比,这些患者的治疗结果显著改善。
对于针对T-ALL的CAR T治疗来说,一种担忧是如果抗CD7 PEBL-CAR T细胞能够杀伤T-ALL肿瘤细胞,它们可能也会抑制淋巴细胞清除后正常T和自然杀伤(NK)细胞的重建(两者均表达CD7)。但在接受抗CD7 PEBL-CAR T细胞治疗的患者中,T细胞和NK细胞均可恢复,不过恢复率通常低于接受抗CD19 CAR T细胞的患者。值得注意的是,恢复的T细胞和NK细胞缺乏CD7表达,因此能够逃避免疫攻击。再生的T细胞呈多克隆性。输注后1个月,非CAR T细胞表现为记忆表型,在所有样本中均可检测到TSCM、TCM和TEM细胞。CD4+和CD8+非CAR T细胞的比例变化较大,类似于B细胞ALL患者。
上述结果表明,自体抗CD7 PEBL-CAR T细胞具有强大的抗白血病活性,是治疗T-ALL的潜在有效选择。这也意味着抗CD7 PEBL-CAR T细胞能够克服限制当前复发或难治性T-ALL治疗的耐药机制,为患者带来希望。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













T-ALL治疗新方案
6
#T-ALL# #CAR T治疗#
10