斯坦福大学高小井Nature大子刊:一种基于RNA编辑的新型后转录合成受体平台
2025-03-31 BioMed科技 BioMed科技
斯坦福大学开发基于后转录调控的 LIDAR 合成受体平台,利用 RNA 编辑技术精确调控细胞行为,具备 RNA 兼容性,为细胞工程和生物医学研究提供新工具。
细胞通过表面受体感知信号分子来调节自身行为,如增殖、分化、迁移和凋亡,这对维持组织稳态和生理功能至关重要。科学家开发了合成受体,通过基因工程设计膜蛋白,可感知特定信号并产生定制化响应,成为细胞工程的重要工具。但目前多数合成受体依赖转录激活机制,存在细胞内转录调控限制、过程复杂、引入额外调控及延迟等问题,且主要通过DNA载体传递,可能引发插入突变等风险,限制其在某些应用中的效率和适用性。近年来,后转录调控机制如RNA编辑、mRNA稳定性调控和翻译起始调控等受到关注。RNA编辑是后转录修饰过程,通过化学修饰改变mRNA碱基序列,影响蛋白质翻译。腺苷脱氨酶作用于RNA(ADAR)可将腺苷(A)编辑为肌苷(I),翻译时被识别为鸟苷(G)。RNA编辑技术因独立酶促反应特性,成为开发新型合成受体的潜在后转录调控机制。
斯坦福大学高小井等人提出开发一种基于后转录调控的合成受体平台——LIDAR。该平台利用RNA编辑技术,通过配体诱导的二聚化激活RNA编辑,从而实现对细胞行为的精确调控。LIDAR平台的一个重要特点是其RNA兼容性。与传统的DNA载体相比,RNA载体(如mRNA)具有更高的安全性和灵活性,能够避免插入突变的风险,并且可以实现更快速的表达。相关内容以“Post-transcriptional modular synthetic receptors”为题发表在《Nature Chemical Biology》上。

【主要内容】
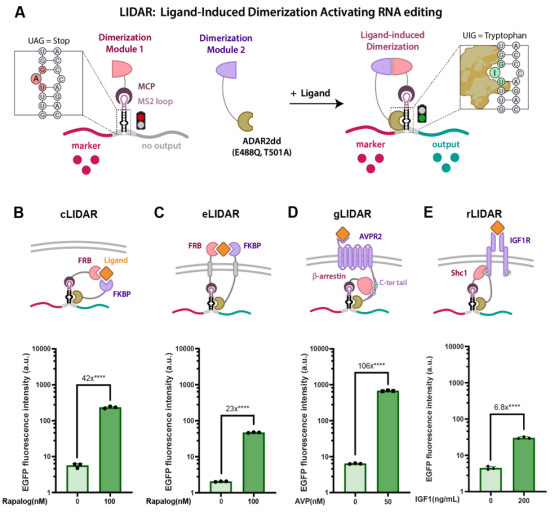
图1 LIDAR平台的设计原理
LIDAR是一种基于后转录调控的合成受体,由三个主要组件构成:两个可定制的二聚化结构域(一个与ADAR2dd融合,另一个与RNA结合蛋白RBP融合),以及一个含有多个RBP招募序列和一个双链区域内的终止密码子(UAG)的报告RNA分子。当特定配体存在时,两个二聚化结构域结合,使ADAR2dd靠近报告RNA,将终止密码子编辑为色氨酸密码子(UGG),从而翻译下游负载。图中还展示了LIDAR平台在不同受体架构中的应用,包括基于细胞质结合剂的cLIDAR、基于细胞外结合剂的eLIDAR、基于G蛋白偶联受体的gLIDAR和基于受体酪氨酸激酶的rLIDAR,验证了其在不同细胞环境中的适用性和功能性输出。
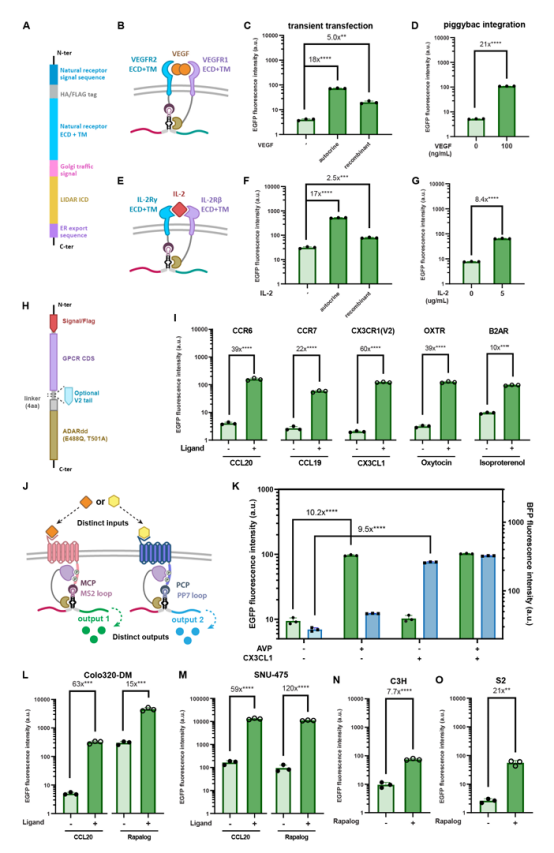
图2 LIDAR的分子和细胞多功能性
作者通过构建不同的eLIDAR和gLIDAR,证明了LIDAR能够感知多种配体(如VEGF、IL-2、CCL20等),并产生相应的荧光信号输出。此外,还展示了gLIDAR在不同G蛋白偶联受体(GPCR)中的应用,以及通过设计正交的GPCR-LIDAR(oLIDAR)实现单细胞中多个受体的正交响应。图中还验证了LIDAR在不同细胞系(如人类胚胎肾细胞、结肠癌细胞、肝癌细胞、小鼠胚胎成纤维细胞和果蝇细胞)中的稳健性,表明其在多种细胞环境中的适用性。
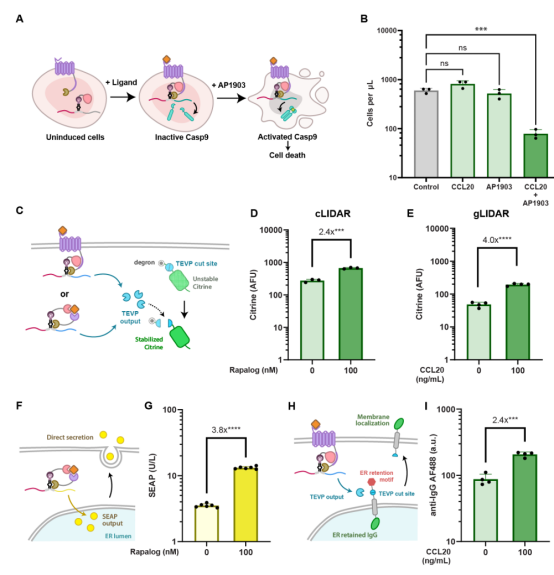
图3 LIDAR的功能性输出
作者利用gLIDAR实现了多种功能性输出,包括诱导细胞凋亡(通过表达iCASP9)、控制蛋白稳定性(通过输出TEV蛋白酶)以及分泌蛋白(如SEAP和膜结合IgG)。这些实验结果表明,LIDAR不仅能够产生荧光信号,还能够驱动复杂的细胞行为和功。
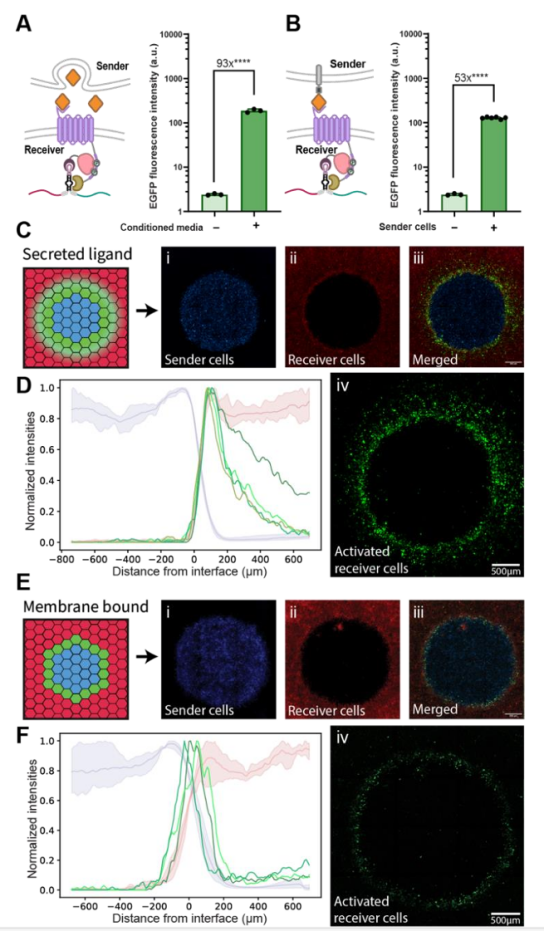
图4 LIDAR用于细胞间通讯和空间模式形成
作者通过共培养实验,证明了LIDAR能够感知其他细胞分泌的可溶性配体或膜结合配体,并据此产生响应。此外,通过将分泌配体的细胞和表达LIDAR的细胞以特定模式共培养,作者成功地在细胞群体中形成了空间模式。这些实验结果表明,LIDAR可以用于编程复杂的多细胞行为,例如细胞间通讯和组织模式形成。
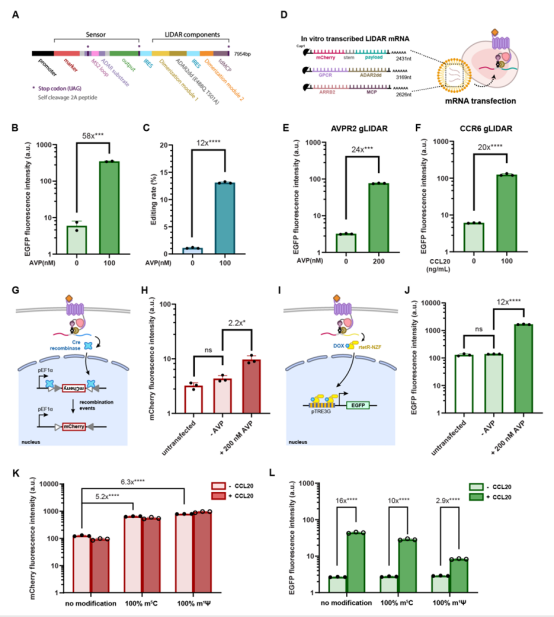
图5 LIDAR的编码和RNA兼容性
作者展示了LIDAR可以被编码为单个转录本,并通过内部核糖体进入位点(IRES)实现多个组件的共表达。此外,作者还通过体外转录(IVT)将LIDAR组件制备为mRNA,并成功地实现了mRNA递送的LIDAR功能。
【全文总结】
LIDAR平台不仅丰富了合成受体的种类,还为细胞工程和生物医学研究提供了一种新的工具。其后转录调控机制和RNA兼容性使其在基础研究和治疗应用中具有广阔的应用前景,例如在癌症治疗、组织工程和神经科学等领域。未来的研究将进一步优化LIDAR平台的性能,探索其在更多生物医学应用中的潜力。
原文链接:
https://doi.org/10.1038/s41589-025-01872-w

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#合成受体# #后转录调控#
18