论著|NSUN2基因敲除对PC12细胞分化和凋亡的影响研究
2025-02-02 中国神经精神疾病杂志 中国神经精神疾病杂志 发表于陕西省
本研究揭示了NSUN2在PC12细胞分化、神经递质调控、细胞钙离子浓度变化、细胞周期调控及氧化应激反应中的重要作用。
摘 要
目的研究NOP2/Sun RNA甲基转移酶2(NOP2/Sun RNA methyltransferase 2, NSUN2)基因在PC12细胞分化和凋亡等功能中的作用,以探索NSUN2基因在神经系统发育过程中的功能。
方法将神经生长因子诱导分化的PC12细胞分为敲除NSUN2 PC12细胞诱导分化组(NSUN2-KO组)和PC12细胞正常细胞诱导分化组(NSUN2组)。采用免疫荧光法检测各组PC12细胞的神经元特征;酶联免疫吸附试验检测细胞神经递质含量;激光共聚焦及流式细胞学检测细胞内钙离子内流;氮蓝四唑法检测超氧化物歧化酶活性;硫代巴比妥酸法检测丙二醛含量;细胞计数试剂盒-8法检测细胞增殖情况;流式细胞术检测细胞周期及细胞凋亡。
结果NSUN2-KO组PC12细胞诱导分化后细胞突触减少、变短(神经元特异性烯醇化酶灰度值44.26 vs. 63.21, P=0.002;神经丝蛋白10.12 vs. 33.63, P<0.001)。NSUN2-KO组释放的天冬氨酸(618.83 nmol/L vs. 372.38 nmol/L, P<0.001)、谷氨酸(880.45 nmol/L vs. 525.17 nmol/L,P<0.001)等兴奋性神经递质较NSUN2组增加,而甘氨酸(197.40 nmol/L vs. 286.15 nmol/L, P<0.001)、γ-氨基丁酸(134.91 nmol/L vs. 208.25 nmol/L, P<0.001)等抑制性神经递质较NSUN2组减少。NSUN2-KO组细胞内的钙离子荧光强度值较NSUN2组增加(51319.70 vs. 24546.06, P<0.001)。NSUN2-KO组细胞较NSUN2组G1期延长(73.38% vs. 68.48%, P<0.001),G2期缩短(14.69% vs. 16.99%, P=0.008),S期缩短(11.92% vs. 14.52%, P=0.002)。NSUN2-KO组细胞较NSUN2组细胞氧化应激水平升高(超氧化物歧化酶活性11.05 U/mgprot vs. 21.59 U/mgprot, P=0.002;丙二醛含量1.42 nmol/mgprot vs. 0.80 nmol/mgprot, P=0.008)。NSUN2-KO组细胞较NSUN2组细胞凋亡增多(21.55% vs. 10.53%, P<0.001)。
结论敲除NSUN2基因使神经生长因子诱导的PC12细胞突触减少、变短,释放兴奋性神经递质的能力增强,细胞毒性增强,细胞活力减低,并促进细胞凋亡,表明NSUN2基因可能是神经元增殖分化并维持其形态与功能的重要神经保护因子。
关键词
NSUN2;基因编辑;基因敲除;智力障碍;PC12细胞;细胞分化;细胞凋亡;神经系统发育
智力障碍(intellectual disability, ID)是一种神经发育障碍,通常在发育时期出现,主要表现为智力功能和适应性行为的显著障碍[1],人群患病率约1%~3%[2],是导致儿童终身残疾的主要原因之一[3],目前暂无可以治疗ID的特效药物,主要以认知行为干预为主[4],给家庭和社会带来沉重负担。ID发病机制尚不清楚[5-6],病例报告研究显示[7-12],NOP2/Sun RNA甲基转移酶2(NOP2/Sun RNA methyltransferase 2, NSUN2)基因变异可以引起家系ID,并呈常染色体隐性遗传。NSUN2基因变异导致的ID患者在临床表现上,除智力障碍外,还存在语言发育迟缓、步态异常、特殊面容、皮肤异常以及身材矮小等,但NSUN2基因调控神经发育的机制研究较少。本研究拟在细胞水平研究NSUN2基因对PC12细胞的神经保护机制。
1 材料与方法
1.1 研究材料
PC12 细胞购于中国科学院上海细胞库。敲除NSUN2的PC12细胞模型从重庆威斯腾生物医药科技有限责任公司(中国)购买。将重组质粒PX459-gRNA转染PC12细胞获得的敲除单克隆细胞作为NSUN2-KO组,而正常诱导分化细胞为NSUN2组。两组PC12细胞用神经生长因子(nerve growth factor,NGF)诱导分化,均提前将培养板用多聚赖氨酸包被,将培养的细胞消化成单细胞悬液后,采用1500 r/min转速离心3 min获得沉淀,用含1%DHS和100 ng/mL β-NGF的培养基重悬计数,调整细胞浓度为1×105个/mL,接种于6孔培养板中,每2 d更换培养基,诱导分化14 d后收集样本。
1.2 研究方法
1.2.1 神经元特征检测 利用免疫荧光染色方法检测细胞诱导分化后神经元特异性烯醇化酶(neuron-specific enolase, NSE)和神经丝蛋白(neurofilament protein, NF)的表达。两组PC12细胞爬片后,浸洗3次进行通透(0.5% TritonX-100,室温),再次1×PBS浸洗3次,随后在一抗NSE(1∶100稀释比例)、NF(1∶300稀释比例)常温孵育90 min;然后,将经稀释的双抗绵羊抗体(按1∶800)逐次加入,置于湿润培养箱中,二抗孵育60 min;在此基础上,加入4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色液经避光孵育5 min,将样品染色成核,再用荧光抑制剂封片,用激光共聚焦显微镜观测并收集影像,测定灰度值。
1.2.2 神经递质的含量测定 采用双抗体一步夹心法酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)。往预先包被神经递质抗体的包被微孔中,依次加入标本、标准品、辣根过氧化物酶(HRP)标记的检测抗体,经过温育并彻底洗涤。用酶标仪测定吸光度(OD值),并计算天冬氨酸(aspartic acid,Asp)、谷氨酸(glutamic acid,Glu)、甘氨酸(glycine,Gly)、γ-氨基丁酸(γ-aminobutyric acid,GABA)的含量。
1.2.3 细胞内钙离子浓度测定 用含有0.5~5 μmol/L的Fluo-3 AM溶液和诱导分化后的细胞一起在20~37 ℃孵育15~60 min进行荧光探针装载,并适当洗涤,随后对两组细胞进行流式和激光共聚焦检测,激发波长和发射波长分别为488 nm和526 nm,获得荧光强度值和激光共聚焦结果。
1.2.4 细胞周期的检测 两组细胞内的DNA被碘化丙啶染色后,用流式细胞仪(flow cytometry,FCM)在激发波长488 nm处检测红色荧光,对细胞进行DNA含量测定,然后根据DNA含量的分布情况,进行细胞周期的分析。
1.2.5 细胞氧化应激水平的测定
采用氮蓝四唑(nitro blue tetrazolium, NBT)法,酶标仪波长设定在562 nm,对两组细胞进行超氧化物歧化酶(superoxide dismutase,SOD)活性检测;采用硫代巴比妥酸(thiobarbituric acid,TBA)法,酶标仪波长设定在530 nm,检测丙二醛(malondialdehyde,MDA)含量。
1.2.6 细胞增殖的测定
采用细胞计数试剂盒-8(C0039,上海碧云天生物技术股份有限公司)法,同时设定酶标仪在450 nm波长处测定OD值,检测两组细胞活力。
1.2.7 细胞凋亡的测定
采用实时qPCR(RT-qPCR)检测Caspase-3和Bcl-2表达水平,按照Hifair试剂使用说明书提取各组PC12细胞总RNA,分光光度计法测定其浓度后置于-20 ℃冰箱保存,并参照试剂盒(AP101,杭州联科生物技术股份有限公司)说明书进行测定。
1.3 统计学方法 数据采用SPSS 23.0进行统计学分析。计量资料以x±s表示,两组间比较采用独立样本t检验。检验水准α=0.05,双侧检验。
2 结果
2.1 细胞单克隆敲除检测 对构建好的稳定敲除细胞株收集DNA进行Sanger测序,结果38号克隆与原细胞株系列比对,发现其插入了1个碱基T,造成移码突变,见图1,表明利用CRISPR/Cas9技术成功敲除NSUN2基因,获得敲除NSUN2基因的PC12细胞,可作为敲除细胞进行实验。
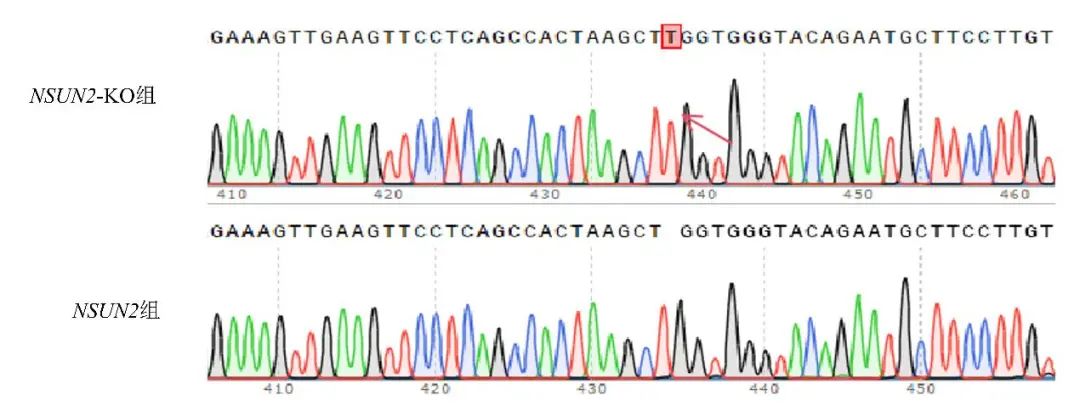
图1 NSUN2基因敲除细胞系提取DNA的Sanger测序结果 注:38号克隆与原细胞株序列比对,插入了1个碱基T,造成移码突变。Fig.1 Screening and identification of NSUN2 knockout PC12 cells by Sanger sequencing
2.2 NSUN2基因对细胞分化的影响 与NSUN2组相比,NSUN2-KO组的PC12细胞经NGF诱导分化后,NSE表达水平下降(t=-7.715,P=0.002),NF表达水平降低(t=-14.414,P<0.001),差异有统计学意义。见表1和图2。
表1 两组细胞神经生物学特征的比较Tab.1 Comparison of neurobiological characteristics between the two groups
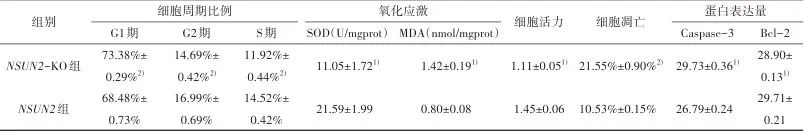
注:NSE,神经元特异性烯醇化酶;NF,神经丝蛋白;Asp,天冬氨酸;Glu,谷氨酸;Gly,甘氨酸;GABA,γ-氨基丁酸;SOD,超氧化物歧化酶;MDA,丙二醛。1)与对照组比较,经独立样本t检验,P<0.05。
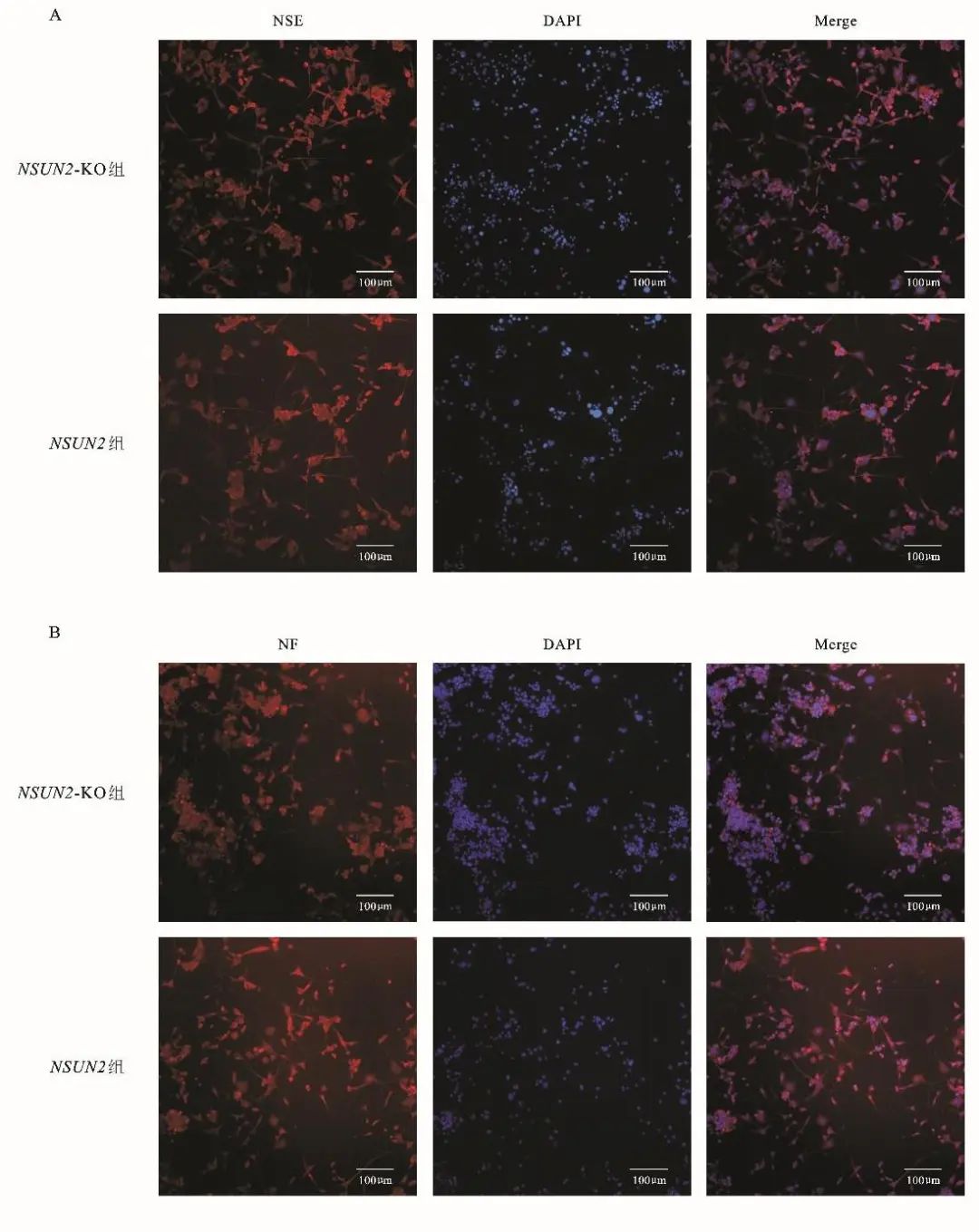
图2 两组神经元特异标志的比较 A. NSUN2-KO组处理后,免疫荧光检测NSE(红色)在细胞内的分布,DAPI(蓝色)指示细胞核。比例尺100 μm。B. NSUN2-KO处理后,免疫荧光检测NF(红色)在细胞内的分布,DAPI(蓝色)指示细胞核。比例尺100 μm。NSE,神经元特异性烯醇化酶;NF,神经丝蛋白。Fig.2 Comparison between the two groups of neuron-specific markers
2.3 NSUN2基因对神经递质的影响 NSUN2-KO组较NSUN2组,兴奋性神经递质Asp(t=11.006,P<0.001)、Glu(t=8.673,P<0.001)均增加,而抑制性神经递质Gly(t=-13.619,P<0.001)、GABA(t=-14.752,P<0.001)均减少,差异有统计学意义。见表1。
2.4 NSUN2基因对细胞钙内流的影响 与NSUN2组相比,NSUN2-KO组细胞内的钙离子荧光强度值升高(t=42.084,P<0.001),差异有统计学意义,见表1。激光共聚焦结果同样提示NGF诱导后,NSUN2-KO组细胞钙内流明显增强。见图3。
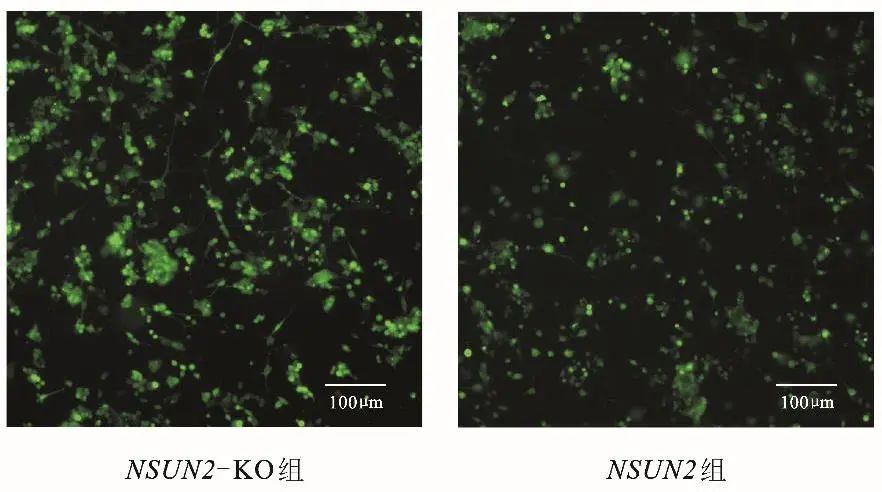
图3 两组钙离子含量激光共聚焦检测结果 注:Fluo-3和钙离子结合后可以产生较强的荧光。Fig.3 Comparison of calcium concentrations between the two groups
2.5 NSUN2基因对细胞周期的影响 流式细胞术检测细胞周期结果见图4。与NSUN2组相比,NSUN2-KO组G1期延长(t=10.707,P<0.001),G2期(t=-4.942,P=0.008)和S期(t=-7.357,P=0.002)缩短,差异有统计学意义。见表1。
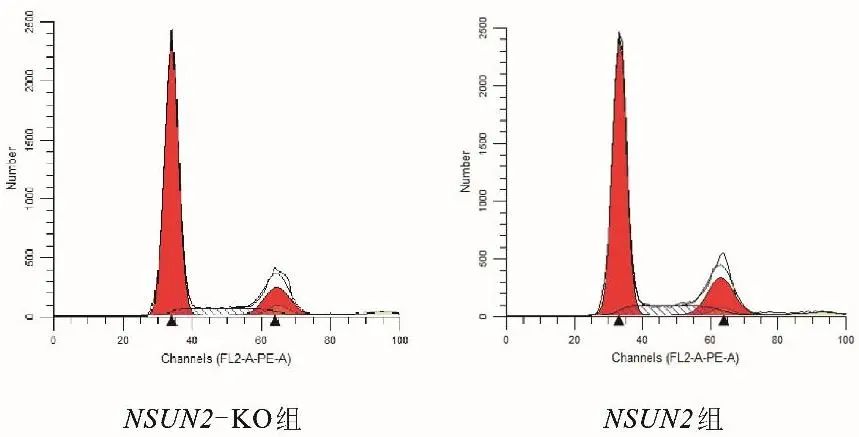
图4 两组细胞周期检测的流式图 注:图中第一个峰为G1期,第二个峰为S期,第三个峰为G2期。Fig.4 Flow cytometric analysis of two sets of cell cycle detection
2.6 NSUN2基因对细胞氧化应激的影响 与NSUN2组相比,NSUN2-KO组的SOD活性降低(t=-6.937,P=0.002),而MDA含量升高(t=4.986,P=0.008),差异有统计学意义。见表1。
2.7 NSUN2基因对细胞增殖的影响 与NSUN2组相比,NSUN2-KO组的细胞活力下降(t=-11.532,P<0.001),差异有统计学意义。见表1。
2.8 NSUN2基因对细胞凋亡的影响 采用流式细胞术检测细胞凋亡的结果显示,与NSUN2组相比,NSUN2-KO组Q1-UR晚期凋亡象限和Q1-LR早期凋亡象限细胞增加,见图5。qPCR进一步检测Caspase-3和Bcl-2表达量,结果提示,与NSUN2组相比,NGF刺激后NSUN2-KO组Caspase-3升高(t=19.871,P<0.001),Bcl-2表达减少(t=-9.543,P<0.001),差异有统计学意义。见表1。
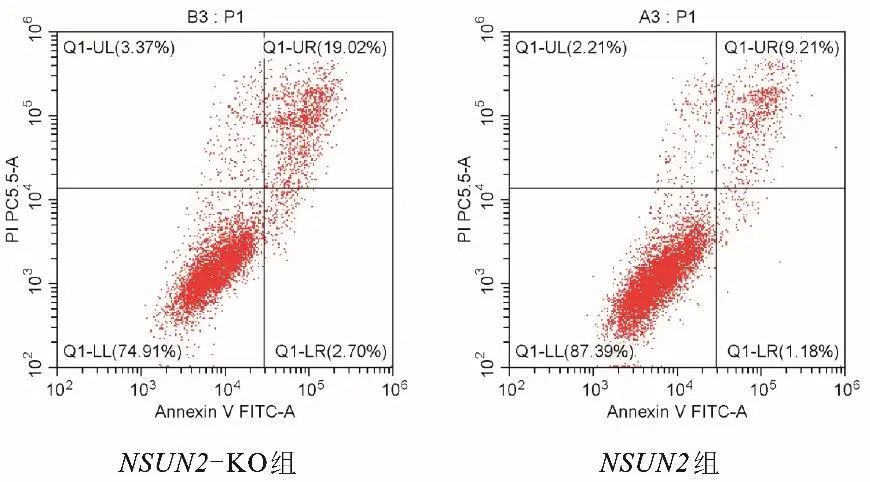
图5 两组流式细胞检测凋亡的结果 注:Q1-UL区域表示坏死细胞,Q1-UR表示晚期凋亡细胞,Q1-LR区域表示早期凋亡细胞,Q1-LL区域表示未发生凋亡的细胞。Fig.5 Comparation of flow cytometry detection of cell apoptosis
3 讨论
本研究首次系统地探讨了NSUN2基因敲除对PC12细胞分化和凋亡等生物学行为的影响。结果表明,NSUN2基因在神经细胞分化、神经递质调控、钙内流、细胞周期、氧化应激及细胞凋亡等多个生物学过程中发挥重要调控作用。NSUN2基因的缺失导致神经元增殖能力下降,分化受阻[13],神经递质释放紊乱,凋亡增加,可能通过调节特定基因的表达抑制NGF诱导PC12细胞向神经元分化[14],进而影响神经系统发育,参与智力障碍等神经系统疾病的发生[15-16]。
NSUN2基因位于5 p15.31号染色体19号外显子,属于NOP2/SUN RNA甲基化修饰酶[17]。NSUN2基因介导的m5C修饰对于维持细胞功能非常重要,尤其是神经系统[18-19]。既往研究提示,Nsun2基因敲低的果蝇出现严重的短时记忆缺陷[20],可能与NSUN2基因对维持神经干细胞分化[21-22]、突触功能[23]有关。本研究同样发现,敲除NSUN2基因降低NGF诱导PC12细胞向神经元分化的能力,并进一步影响细胞周期,尤其是G1期的延长,提示NSUN2基因对维持神经元分化[24]、成熟有重要作用。与既往研究相似,本研究表明NSUN2在调节神经递质平衡方面也具有重要意义。本研究表明,NSUN2基因缺失导致兴奋性神经递质如Asp和Glu水平增加,同时抑制性神经递质如Gly和GABA水平下降。这一结果提示NSUN2可能在神经信号传递的调控中发挥重要作用[25],并影响神经网络的功能[26]。动物模型中,条件性敲除小鼠前额叶皮质神经元的Nsun2基因,小鼠表现出抑郁等行为异常[27]。进一步的电生理研究发现,缺失Nsun2基因的小鼠前额叶皮质神经元甘氨酸的表达异常增加。甘氨酸不仅是重要的神经递质[28-29],且参与谷胱甘肽的合成[30],后者是细胞内抗氧化物的重要成分。NSUN2基因缺失导致神经递质的表达紊乱[31],最终导致神经元凋亡增加。本研究在细胞水平证实NSUN2基因在维持神经元正常的分化、抗氧化能力方面起到重要作用,对减少细胞凋亡、维持细胞增殖等方面具有重要影响。
本研究的局限性主要体现在几个方面。首先,本研究尚未通过设计实验深入探讨NSUN2在细胞分化过程中的具体分子机制,这限制了对其功能的全面理解,未来的研究可以通过RNA测序和蛋白质组学分析,深入探讨NSUN2基因调控的下游信号通路及其在神经系统疾病中的作用。其次,缺乏临床验证分析,使得本研究结果无法直接应用于临床场景,未来需扩展样本量并纳入临床样本进行验证,增强结果的临床相关性。
综上所述,本研究揭示了NSUN2在PC12细胞分化、神经递质调控、细胞钙离子浓度变化、细胞周期调控及氧化应激反应中的重要作用。这些发现为理解神经元发育和功能的基本生物学过程提供了新的视角,并为未来针对神经系统疾病的治疗策略开发奠定了理论基础。未来的研究应着重于阐明NSUN2的具体作用机制及其在其他类型神经细胞中的功能,以推动神经生物学研究的深入发展。
参考文献:
1. SIEGEL M, MCGUIRE K, VEENSTRA-VANDERWEELE J, et al. Practice parameter for the assessment and treatment of psychiatric disorders in children and adolescents with intellectual disability (intellectual developmental disorder)[J]. J Am Acad Child Adolesc Psychiatry, 2020, 59(4): 468-496.
2. ANDERSON L L, LARSON S A, MAPELLENTZ S, et al. A systematic review of U.S. studies on the prevalence of intellectual or developmental disabilities since 2000[J]. Intellect Dev Disabil, 2019, 57(5): 421-438.
3. PURUGGANAN O. Intellectual disabilities[J]. Pediatr Rev, 2018, 39(6): 299-309.
4. MACDONALD S, SUMMERS S J. Psychosocial interventions for people with intellectual disabilities and dementia: A systematic review[J]. J Appl Res Intellect Disabil, 2020, 33(5): 839-855.
5. CVETKOVSKA V, BAGOT R C. Ophn1 regulation of prefrontal inhibition: A mechanism for stress susceptibility in intellectual disability[J]. Neuron, 2021, 109(10): 1583-1584.
6. SANCHEZ-LUQUEZ K Y, CARPENA M X, KARAM S M, et al. The contribution of whole-exome sequencing to intellectual disability diagnosis and knowledge of underlying molecular mechanisms: A systematic review and meta-analysis[J]. Mutat Res Rev Mutat Res, 2022, 790: 108428.
7. KOMARA M, AL-SHAMSI A M, BEN-SALEM S, et al. A novel single-nucleotide deletion (c.1020delA) in NSUN2 causes intellectual disability in an emirati child[J]. J Mol Neurosci, 2015, 57(3): 393-399.
8. YANG Q, ZHANG Q, QIN Z, et al. A novel variant in NSUN2 causes intellectual disability in a Chinese family[J]. BMC Med Genomics, 2024, 17(1): 95.
9. MUHAMMAD N, HUSSAIN S I, REHMAN Z U, et al. Autosomal recessive variants c.953A>C and c.97-1G>C in NSUN2 causing intellectual disability: A molecular dynamics simulation study of loss-of-function mechanisms[J]. Front Neurol, 2023, 14: 1168307.
10. SUN S, CHEN L, WANG Y, et al. Further delineation of autosomal recessive intellectual disability syndrome caused by homozygous variant of the NSUN2 gene in a chinese pedigree[J]. Mol Genet Genomic Med, 2020, 8(12): e1518.
11. PINGREE G, HARPER A, SNAJCZUK J, et al. Eye manifestations in the NSUN2 intellectual disability syndrome[J]. Int J Mol Epidemiol Genet, 2021, 12(6): 129-134.
12. KATO K, MIZUNO S, MORTON J, et al. Expanding the phenotype of biallelic loss-of-function variants in the NSUN2 gene: Description of four individuals with juvenile cataract, chronic nephritis, or brain anomaly as novel complications[J]. Am J Med Genet A, 2021, 185(1): 282-285.
13. BLANCO S, DIETMANN S, FLORES J V, et al. Aberrant methylation of tRNAs links cellular stress to neuro-developmental disorders[J]. EMBO J, 2014, 33(18): 2020-2039.
14. BLANCO S, BANDIERA R, POPIS M, et al. Stem cell function and stress response are controlled by protein synthesis[J]. Nature, 2016, 534(7607): 335-340.
15. KIM Y A, SIDDIQUI T, BLAZE J, et al. RNA methyltransferase NSun2 deficiency promotes neurodegeneration through epitranscriptomic regulation of tau phosphorylation[J]. Acta Neuropathol, 2023, 145(1): 29-48.
16. MATTIOLI F, WORPENBERG L, LI C T, et al. Biallelic variants in NSUN6 cause an autosomal recessive neurodevelopmental disorder[J]. Genet Med, 2023, 25(9): 100900.
17. Van HAUTE L, LEE S Y, MCCANN B J, et al. NSUN2 introduces 5-methylcytosines in mammalian mitochondrial tRNAs[J]. Nucleic Acids Res, 2019, 47(16): 8720-8733.
18. SUN Z, XUE S, XU H, et al. Effects of NSUN2 deficiency on the mRNA 5-methylcytosine modification and gene expression profile in HEK293 cells[J]. Epigenomics, 2019, 11(4): 439-453.
19. HUSSAIN S, SAJINI A A, BLANCO S, et al. NSun2-mediated cytosine-5 methylation of vault noncoding RNA determines its processing into regulatory small RNAs[J]. Cell Rep, 2013, 4(2): 255-261.
20. YANG X, YANG Y, SUN B F, et al. 5-methylcytosine promotes mRNA export - NSUN2 as the methyltransferase and ALYREF as an m5C reader[J]. Cell Res, 2017, 27(5): 606-625.
21. FLORES J V, CORDERO-ESPINOZA L, OEZTUERK-WINDER F, et al. Cytosine-5 RNA methylation regulates neural stem cell differentiation and motility[J]. Stem Cell Reports, 2017, 8(1): 112-124.
22. SUN Z, XUE S, ZHANG M, et al. Aberrant NSUN2-mediated m5C modification of H19 lncRNA is associated with poor differentiation of hepatocellular carcinoma[J]. Oncogene, 2020, 39(45): 6906-6919.
23. SHINODA S, KITAGAWA S, NAKAGAWA S, et al. Mammalian NSUN2 introduces 5-methylcytidines into mitochondrial tRNAs[J]. Nucleic Acids Res, 2019, 47(16): 8734-8745.
24. OKAMOTO M, HIRATA S, SATO S, et al. Frequent increased gene copy number and high protein expression of tRNA (cytosine-5-)-methyltransferase (NSUN2) in human cancers[J]. DNA Cell Biol, 2012, 31(5): 660-671.
25. ZAN Y, DING Y. Pancancer analysis of NSUN2 with a focus on prognostic and immunological roles in endometrial cancer[J]. Reprod Sci, 2024 (2024-06-20) [2024-12-27] http://dx.doi.org/10.1007/s43032-024-01625-5.
26. HU Y, CHEN C, TONG X, et al. NSUN2 modified by SUMO-2/3 promotes gastric cancer progression and regulates mRNA m5C methylation[J]. Cell Death Dis, 2021, 12(9): 842.
27. BLAZE J, NAVICKAS A, PHILLIPS H L, et al. Neuronal Nsun2 deficiency produces tRNA epitranscriptomic alterations and proteomic shifts impacting synaptic signaling and behavior[J]. Nat Commun, 2021, 12(1): 4913.
28. KAKIZAKI T, SAKAGAMI H, SAKIMURA K, et al. A glycine transporter 2-Cre knock-in mouse line for glycinergic neuron-specific gene manipulation[J]. IBRO Rep, 2017, 3: 9-16.
29. DUMAN R S, SHINOHARA R, FOGACA M V, et al. Neurobiology of rapid-acting antidepressants: Convergent effects on GluA1-synaptic function[J]. Mol Psychiatry, 2019, 24(12): 1816-1832.
30. PARK M K, CHOI B Y, KHO A R, et al. The protective role of glutathione on zinc-induced neuron death after brain injuries[J]. Int J Mol Sci, 2023, 24(3): 2950.
31. HARE B D, DUMAN R S. Prefrontal cortex circuits in depression and anxiety: contribution of discrete neuronal populations and target regions[J]. Mol Psychiatry, 2020, 25(11): 2742-2758.
【引用格式】张利利,贺九芳,陈林,等. NSUN2基因敲除对PC12细胞分化和凋亡的影响研究[J]. 中国神经精神疾病杂志,2024,50(12):735-741.
【Cite this article】ZHANG L L, HE J F,CHEN L ,et al.Research on the effects of NSUN2 gene knockout on the differentiation and apoptosis of PC12 cells[J]. Chin J Nervous Mental Dis,2024,50(12):735-741.
DOI:10.3969/j.issn.1002-0152.2024.12.005
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#PC12细胞# #NSUN2#
11