50岁子宫内膜去分化癌患者检出新型MSH2胚系突变,助力家系成员确诊林奇综合征
2025-04-13 苏州绘真医学 苏州绘真医学 发表于重庆
本研究证实MSH2无义突变c.354T>A是极可能致病突变,可导致典型的LS相关子宫内膜癌。研究强调对先证者家族成员进行遗传咨询有助于早期诊断LS相关癌症的重要性。
林奇综合征(LS)是一种由错配修复基因突变引起的常染色体显性遗传病。由于携带这些突变的个体终生罹患多种癌症的风险显著增加,遗传咨询对LS的防治至关重要。MSH2作为关键蛋白编码基因,在LS发生中起核心作用。大量LS病例与MSH2基因的有害杂合突变相关。先证者为 50 岁子宫内膜去分化癌患者,其肿瘤经免疫组化检测显示dMMR/MSI-H状态且MSH2/MSH6蛋白表达缺失。通过下一代测序技术(NGS)进行遗传咨询及肿瘤基因检测,发现一种既往未报道的MSH2基因胚系无义突变NM_000251.2:exon2.354T>A(p.Y118*),从而确诊LS。家系验证分析显示,该变异在 5 名受检家族成员中存在,其中一名 43 岁家族成员已确诊结直肠癌(CRC)。先证者接受术后放化疗后获得 2 年无病生存,目前仍在随访中。本研究证实MSH2无义突变c.354T>A是极可能致病突变,可导致典型的LS相关子宫内膜癌。研究强调对先证者家族成员进行遗传咨询有助于早期诊断LS相关癌症的重要性。
背 景
林奇综合征(LS)是一种常染色体显性遗传性疾病,与错配修复基因(MMR)的胚系突变相关,包括MLH1、MSH2、MSH6、PMS2及EPCAM等基因。MMR系统通过纠正DNA复制过程中产生的碱基替换及插入-缺失错配维持基因组稳定性,其功能缺失会导致微卫星不稳定性(MSI)。MMR功能丧失会破坏基因组完整性并促进癌症发生。临床中,通过聚合酶链式反应(PCR)检测微卫星不稳定性(MSI)和/或免疫组化(IHC)染色评估MMR蛋白表达缺失(MMR-D),已成为结直肠癌(CRC)筛查MMR缺陷的常规方法。因此,MSI-H和MMR-D是LS相关肿瘤的主要遗传标志。除CRC风险显著增加外,LS患者还易发生累及子宫内膜、卵巢、胃、小肠、肝胆系统、泌尿道及皮肤等多器官的原发肿瘤。女性LS患者有约 40%–60% 的概率以子宫内膜癌(EC)作为前哨癌,这也是LS患者最常见的肠外前哨肿瘤。LS相关EC患者在初次确诊后 10 年内发生第二原发恶性肿瘤的风险约为 25%,15 年内风险可达 50%。因此,识别EC患者中的LS对妇科肿瘤医生至关重要。
林奇综合征治疗的预后在很大程度上依赖于早期诊断。目前针对林奇综合征相关子宫内膜癌(LS-EC)的筛查标准已逐步完善。基于家族史的阿姆斯特丹II标准和Bethesda指南是广泛应用于CRC患者筛查LS的临床标准,但将其外推至EC患者时特异性分别仅有 61% 和 49%。目前推荐对所有确诊EC的女性进行MMR普筛以识别潜在的LS患者。基于分子筛查方法的新型预测工具(包括MMR免疫组化染色、微卫星不稳定性检测及基因检测)被广泛应用于提高LS筛查的准确性,建议联合多种分子检测方法对EC患者进行LS筛查。此外,基于深度突变扫描(DMS)或多重变异效应分析(MAVE)等高通量技术与计算预测工具,已被开发用于评估LS中意义未明的遗传变异。MSH2或MLH1基因突变是LS患者中最常见的遗传变异,分别占LS病例的 40% 和 50%。在LS-EC患者中,MSH2基因突变率为 50%–66%,MLH1为 24%–40%,MSH6为 10%–13%。
本文通过家族史及免疫组化检测发现一例MSH2蛋白表达缺失的EC患者,并对其外周血样本进行遗传分析以明确特定胚系突变。利用第二代高通量测序(NGS)技术,研究人员对先证者LS相关基因的外显子、内含子全序列及连接区序列进行变异分析(包括单核苷酸变异及小片段插入/缺失),最终发现了一种既往未报道的MSH2基因胚系突变。
病 例
患者女,50 岁,先证者(孕3产1流产2次,BMI 23.5 kg/m²),因异常阴道出血就诊。患者曾于外院行宫腔镜下分段诊刮术,经本院病理专家会诊确认子宫内膜组织存在低分化癌。为其施行了根治性子宫切除术(Querleu-Morrow B型)、双侧附件切除术、盆腔淋巴结清扫术及腹主动脉旁淋巴结活检术。术后病理结果显示:子宫内膜去分化癌浸润子宫肌层不足 1/2,未累及宫颈管,手术切缘阴性,淋巴结未见癌转移。根据术中标本组织病理学检查,患者被诊断为子宫内膜去分化癌I A期。免疫组化染色显示ER、PR、波形蛋白、Ki67、MLH1及PMS2蛋白表达阳性,而MSH2和MSH6蛋白表达阴性(图1)。结合其家族史中存在的林奇综合征相关恶性肿瘤病史(图2),该患者符合阿姆斯特丹II标准,临床诊断为LS。因此,研究人员建议其接受遗传咨询及基因检测。根据子宫内膜癌TCGA分子分型标准,该患者的分子分型为错配修复缺陷型(MMR-d)。为明确胚系突变,研究人员采用二代测序(NGS)技术,对先证者LS相关基因的外显子、内含子全序列及连接区序列进行变异分析(包括单核苷酸变异及小片段插入/缺失)。胚系检测发现MSH2基因存在NM_000251.2:exon2:c.354T>A(p.Y118*)突变,该无义突变导致基因编码蛋白第118位氨基酸由酪氨酸突变为终止密码子,可能因蛋白质提前截断或无义介导的mRNA降解导致功能损伤或失活。经NGS验证确认该突变存在,其功能及临床意义尚未见文献报道。对该变异进行的家系遗传分析共纳入 5 名家族成员(图3),所有成员均携带相同MSH2基因突变。其中 1 名成员(III-15)表型符合LS,已于 43 岁时确诊结直肠癌;4 名成员(IV-20、IV-21、IV-23及IV-24)在筛查时表型未显示LS相关症状(图2)。
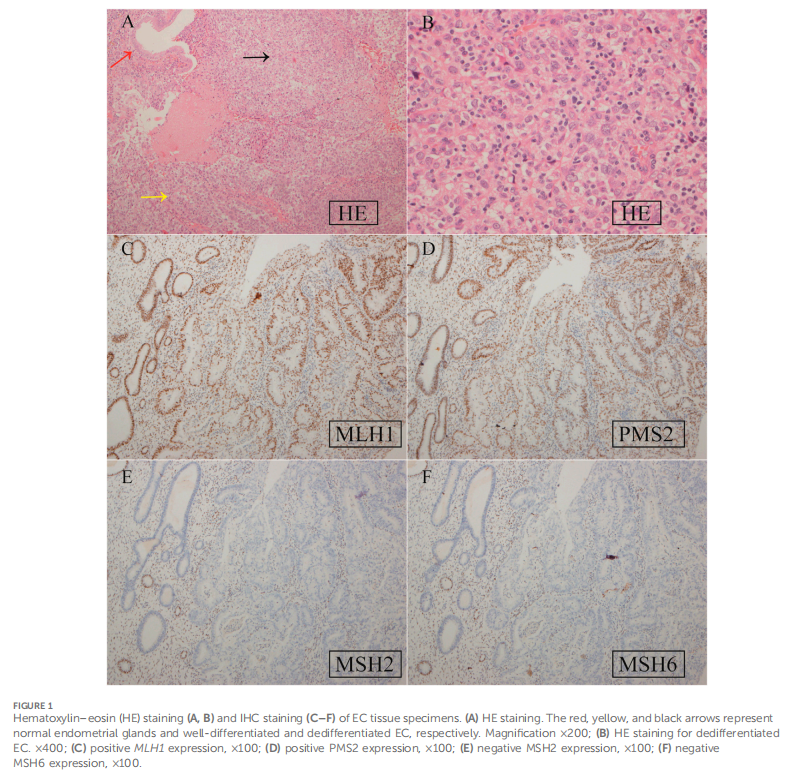
▲图1 EC标本的HE和免疫组化结果
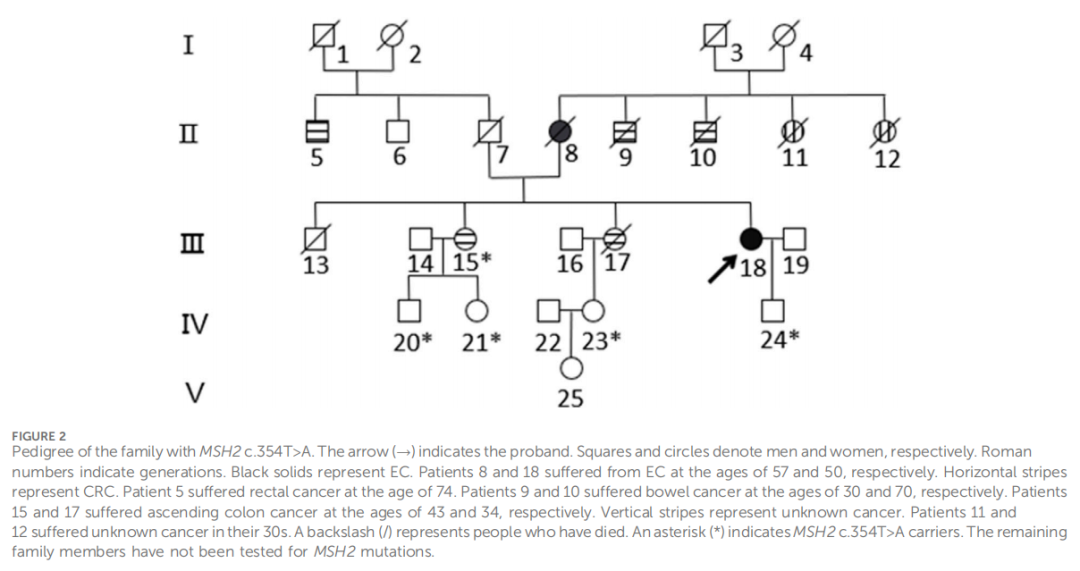
▲图2 家族谱系

▲图3 先证者家系的NGS检测结果
讨 论
本文先证者为一名 50 岁女性,初诊为子宫内膜去分化癌。其母亲罹患子宫内膜癌,两位舅舅及两位姐妹患结直肠癌,肿瘤发生跨越两代人。其中一位舅舅(II-9)及两位姐妹(III-15、III-17)分别在 43 岁及 34 岁时确诊结直肠癌,符合阿姆斯特丹II标准。该家系呈现典型的林奇综合征(LS)相关肿瘤谱,包括结直肠癌、子宫癌及原发性不明癌。
MMR基因检测已被广泛应用于LS诊断。本报告证实c.354T>A突变导致MSH2基因发生无义突变。国际遗传性胃肠肿瘤学会(InSiGHT)数据库目前收录 9,061 例已报道的MSH2基因突变,其中移码突变与无义突变(导致蛋白质截短)最为常见,分别占所有MSH2突变的 49% 和 19%。
MMR蛋白以异源二聚体形式发挥作用,其中MLH1与PMS2配对,MSH2与MSH6配对。这些蛋白在非配对状态下不稳定,MLH1和MSH2可与其他蛋白形成稳定异源二聚体,而PMS2和MSH6仅能分别与MLH1和MSH2结合。MSH2基因突变通常导致免疫组化中MSH2和MSH6蛋白同时缺失。本研究通过免疫组化验证了MSH2和MSH6蛋白表达缺失,表明MSH2缺陷是主要事件,建议进行LS相关胚系突变检测。通过MMR基因检测辅助LS诊断,基于二代测序(NGS)结果在MSH2基因2号外显子发现点突变(c.354T>A,p.Y118*)。该无义突变导致基因编码蛋白第118位氨基酸由酪氨酸突变为终止密码子,可能通过蛋白质提前截断或无义介导的mRNA降解导致蛋白功能损伤或失活。
子宫内膜癌在发病机制上可分为I型和II型。I型为低级别子宫内膜样腺癌,II型包括高级别子宫内膜样腺癌及大多数非子宫内膜样癌。LS相关子宫内膜癌常表现出更复杂的组织学类型,既包含子宫内膜样癌也包含非子宫内膜样癌,如透明细胞癌、子宫内膜样浆液性癌、未分化癌及癌肉瘤。MSH2基因突变似乎更常与非子宫内膜样组织学类型相关。然而,MSH2蛋白缺失在子宫内膜未分化癌中的报道相对少见。Zhou等人报道 3 例伴神经内分泌分化的去分化子宫内膜样癌中,有 1 例显示MSH2/PMS6蛋白表达缺失,这与本研究结果一致,提示MSH2缺失与子宫内膜去分化癌存在相关性。
与普通人群相比,携带LS相关MMR基因胚系突变的个体终生罹患结直肠癌、子宫内膜癌及其他恶性肿瘤(如胃癌、卵巢癌)的风险显著升高。建议对受累家系成员采取干预措施以降低相关癌症风险。在本文家系中,对 5 名家系成员(III-15、IV-20、IV-21、IV-23及IV-24)进行遗传学检测,所有成员均检出MSH2基因突变。其中成员III-15在 43 岁时确诊结直肠癌,其余 4 名成员(IV-20、IV-21、IV-23及IV-24)目前尚未出现LS相关临床症状,可能与其较为年轻(分别为 16 岁、24 岁、28 岁及 26 岁)相关。该突变被判定为"致病变异",可能是导致LS表型的原因。对这些个体实施及时管理策略至关重要,尤其是已确诊结肠癌的III-15成员。
目前针对MMR致病性变异携带者的监测尚缺乏统一方案,因现有数据不足以证实临床获益。多项研究表明,联合应用经阴道超声(TVS)与子宫内膜活检可提高监测效果。根据美国国家综合癌症网络(NCCN)子宫肿瘤指南,建议未患子宫内膜癌的LS患者及其家族成员每年接受子宫内膜活检以评估癌变风险。建议完成生育后行预防性子宫切除术/双侧附件切除术。Schmeler等开展的回顾性队列研究发现,接受预防性妇科手术的患者未发生子宫内膜癌、卵巢癌或原发性腹膜癌,而对照组 33% 的患者被确诊为子宫内膜癌,提示降低风险手术是LS患者预防子宫内膜癌的有效策略。手术时机与方案可根据生育需求、合并症、绝经状态、家族史及胚系突变类型进行个体化选择。LS相关子宫内膜癌风险因胚系致病性变异(PVs)类型而异:MLH1或MSH2携带者可考虑在无需保留生育功能的35岁左右行降低风险手术。对于类似本家系中 43 岁确诊结直肠癌且无生育需求的MSH2变异携带者III-15,推荐行降低风险手术。针对其他年轻女性MSH2变异携带者(如IV-21,24岁;IV-23,26岁),由于LS妇科监测研究有限,目前尚无统一指南。研究人员建议这三位携带者需警惕"预警症状",包括异常出血、体重减轻、腹胀、排便习惯改变、反复泌尿系统症状及腹部不适,在完成生育目标后可考虑预防性子宫切除术/双侧附件切除术。
针对结直肠癌监测,MLH1或MSH2胚系突变携带者至 70 岁时罹患结直肠癌的风险为 52%–82%。系统综述显示,推荐MLH1或MSH2基因突变携带者从20–25岁开始首次结肠镜检查,此后每 1–2 年复查,或从家族中结直肠癌患者确诊年龄提前 10 年开始筛查。本文报道家系中结直肠癌最早确诊年龄为 34 岁(III-17),因此研究人员建议 6 名携带者(含先证者)从 24 岁起每 1–2 年接受结肠镜检查。
总之,本研究报道一例携带MSH2基因NM_000251.2:exon2:c.354T>A(p.Y118*)突变的林奇综合征(LS)相关子宫内膜去分化癌病例,该肿瘤呈dMMR/MSI-H特征。该突变被判定为极可能致病变异。研究人员为患者及其 5 名家族成员提供了针对MSH2基因的遗传咨询,并通过检测确认了MSH2 c.354T>A(p.Y118*)突变的存在。目前文献中尚未见携带该变异的LS病例报道。结合本家系观察结果,研究人员认为该变异极有可能是LS的致病变异。
参考文献:
Zhong L, Wang W, Duan Y, Song L, Li Z, Yang K, Li Q and Yin R (2024) A new subtype of Lynch syndrome associated with MSH2 c.354T>A (p. Y118*) identified in a Chinese family: case report and literature review. Front. Genet. 15:1440179. doi: 10.3389/fgene.2024.1440179


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#林奇综合征# #MSH2#
19