兰州大学口腔医学院范增杰AFM:微环境调控双层微针贴片促进糖尿病牙周炎软硬组织再生
8小时前 BioMed科技 BioMed科技 发表于陕西省
兰州大学范增杰提出多功能双层微针(d-MNs)用于糖尿病牙周炎软硬组织再生,介绍其各部分功能、相关特性验证及动物实验结果,显示其修复优势,为治疗提供新前景,附原文链接。
糖尿病患者的慢性牙周炎会加剧局部牙周软组织的破坏,并加速硬组织的吸收。目前,同时恢复牙周软硬组织的有效策略仍然不足。为了解决这一挑战,兰州大学口腔医学院范增杰提出了一种多功能双层微针(d-MNs)设计,用于在糖尿病患者中再生牙周软硬组织。d-MNs基底由含有纳米羟基磷灰石(nHA)的明胶甲基丙烯酰胺(GelMA)组成,这有助于成骨细胞分化为成骨细胞,从而促进牙槽骨再生。另一方面,d-MNs的尖端主要由透明质酸(HA)和载有葡萄糖氧化酶(GOX)的镁基金属有机框架(Mg-MOF)组成。这种组合创造了一个降血糖、促血管生成和抗炎的微环境,支持软组织修复。当植入牙周炎部位时,d-MNs基底和尖端之间的协同作用有效促进了软硬组织的再生,这一点已在糖尿病牙周炎大鼠模型中得到证明。这些创新的d-MNs有潜力彻底改变治疗糖尿病牙周炎的传统方法,并可在牙科诊所广泛应用。该研究以题为“Microenvironment-Regulated Dual-Layer Microneedle Patch for Promoting Periodontal Soft and Hard Tissue Regeneration in Diabetic Periodontitis”的论文发表在《Advanced Functional Materials》上。

图1展示了双层微针(d-MNs)的制备过程及其在牙周组织修复中的作用模型。d-MNs的尖端由可溶性透明质酸和GOX/Mg-MOF组成,能够通过快速自溶解释放GOX/Mg-MOF,以降低血糖、抗炎和促进血管生成,从而修复软组织。基底则由GelMA和nHA组成,贴附于牙槽骨表面,促进成骨细胞分化为成骨细胞,加速硬组织修复。这种设计确保了d-MNs在牙周炎部位植入后,能够有效促进软硬组织的协同再生,为糖尿病牙周炎的治疗提供了一种创新的策略。
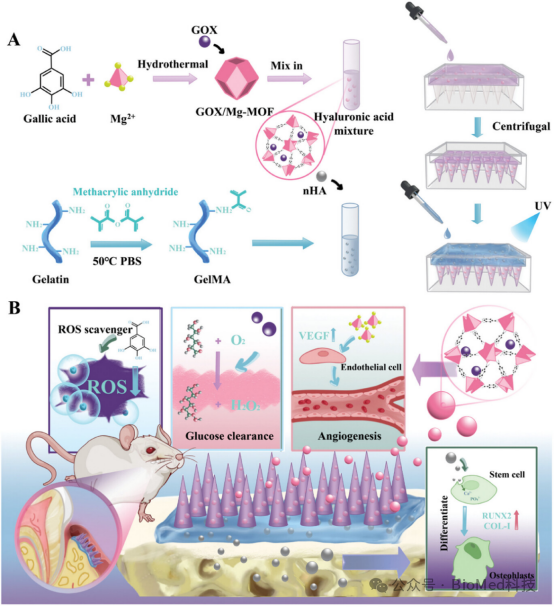
图1. 双层微针制备及促进牙周组织修复的模型图
【合成MOF的形貌和功能特性】
图2展示了合成的Mg-MOF和GOX/Mg-MOF纳米颗粒的形貌和功能特性。通过透射扫描电子显微镜(TEM)观察,发现MOF纳米颗粒呈多面体形状,但大小和形状不规则,且GOX的负载并未改变Mg-MOF的结构。傅里叶变换红外光谱(FTIR)分析确认了Mg和GA之间形成了新的化学键。X射线衍射(XRD)进一步验证了Mg-MOF的成功合成。此外,通过靛蓝褪色实验验证了GOX/Mg-MOF保留了GOX的酶活性。这些结果表明,成功制备了具有生物相容性和多孔结构的Mg-MOF,并且GOX的负载和释放功能得到了有效实现,为后续的生物应用奠定了基础。
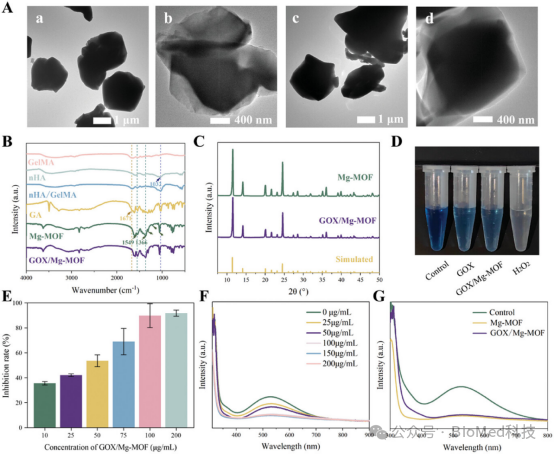
图2. 合成MOF的形貌和功能特性
【双层微针及其微针基底的特性】
图3展示了双层微针(d-MNs)及其微针基底的制备、结构和物理特性。通过扫描电子显微镜(SEM)观察,d-MNs呈现均匀的圆锥形结构,具有良好的双层结构设计,基底由GelMA和nHA组成,尖端由HA和GOX/Mg-MOF组成。压缩应力-应变曲线显示,随着GelMA浓度的增加,微针基底的抗压强度和模量提高,最终选择10%GelMA与5%nHA的组合以获得最佳的机械性能和生物相容性。此外,微针基底的溶胀率随nHA的引入而降低,且在胶原酶II的作用下表现出良好的降解性能。这些特性表明,所制备的d-MNs具有优异的结构稳定性和生物相容性,能够满足牙周组织修复的需求.
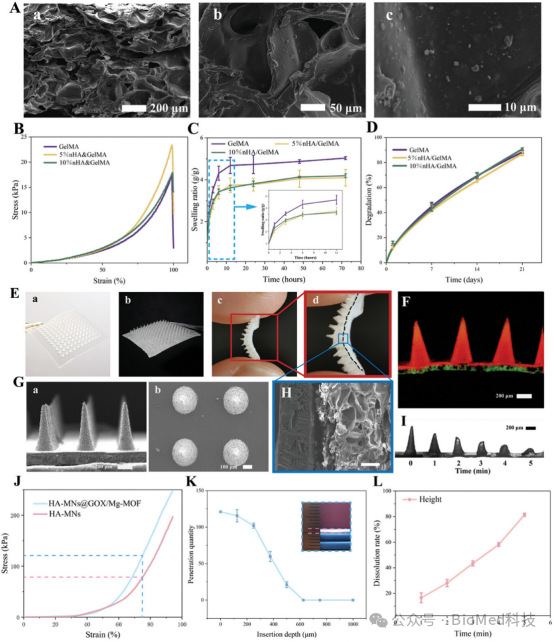
图3. 双层微针(d-MNs)及其微针基底的特性
【细胞生物相容性、成骨和血管生成特性】
图4展示了双层微针(d-MNs)及其各组分的细胞生物相容性、成骨和血管生成特性。通过CCK8实验和活/死细胞染色,结果显示所有样品的细胞活性均超过85%,表明其具有良好的生物相容性。此外,与nHA/GelMA共培养的MC3T3-E1细胞表现出显著的成骨分化能力,如碱性磷酸酶(ALP)和茜素红(ARS)染色结果所示,其成骨相关基因RUNX2和OCN的表达也显著上调。在血管生成实验中,MOF/HA组的HUVECs管状结构形成能力优于其他组。这些结果表明,d-MNs的各组分在促进成骨和血管生成方面具有协同作用,为其在牙周组织修复中的应用提供了实验依据。
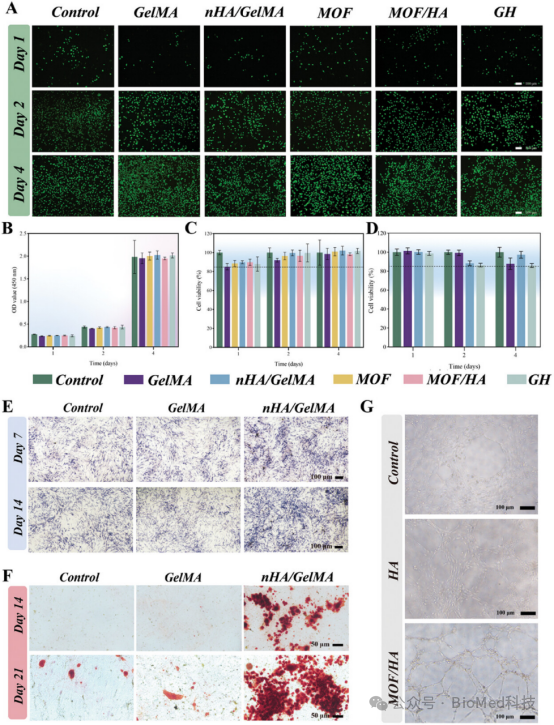
图4. 细胞生物相容性、成骨和血管生成特性
【nHA/GelMA促进成骨的PCR评估,以及MOF体外的抗炎和抗氧化特性】
图5展示了nHA/GelMA促进成骨的PCR评估以及MOF在体外的抗炎和抗氧化特性。通过PCR分析,结果显示nHA/GelMA组的成骨相关基因RUNX2和OCN表达显著上调,表明其具有良好的成骨诱导能力。此外,MOF能有效降低细胞内活性氧(ROS)水平,减少炎症因子IL-6和TNF-α的表达,并促进巨噬细胞向抗炎M2表型极化。这些结果表明,nHA/GelMA和MOF在促进成骨和抗炎方面具有显著作用,为牙周组织修复提供了重要的分子机制支持。
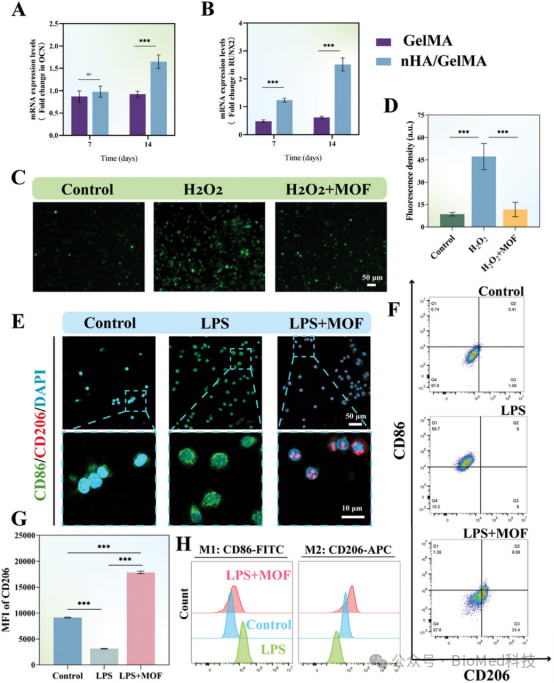
图5. nHA/GelMA促进成骨的PCR评估,以及MOF体外的抗炎和抗氧化特性
【组织学和免疫组化染色】
图6展示了糖尿病牙周炎动物实验的组织学和免疫组化染色结果。实验分为多个组别,包括健康对照组、糖尿病牙周炎组(DP组)、常规治疗组(PDP组)、空白双层微针组(d-MNs组)和载有GOX/Mg-MOF的双层微针组(d-MNs@MOF组)。结果显示,经过14天和28天的治疗,d-MNs@MOF组的牙周组织修复效果最为显著。在14天时,d-MNs@MOF组的牙周组织中炎症细胞浸润明显减少,结缔组织纤维束排列有序,与健康组织相似,而DP组和PDP组的炎症反应较为严重,纤维束排列紊乱。此外,d-MNs@MOF组的牙龈组织中血管内皮生长因子(VEGF)表达水平最高,表明其在促进血管新生方面具有优势。这些结果表明,d-MNs@MOF在糖尿病牙周炎的治疗中具有良好的效果,能够有效促进牙周软硬组织的修复和再生。
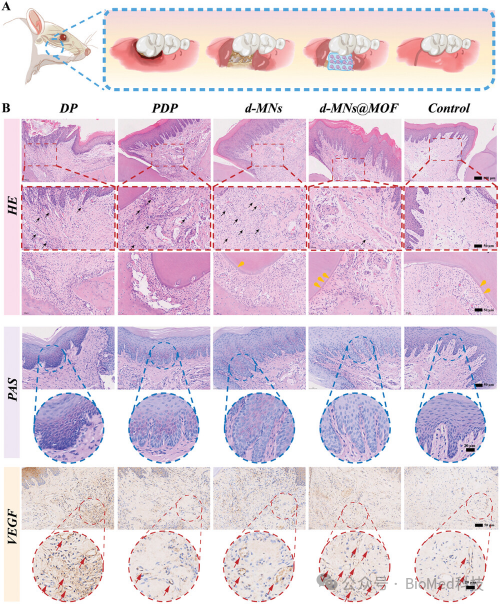
图6. 组织学和免疫组化染色
【牙周组织的Masson和免疫组化染色】
图7展示了糖尿病牙周炎动物实验中牙周组织的Masson染色和免疫组化染色结果。结果显示,在治疗14天后,d-MNs@MOF组的牙周组织中胶原纤维密度、连续性和组织化程度显著优于其他组,Masson染色显示其蓝色染色区域更为明显,表明胶原再生效果更好。免疫组化染色结果显示,d-MNs@MOF组在牙龈组织中I型和III型胶原(COL-I和COL-III)的表达量最高,且在牙槽骨区域RUNX2和COL-I的表达也最为显著,表明其在促进牙周软硬组织修复方面具有显著优势。
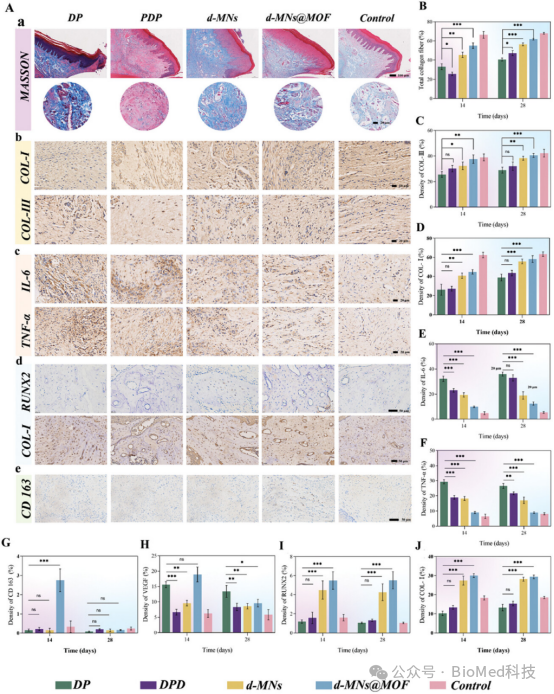
图7. 牙周组织的Masson和免疫组化染色
【微CT成像及骨量分析】
图8展示了通过微CT成像对糖尿病牙周炎动物模型中牙槽骨再生的评估结果。结果显示,经过治疗后,d-MNs@MOF组的牙周组织在牙槽骨高度恢复方面表现最为显著,其牙槽骨体积和质量显著优于其他治疗组和对照组。具体而言,d-MNs@MOF组在牙槽骨的骨密度(BMD)、骨体积分数(BV/TV)、骨小梁数量(Tb.N)和骨小梁厚度(Tb.Th)等微结构参数上均取得了显著改善。这些结果表明,d-MNs@MOF在促进牙槽骨再生和修复方面具有显著优势,能够有效恢复糖尿病牙周炎引起的牙槽骨损伤.
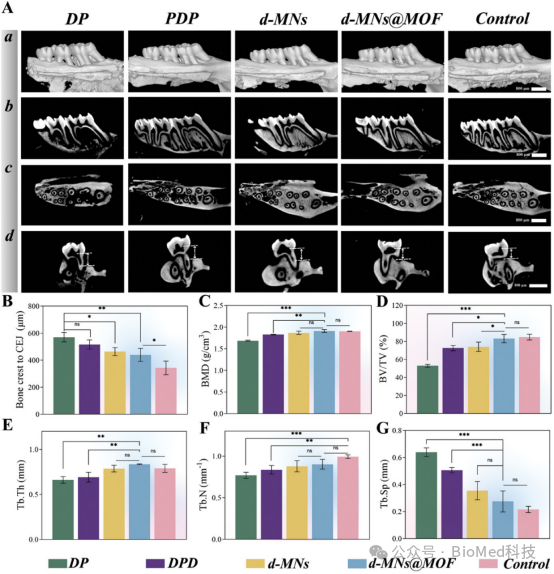
图8. 微CT成像及骨量分析
【小结】
该论文开发了一种具有上下层不同功能的双层微针贴片(d-MNs@MOF),其尖端层能够降低局部组织的血糖浓度、通过清除活性氧来抗炎,并释放镁离子以促进血管生成,而基底层则促进骨组织再生。这些协同功能使得d-MNs@MOF能够全面修复糖尿病牙周炎所损伤的软硬组织,为糖尿病牙周炎的手术治疗提供了新的临床应用前景。
原文链接:
https://doi.org/10.1002/adfm.202418076
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#糖尿病牙周炎# #软硬组织再生#
4