脂质纳米颗粒,最新Nature Biotechnology!
5小时前 BioMed科技 BioMed科技 发表于陕西省
本文报道了一种新型脂质纳米颗粒(LNP67),它能在无需骨髓动员或化疗的情况下,有效地将mRNA递送到小鼠、猕猴和人类原代造血干细胞和祖细胞中。
非人灵长类动物中LNP介导的造血干细胞
脂质纳米颗粒(LNPs)的研发灵感源于对高效、靶向药物递送系统的需求,特别是在核酸药物领域。核酸药物如mRNA和siRNA在治疗遗传性疾病、癌症和传染病方面展现出巨大潜力,但它们在体内的稳定性差,容易被酶降解,且难以穿透细胞膜进入细胞内。因此,科学家们寻求开发一种能够保护核酸分子、提高其稳定性和细胞摄取的递送系统,LNPs因此应运而生。
LNPs的组分设置是为了实现这一目标而精心设计的。一个典型的LNP由四种主要脂质成分组成:可电离脂质(DOTMA、DOTAP、DLin-MC3-DMA和DLin-MC3-DMAP)、聚乙二醇(PEG)脂质(DSPE-PEG2000和DSPE-PEG5000)、胆固醇和辅助脂质(DOPE、DSPC和EPC)。可电离脂质在特定pH值下带正电,与带负电的核酸分子结合,保护它们不被降解,并在细胞内释放核酸。PEG脂质增加了LNP的稳定性,防止它们在血液中被快速清除,并可能影响其在体内的分布。胆固醇有助于稳定LNP的结构,调节其流动性,并影响其与细胞膜的融合。辅助脂质进一步稳定LNP,并可能影响其靶向性和细胞摄取。
LNPs的组分会根据特定的治疗需求和监管要求进行优化。这可能包括定制化的可电离脂质以提高核酸的包载效率和细胞转染效率,优化PEG脂质的分子量和密度以改善LNP的药代动力学特性和减少免疫反应,以及调整胆固醇和辅助脂质的比例以适应不同的核酸类型和目标组织。此外,为了提高LNP的性能,可能还会添加其他成分,如pH敏感的脂质、靶向配体或细胞穿透肽。
乔治亚理工学院和埃默里大学James E. Dahlman团队开发一种能够在非人灵长类动物中有效、安全地将mRNA递送到造血干细胞和祖细胞的LNP技术,且无需依赖骨髓动员或化疗预处理,同时确保LNP的稳定性、生物相容性以及跨物种的适用性。相关内容以“Lipid nanoparticle-mediated mRNA delivery to CD34+ cells in rhesus monkeys”为题发表在《Nature Biotechnology》上。

【主要内容】
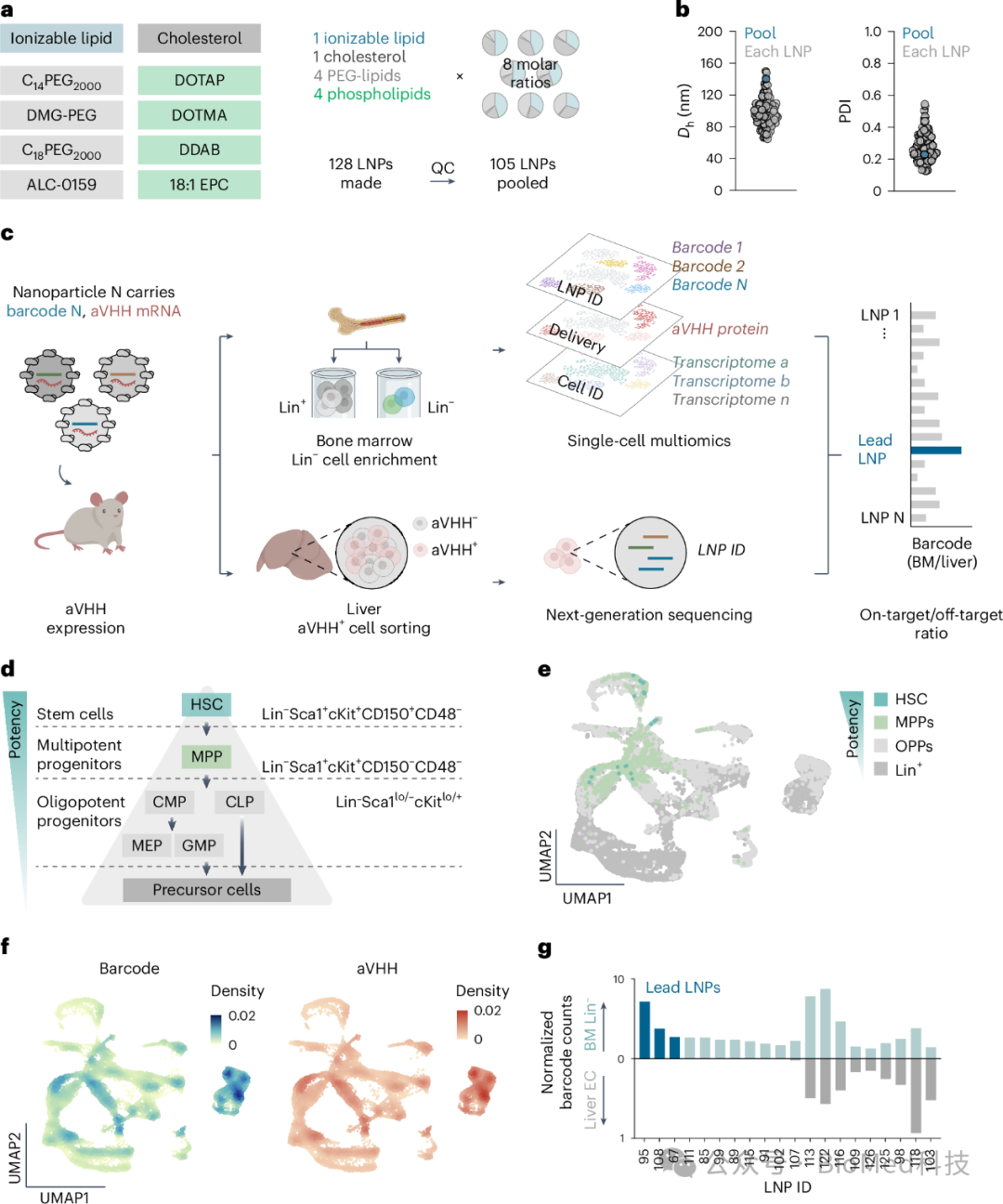
图1 128种LNPs注射到小鼠体内后,对骨髓中的Lin-细胞群分析
这些LNPs被设计来携带GPI锚定的VHH抗体(aVHH)的mRNA。研究人员首先通过流式细胞术和下一代测序技术,从骨髓中分离出Lin-细胞,并量化了LNP(通过DNA条形码)、功能性递送(通过aVHH蛋白表达)和细胞身份(通过转录组)。他们观察到在转录上定义的造血干细胞(HSCs)群体中,LNPs的递送效率,包括多能祖细胞(MPPs)和寡能祖细胞(OPPs)。通过分析,研究人员确定了LNPs在骨髓和肝脏中的递送效率,并筛选出三个主要的LNP候选物,LNP67、LNP95和LNP108,它们显示出对骨髓有较好的靶向性。
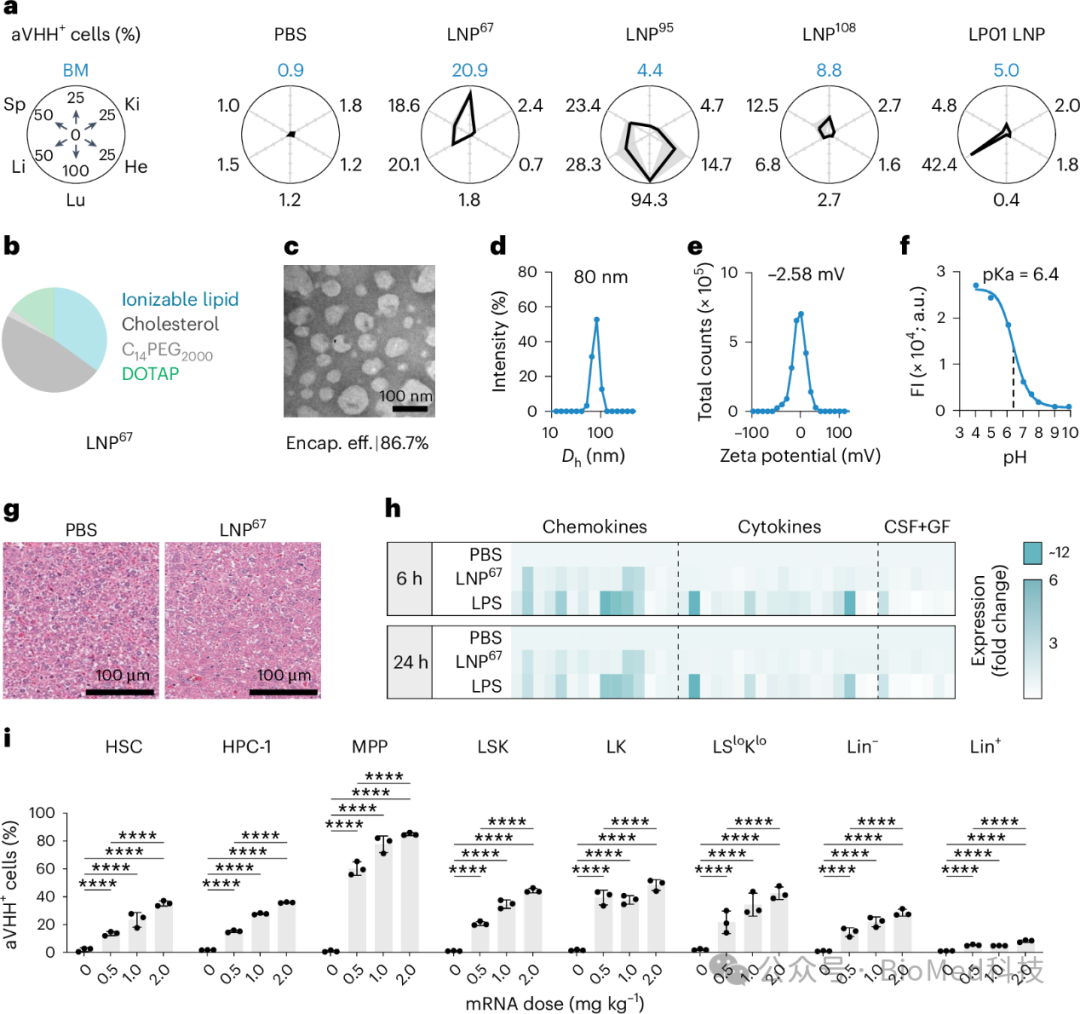
图2 LNP67在小鼠体内的递送效率和生物分布
研究发现,LNP67能够将mRNA有效地递送到小鼠骨髓中的造血干细胞和祖细胞(HSCs和HSPCs),以及肝脏细胞。通过比较不同器官中aVHH蛋白的表达量,研究者们发现LNP67在骨髓与肝脏的递送比例最为理想,而作为对照的LP01 LNP则如预期那样主要靶向肝脏。图中还展示了LNP67的物理特性,包括其球形结构、流体动力学直径、zeta电位和pKa值。此外,通过与小鼠血浆混合并进行质谱分析,研究者们鉴定了吸附在LNP67上的血清蛋白,这些蛋白可能影响LNP的组织特异性。研究结果表明,LNP67在不引起血清细胞因子激活的情况下,能够高效地将mRNA递送到HSCs和HSPCs
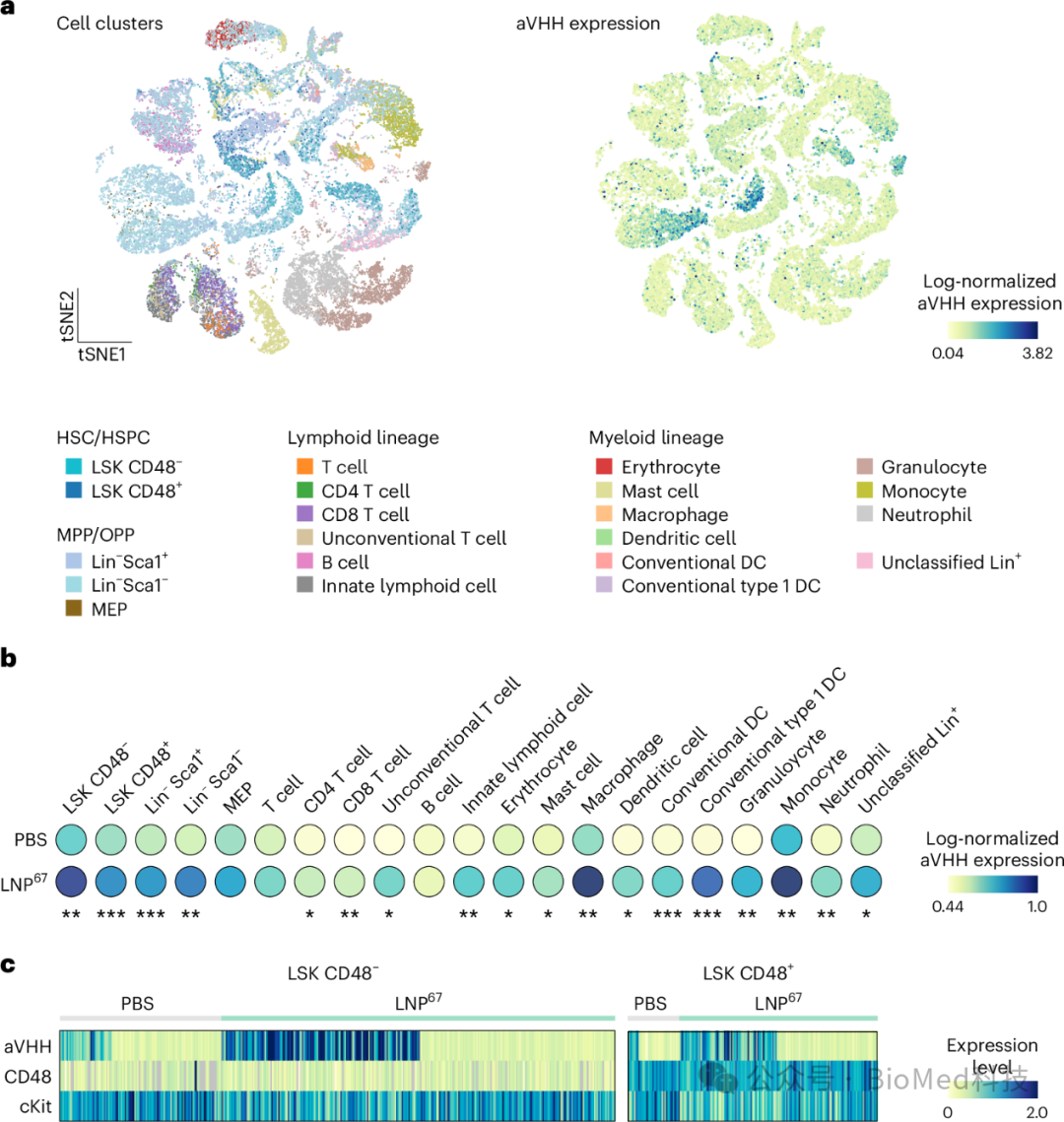
图3 单细胞多组学技术揭示了LNP67在小鼠体内将mRNA递送到转录定义的HSCs的情况
研究者们使用LNP67携带aVHH mRNA,并通过静脉注射给小鼠,24小时后从骨髓中富集Lin-细胞。通过DNA共轭的抗VHH抗体定量aVHH蛋白,并将其读数与单细胞转录组数据叠加。分析结果显示,在所有21个细胞簇中,LNP67处理组的aVHH阳性细胞数量显著高于PBS处理组的背景信号。特别是在包含HSCs的簇中,约50%的LSK细胞(无论CD48-还是CD48+)显示出aVHH蛋白表达,其中CD48-细胞(HSCs和MPPs)的表达显著高于CD48+细胞(OPPs)。此外,Lin-细胞类型的aVHH表达也显著高于Lin+细胞类型。
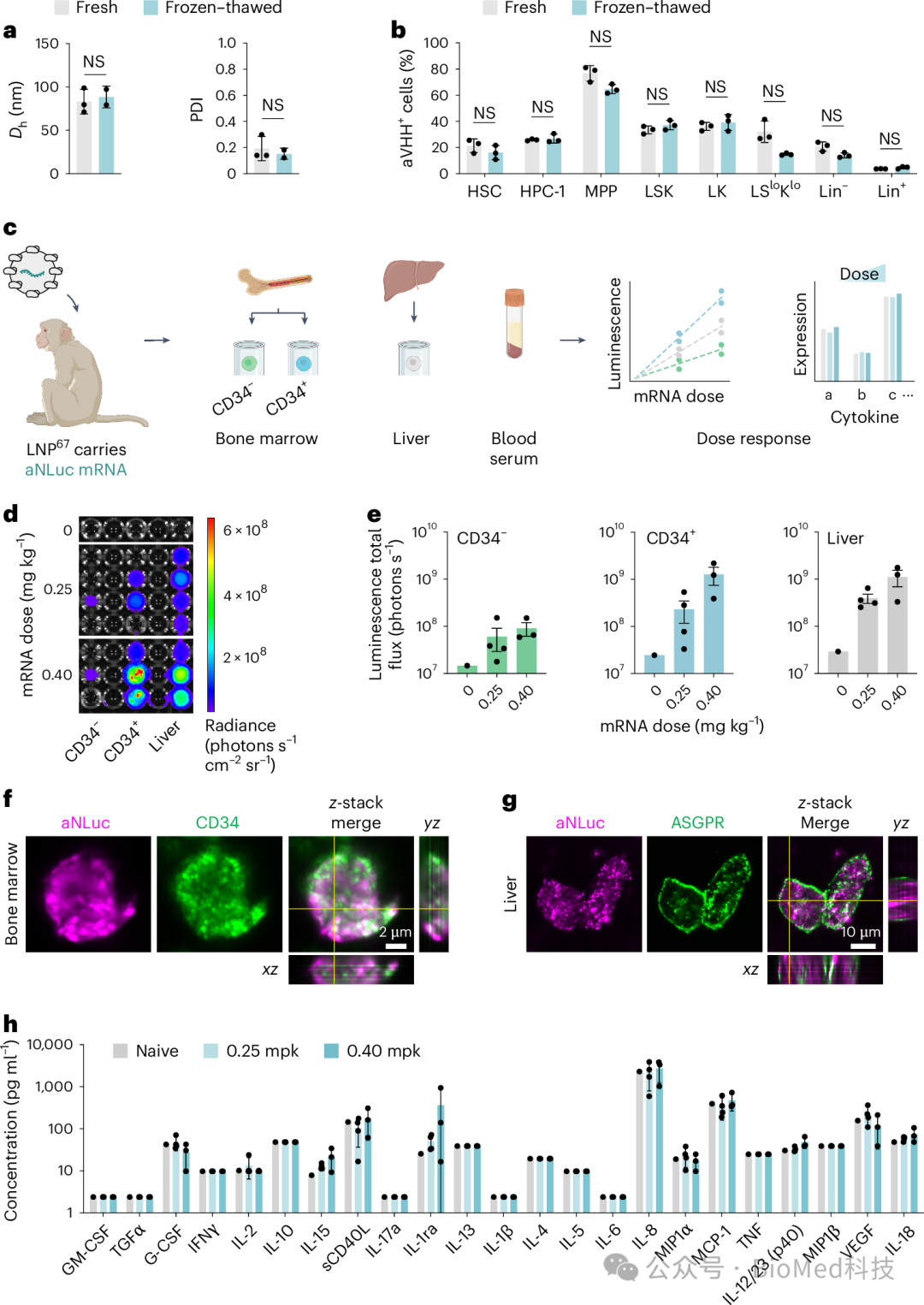
图4 LNP67在猕猴体内的mRNA递送效率和生物分布
研究中,LNP67携带锚定纳米荧光素酶(aNLuc)mRNA,经过冷冻保存和解冻后,通过静脉注射给年轻猕猴,剂量分别为0.25 mg/kg和0.4 mg/kg。大约24小时后,收集了血液样本和组织(包括肝脏和骨髓),并从骨髓抽提液中免疫选择CD34+和CD34-细胞,同时准备肝脏细胞悬浮液。通过添加荧光素酶底物荧光素,评估了LNP67在骨髓和肝脏中的剂量依赖性递送,结果显示在CD34+和肝脏细胞类型中,两种剂量的LNP67都能引起相似的荧光素酶表达。通过抗NLuc抗体荧光成像进一步确认了CD34+和肝脏细胞中的递送。此外,血清细胞因子分析显示,与对照动物相比,经LNP67处理的动物没有观察到显著差异。
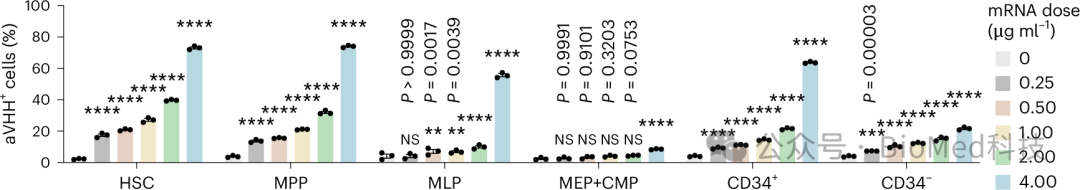
图5 LNP67对原代HSCs和HSPCs的体外mRNA递送能力
研究中,LNP67携带aVHH mRNA,以不同剂量处理原代人骨髓CD34+细胞。24小时后,通过流式细胞术分析aVHH蛋白的表达,以评估功能性递送效率。结果显示,LNP67处理的细胞在所有六个细胞亚型中均显示出剂量依赖性的递送效率,特别是在HSCs和HSPCs中的递送效果比其他细胞(CD34-)更为显著。这一发现证实了LNP67在体外模型中能够有效地将mRNA递送到人类HSCs和HSPCs。
【全文总结】
本文报道了一种新型脂质纳米颗粒(LNP67),它能在无需骨髓动员或化疗的情况下,有效地将mRNA递送到小鼠、猕猴和人类原代造血干细胞和祖细胞中。LNP67显示出良好的耐受性和安全性,为遗传性血液疾病的治疗提供了新的可能性,推动了基因治疗领域的发展。
原文链接:
https://doi.org/10.1038/s41587-024-02470-2
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#脂质纳米颗粒# #LNP67#
0