Small:南方医科大学赵冰夏/刘天才合作构建仿生杂化膜纳米载体用于高效肿瘤靶向给药
14小时前 iNature iNature 发表于陕西省
该研究通过将CCM与pH敏感脂质体(1,2-二油酰-sn-甘油-3-磷酸乙醇胺脂质体,DOPE-Lipo)杂交,设计了一种新型仿生靶向纳米载体CCMpHD。
涂有癌细胞膜(CCM)的仿生伪装纳米载体在药物递送应用中引起了广泛关注。CCM伪装的纳米载体具有固有的肿瘤同源靶向能力,但其通过内吞作用进入癌细胞,药物递送效率较差。将内化机制转换为膜融合可能会提高其递送效率。
2024年12月29日,南方医科大学赵冰夏、刘天才共同通讯在Small 在线发表题为“Less is More: Biomimetic Hybrid Membrane Nanocarriers for Highly Efficient Tumor Targeted Drug Delivery”的研究论文。该研究通过将CCM与pH敏感脂质体(1,2-二油酰-sn-甘油-3-磷酸乙醇胺脂质体,DOPE-Lipo)杂交,设计了一种新型仿生靶向纳米载体CCMpHD。
CCM的存在使纳米载体能够进行同源靶向,而DOPE-Lipo杂交体使纳米载体能够通过膜融合实现有效的内化。值得注意的是,CCMpHD的细胞摄取率显著高于CCMs。1/10CCM可实现最高效的递送,需要的细胞膜明显减少。阿霉素(DOX)作为模型药物来表征杂交纳米载体的同源靶向药物递送特性。体外和体内实验均表明,纳米载体具备优异的生物安全性和肿瘤靶向递送能力。杂化膜纳米载体提高了递送效率,同时需要更少的CCM,为癌症治疗中基于CCM的药物递送提供了一种新策略。

近年来,已经开发了许多抗肿瘤药物递送系统。其中,基于癌细胞膜(CCM)的仿生纳米材料因其免疫逃逸、血液循环持续时间长、分子特异性识别和同源靶向特性而受到广泛关注。迄今为止,CCM已广泛用于增强肿瘤靶向药物递送,以及使用CCMs与其他天然细胞膜融合的仿生修饰,以结合各种细胞膜功能。
尽管基于CCM的纳米载体表现出有效的药物递送特性,但这些纳米载体的内化机制依赖于内吞作用。内吞作用(耗能过程)吸收药物的效率明显低于通过非耗能过程(膜融合)实现的效率,设计具有膜融合内化机制的仿生纳米载体尤为重要。
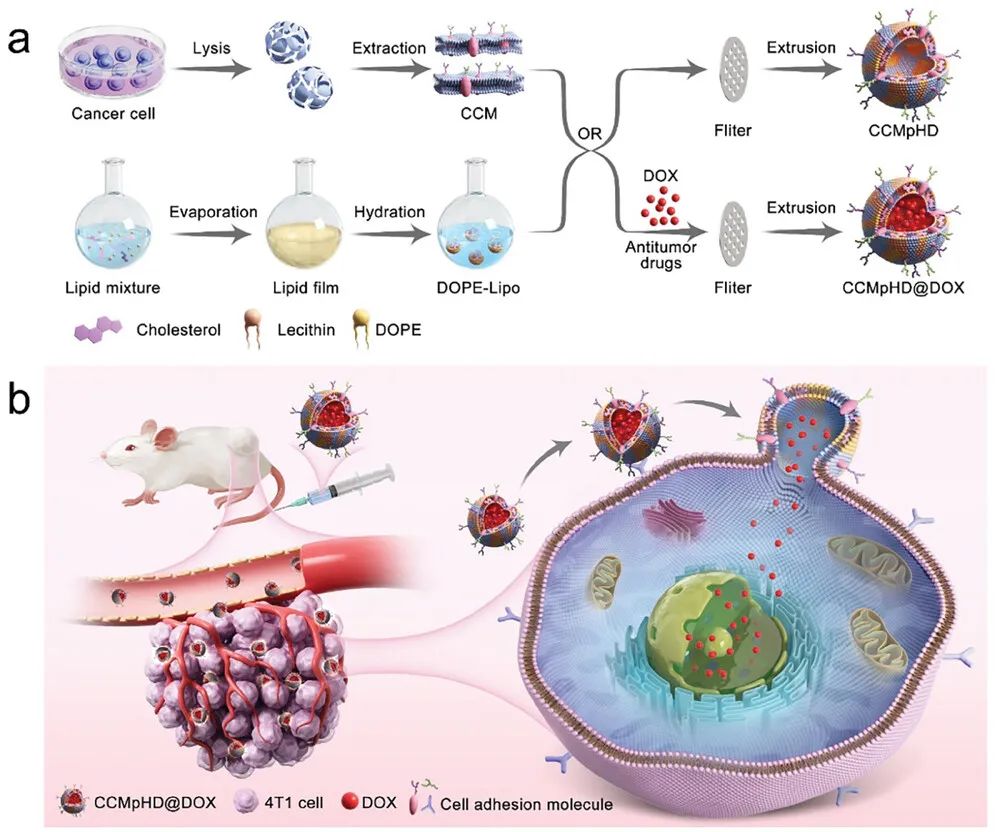
图1 CCMpHD@DOX膜融合生仿生纳米载体的制备示意图(摘自Small )
一些pH敏感脂质体(pHL),如pH响应性1,2-二油酰-sn-甘油-3-磷酸乙醇胺-脂质体(DOPE-Lipo),通过膜融合内化。因此,设计一种CCM-pHL杂交膜纳米载体有可能将其内吞机制从内吞作用转变为膜融合。由于部分细胞膜包被的纳米颗粒也可以实现同源靶向,也可以被靶细胞内化,用pHL代替一些CCM来设计杂化膜纳米载体可能不会影响其靶向能力。尽管已经报道了一些脂质体和细胞膜杂交纳米载体,CCMs与pHL杂交通过膜融合增强药物摄取的有效性仍是未知数。
该研究设计了一种CCM/pH敏感的脂质体-成分混合纳米载体(CCMpHD)。从小鼠乳腺癌细胞系4T1中提取一整套CCM蛋白,为仿生杂交纳米载体提供识别和粘附同源肿瘤细胞的能力,并允许纳米载体集中在肿瘤部位。此外,CD47等膜蛋白是肿瘤细胞免疫耐受和避免被巨噬细胞摄取的重要调节因子。利用pH响应性DOPE-Lipo制备杂交纳米载体,通过膜融合实现高效的细胞内化。选择广谱抗肿瘤药物盐酸阿霉素(DOX)作为模型药物,评估了仿生纳米载体(CCMpHD@DOX)的靶向抗肿瘤治疗效果。体外和体内实验均验证了膜融合仿生纳米载体CCMpHD@DOX的肿瘤靶向和抗肿瘤作用,表明CCM/pH响应性脂质成分杂交纳米载体通过膜融合机制进行内化,实现了高效的同源肿瘤靶向药物递送。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/smll.202407245
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#CCM# #杂化膜纳米载体#
4