Nat Commun:大规模真实世界临床基因组数据分析,揭示与20种癌症治疗反应相关的776个基因组改变
19小时前 测序中国 测序中国 发表于陕西省
研究团队将癌症患者体细胞突变数据与其EHR中提取的治疗及结果数据相整合,确定了与20种不同癌症类型生存结果相关的776个基因组改变,并揭示了特定基因、通路突变与治疗反应的关联。
随着精准医学的发展,利用特定基因突变为癌症患者定制个性化的治疗方案已成为可能,有望显著改善患者预后。近年来,NGS技术的进步极大地推动了基因组学分析,拓展了其在癌症治疗中的应用;虽然目前存在大量可用的基因突变信息,但仅有少数突变与治疗有效性直接相关。
已有研究表明,通过分析大规模的现实世界临床基因组数据,尤其是电子医疗记录(EHR)中的数据,人们能够发现与癌症治疗反应相关的关键生物标志物,并基于此预测患者对治疗的应答情况。
近日,美国斯坦福大学James Zou团队与Genentech公司Ryan Copping团队合作,在Nature Communications上发表了题为“Characterizing mutation-treatment effects using clinico-genomics data of 78,287 patients with 20 types of cancers”的文章。研究团队将癌症患者体细胞突变数据与其EHR中提取的治疗及结果数据相整合,确定了与20种不同癌症类型生存结果相关的776个基因组改变,并揭示了特定基因、通路突变与治疗反应的关联。基于这些发现,研究团队开发了一个机器学习模型,用于预测晚期非小细胞肺癌(aNSCLC)患者对免疫疗法的反应。该研究展示了大规模真实世界数据的计算解析如何推动精准肿瘤学向前发展,并为肿瘤学中的基因治疗和通路治疗动力学提供了重要见解。

文章发表在Nature Communications
研究团队利用FH-FMI CGDB数据库中78,287位患者数据,以识别可预测特定治疗结果的突变,包括NSCLC、转移性乳腺癌(mBC)、和转移性结直肠癌(mCRC)等20种不同癌症类型。
接下来,基于单变量Cox比例风险模型,研究团队探究了20种不同癌症类型中特定基因突变对患者总生存期的影响,所有分析仅考虑非同义突变。在调整潜在混杂变量后,发现95个基因与至少一种癌症的生存率显著关联,TP53、CDKN2A和 CDKN2B等基因突变与大多数癌症类型患者的总生存率降低有关。
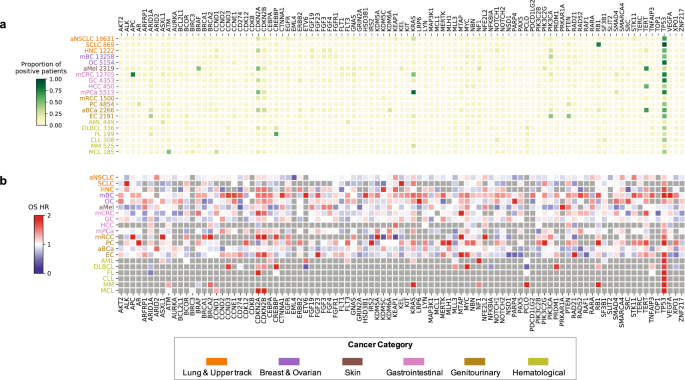
图1. 突变统计和突变-生存率关联概述
研究团队通过使用Cox模型分析了基因-治疗相互作用,以确定可能影响治疗结果的特定基因突变,并调整了年龄、性别、种族等潜在混杂变量。结果显示,共识别出与特定治疗下患者生存相关的776个基因-治疗相互作用。
在具有KRAS突变的aNSCLC患者中,与其他疗法相比,接受化疗或帕博利珠单抗治疗时生存率更好;接受EGFR抑制剂治疗时生存率较差。而在没有KRAS突变的患者中,EGFR抑制剂治疗与较好生存率相关。
研究团队还发现了NF1基因与各种治疗之间的多个具有统计学意义的显著基因-治疗相互作用。在aNSCLC患者中,NF1突变患者在接受免疫治疗、纳武利尤单抗治疗时显示出良好生存率,但在ALK抑制剂和EGFR抑制剂治疗中则与较差的生存率相关。在mCRC患者中,NF1突变患者接受氟维司群和帕博利珠联合治疗时生存率较差。
对于小细胞肺癌(SCLC)和胃癌(GC),特定基因突变也与较差的生存率相关。SCLC患者中,具有NOTCH1基因突变并接受一线免疫治疗的患者与较差生存率相关;在接受任何化疗的GC患者中,与没有突变相比,具有CDKN2B基因突变的患者生存率更差。这些结果表明,随着真实世界队列规模的增加,更显著的基因-治疗相互作用越来越多;开发针对这些基因的靶向治疗,有望改善患者预后。
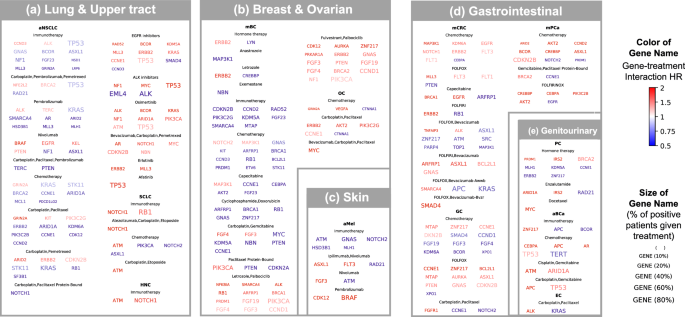
图2. 不同癌症中基因-治疗相互作用分析
为探究特定基因通路中的突变如何影响主要治疗的有效性,研究团队使用Cox模型探究了通路-治疗相互作用。结果显示,PI3K/AKT/mTOR通路与mBC内分泌治疗不良结果之间存在相关性,该通路也是预测晚期黑色素瘤(aMEL)、转移性肾细胞癌(mRCC)、mCRC患者治疗反应的强预测因子。
此外,DNA修复通路中的双链DNA修复机制与aNSCLC患者对免疫疗法的良好反应相关。特别地,Toll样受体(TLR)信号通路在治疗反应中至关重要:TLR通路中任何一个基因改变都与NSCLC患者免疫治疗和特定联合治疗(卡铂+培美曲塞+帕博利珠单抗)后生存率显著提高相关。
上述结果表明,虽然特定基因突变可以提供有价值的见解,但了解其所属的更广泛基因通路可能提供更全面的治疗动态视图;评估通路-治疗相互作用动力学可制定更明确的治疗方案,并揭示药物开发和优化的潜在方向。

图3. 不同癌症中通路-治疗相互作用分析
最后,基于上述突变-治疗分析结果,研究团队利用机器学习将所有突变组合在一起,评估了其对患者预后的预测效果;开发了随机森林(RSF)模型,可生成相应评分来预测免疫疗法对aNSCLC患者的生存益处。RSF模型以患者的基因组特征作为特征,包括TMB状态和95个重要预后基因的突变状态。
在TMB低且RSF评分高的患者群体中,免疫疗法显示出比其他治疗更好的效果,这表明RSF评分可以作为TMB的一个补充指标。此外,RSF评分在指导免疫疗法应用方面也与单独使用TMB性能相似。

图4. aNSCLC患者组中免疫治疗和非免疫治疗的比较
总之,研究团队通过扩展数据范围,深入研究了患者的肿瘤突变谱、治疗史和生存结局,确定了可显著预测患者治疗后生存结果的体细胞基因组改变。该研究结果强调了对大规模真实世界临床基因组学数据进行计算分析的价值,为精准肿瘤学的后续发展提供了新见解并奠定了基础。
参考文献:
Liu, R., Rizzo, S., Wang, L. et al. Characterizing mutation-treatment effects using clinico-genomics data of 78,287 patients with 20 types of cancers. Nat Commun 15, 10884 (2024).
https://doi.org/10.1038/s41467-024-55251-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#癌症# #真实世界#
4