Nat Commun:东亚人群慢性肾病(CKD)的基因风险位点分析
5小时前 liangying MedSci原创 发表于陕西省
F12基因可能通过调控炎症和血压参与CKD的发病机制。
慢性肾病(CKD)是一种全球范围内影响超过7亿人的重大公共健康问题,其病理机制尚未完全明确。肾功能的遗传变异研究对加速药物研发具有重要意义。然而,目前大规模全基因组关联研究(GWAS)多集中于欧美人群,东亚人群研究严重不足,而台湾等地的CKD患病率居全球之首。因此,本研究旨在利用东亚人群的遗传数据,探索CKD的基因风险位点,为高风险人群的早期筛查与疾病防控提供科学依据。

本研究采用固定效应逆方差加权的荟萃分析方法,整合了来自日本生物库(BBJ, n=143,658)和台湾生物库(TWB, n=101,294)的GWAS数据,共纳入244,952名东亚个体。此外,我们利用TWB独立数据集(n=27,058)进行了复制研究,并在台湾(n=25,345)和英国白人群体(n=260,245)的独立队列中验证了CKD的多基因风险评分(PRS)。基因型数据通过1000基因组项目的东亚参考面板进行推断,并通过功能富集分析和精细定位分析探索相关变异的潜在机制。研究结果以统计学显著性(P<5×10⁻⁸)评估遗传位点的显著性,并使用多种生物信息学工具进行基因功能优先化。
本研究发现了5790个与肾小球滤过率(eGFR)显著相关的SNP位点,其中2140个为首次报道。在97个基因风险位点中,26个位点此前未被报道,包括位于CASP9的rs754331108(P=5.1×10⁻⁴⁵)。通过TWB独立数据集复制,5342个SNP位点中3899个位点方向一致且P<0.05。进一步功能分析显示,eGFR相关SNP显著富集于肾髓质(P=1.01×10⁻⁶)和肾皮质(P=1.26×10⁻⁶),并与尿酸代谢(Bonferroni校正P=2.0×10⁻⁴)等9个关键通路相关。在CMUH数据集中,eGFR相关SNP与CKD和终末期肾病(ESKD)的风险呈负相关(Pearson’s r=-0.94和-0.96,P<0.0001)。此外,PRS在台湾(AUROC=0.788)和英国白人群体(AUROC=0.788)中均能有效区分高风险和低风险个体,并可预测高风险组CKD的发病时间较低风险组提前约8年。
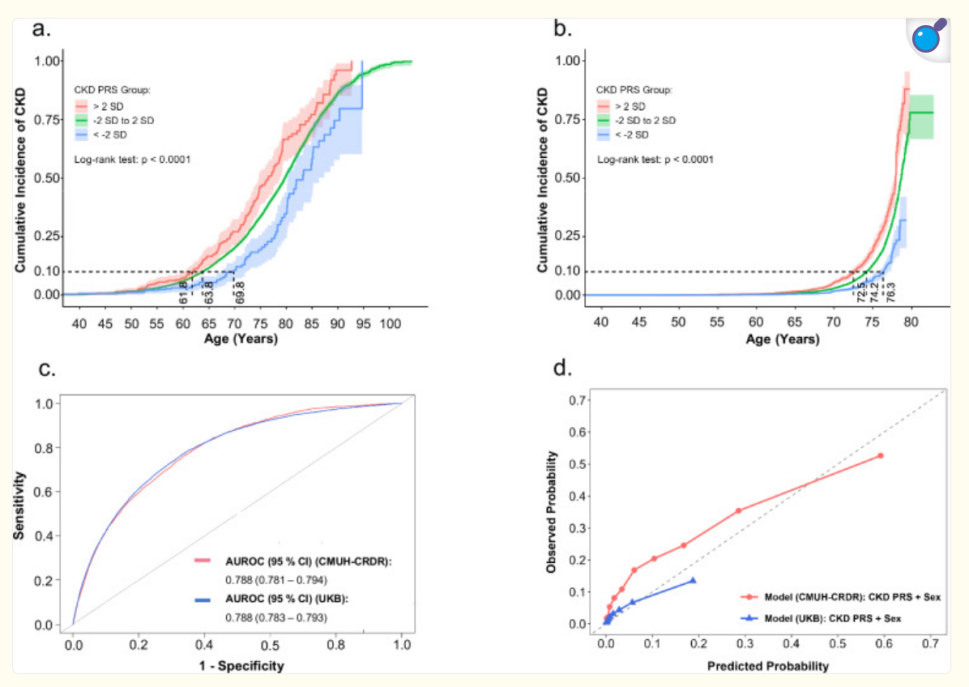
基于PRS分层的CKD累积发生率,使用从CMUH-CRDR获得的台湾数据集和从UKB获得的白色英国数据集
本研究是针对东亚人群的大规模eGFR GWAS研究,揭示了与CKD相关的26个新风险位点,重点发现了F12基因可能通过调控炎症和血压参与CKD的发病机制。PRS分析表明其在CKD早期预防中的潜在价值。这些结果为CKD的遗传风险评估和个性化干预策略提供了新视角,同时强调了增加多样性人群遗传研究的重要性,以实现全球范围内更精准的疾病防控与管理。
原始出处:
Discovery and prioritization of genetic determinants of kidney function in 297,355 individuals from Taiwan and Japan. Nat Commun. 2024 Oct 29;15(1):9317. doi: 10.1038/s41467-024-53516-7. PMID: 39472450; PMCID: PMC11522641.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#遗传数据# #慢性肾病(CKD)#
3