Eur Heart J 曾春雨\陈良龙\余骏逸教授团队发现乙酰化转移酶NAT10通过mRNA ac4C修饰调控血管重构
2024-10-27 论道心血管 论道心血管 发表于上海
该研究发现了乙酰化转移酶NAT10通过mRNA ac4C修饰调控VSMC表型转换、诱导血管重构的功能和分子机制,为RNA修饰在血管重构研究提供了新的理论。
血管重构是血管损伤后重要病理特征,是导致动脉粥样硬化、高血压、血管内再狭窄、心肌梗死等心血管疾病的关键病理过程。血管平滑肌细胞(Vascular smooth muscle cell, VSMC)是血管组织的主要细胞,当受到外界损伤或病理性刺激后,VSMC由收缩表型转分化为增殖分泌表型,异常增殖、迁移导致血管内膜增生。因此,揭示VSMC表型转换的分子机制,将有助于开发血管重构预防和治疗的新靶点。
RNA修饰是表观遗传学的新兴领域,N-乙酰基转移酶10 (N-acetyltransferase 10, NAT10)能够对mRNA进行N4-乙酰胞嘧啶(N4-acetylcytidine, ac4C)修饰,影响mRNA稳定性及蛋白翻译效率。目前,抑制NAT10表达或乙酰化酶功能已被证实在心肌肥大、肿瘤等疾病中具有预防及治疗作用,但其在血管重构中的作用尚未明了。
2024年10月25日,陆军军医大学陆军特色医学中心(大坪医院)、老年心脑血管病教育部重点实验室曾春雨教授、余骏逸副教授和福建医科大学附属协和医院陈良龙教授团队在European Heart Journal期刊上发表题为“NAT10 Promotes Vascular Remodeling via ac4C mRNA Acetylation”的研究论文。该研究发现了乙酰化转移酶NAT10通过mRNA ac4C修饰调控VSMC表型转换、诱导血管重构的功能和分子机制,为RNA修饰在血管重构研究提供了新的理论,揭示mRNA ac4C修饰可作为血管重构相关疾病防治的潜在靶点。

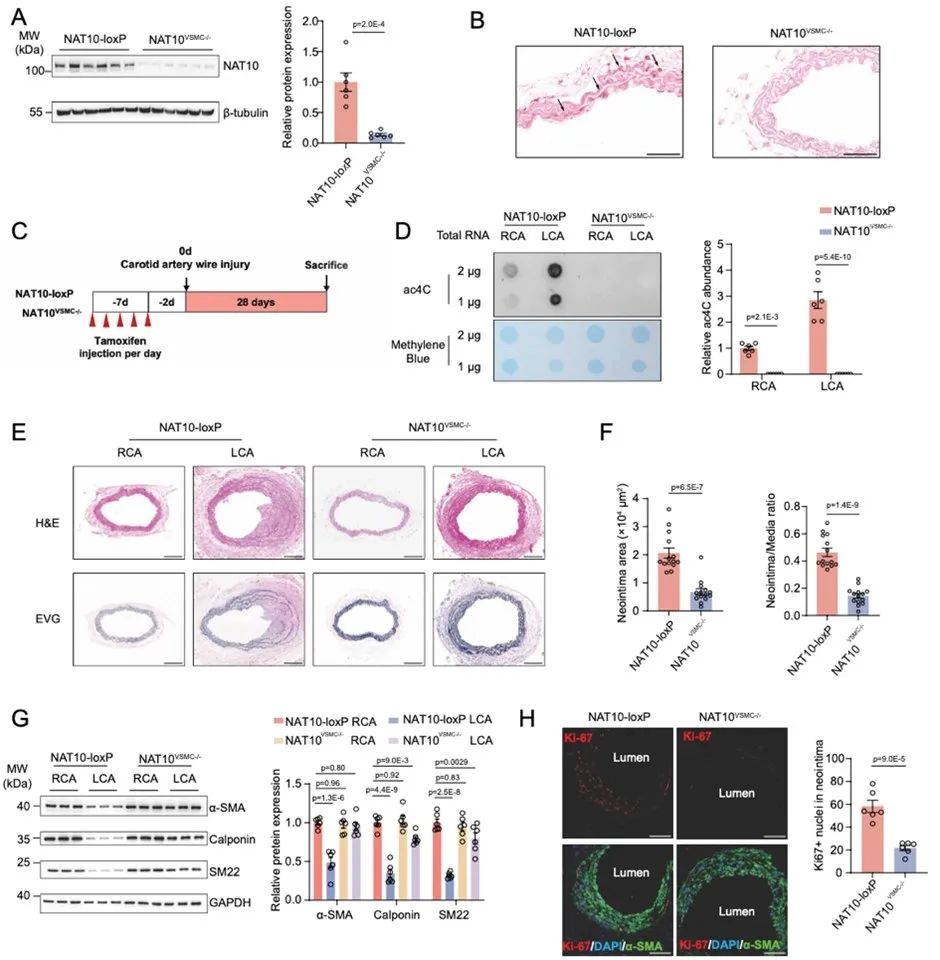
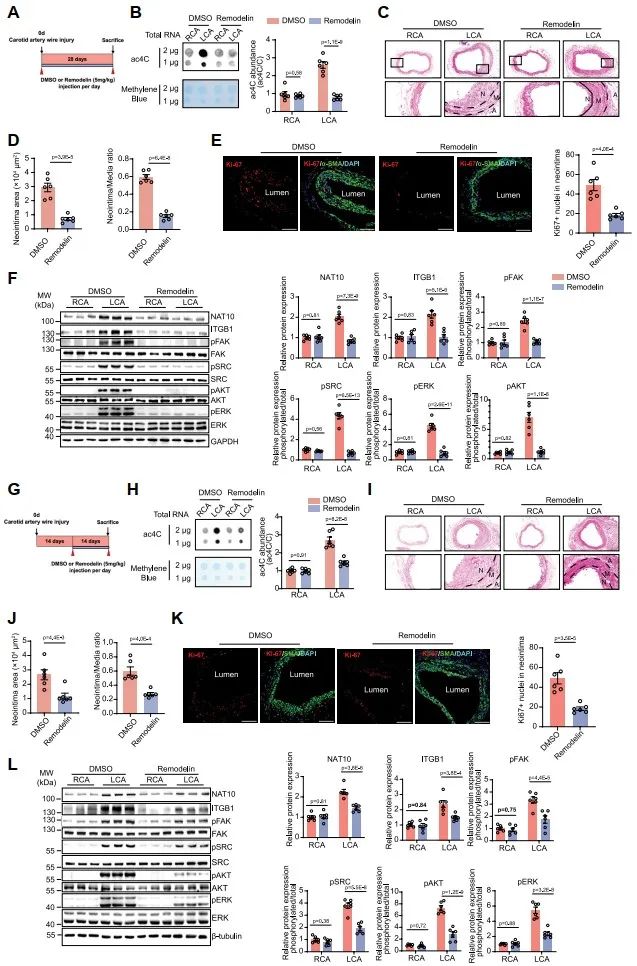
为探究NAT10是否参与血管重构的发生,研究人员首先检测了NAT10在不同血管重构模型中的表达情况,发现NAT10在人动脉粥样硬化样本中的表达显著上调;血管损伤后内膜新生是动脉粥样硬化、支架内再狭窄的重要病理过程,研究者在大鼠颈动脉球囊损伤诱导的血管内膜新生模型中,发现NAT10表达量随着平滑肌收缩蛋白降低而显著上调;该结果同样在小鼠颈动脉导丝损伤诱导的血管内膜新生模型中观察到。此外,在血小板衍生生长因子(PDGF-BB)诱导的VSMC表型转换模型中,NAT10表达亦明显升高。这些发现表明,NAT10上调可能参与VSMC表型转换相关血管重构过程。

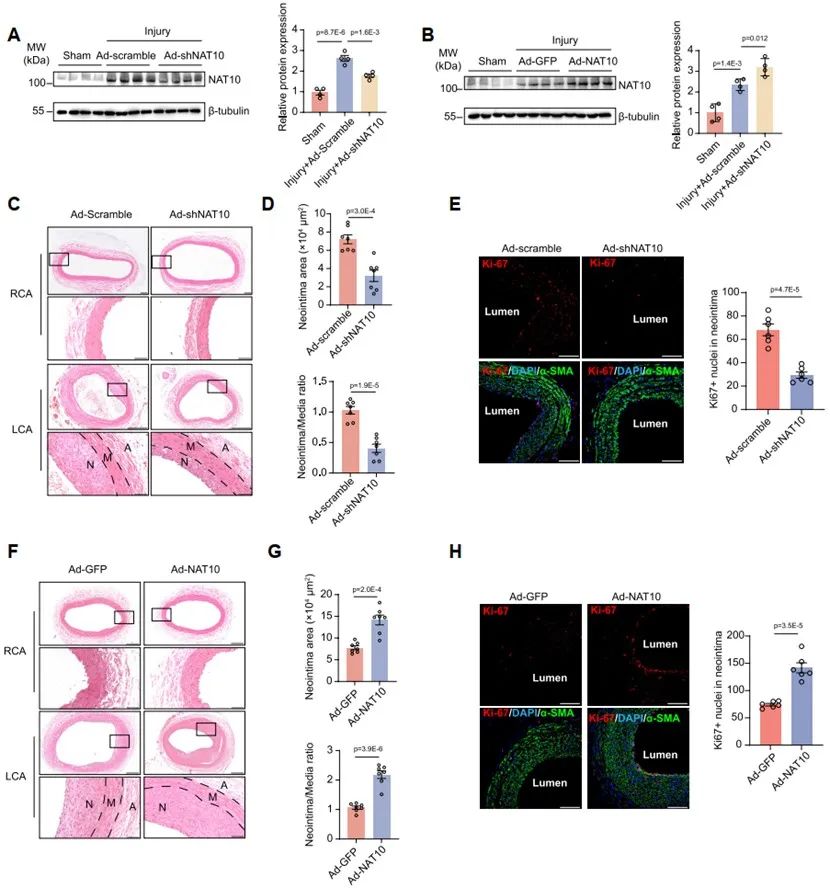
为了进一步明确NAT10在VSMC表型转换及血管重构中的作用,研究人员构建了基于loxP-Cre系统的NAT10平滑肌细胞特异性敲除(NAT10VSMC-/-)小鼠,发现NAT10VSMC-/-小鼠颈动脉组织中NAT10表达及ac4C修饰水平降低,能够显著逆转小鼠颈动脉导丝损伤诱导的平滑肌收缩标志蛋白α-SMA、Calponin、SM22降低,并抑制血管内膜新生。同时,在大鼠颈动脉球囊损伤模型局部孵育NAT10敲降腺病毒,亦可显著减轻球囊损伤诱导的颈动脉内膜新生,而孵育NAT10过表达腺病毒则显著加重颈动脉新生内膜形成,以上动物实验表明NAT10在VSMC表型转换及血管重构中的必要及充分作用。
通过斑点实验(Dot blotting)、高效液相色谱-串联质谱(LC-MS/MS)检测,研究人员证实RNA ac4C修饰水平在人动脉粥样硬化样本、大鼠颈动脉球囊损伤样本、小鼠颈动脉导丝损伤样本及PDGF-BB刺激的VSMC中均显著上调,且与血管新生内膜严重程度正相关。为进一步明确NAT10调控血管新生内膜形成是否依赖其ac4C修饰功能发挥作用,研究人员构建NAT10乙酰化酶结构域突变质粒(G641E),发现消除NAT10乙酰化修饰作用后能够显著抑制其促VSMC表型转换、增殖及迁移的作用。上述结果表明,NAT10需要通过其ac4C修饰功能调控VSMC表型转换、增殖及迁移,从而促进血管新生内膜形成。

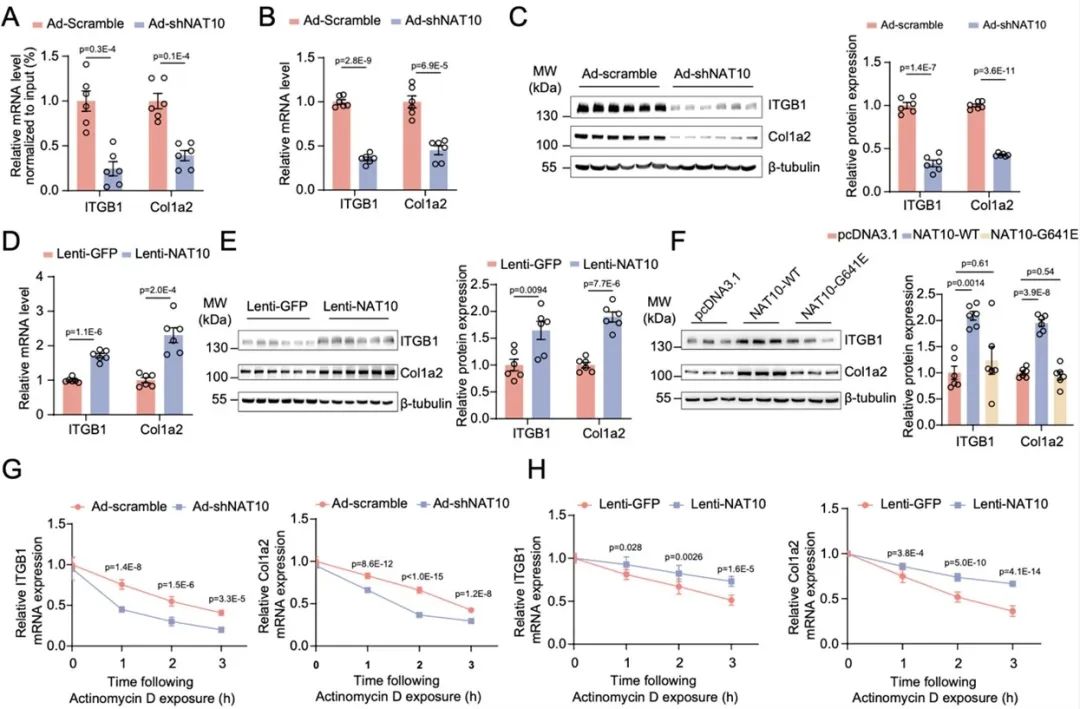
为进一步阐释NAT10通过ac4C修饰调控血管新生内膜形成的分子机制,研究人员使用NAT10敲降腺病毒干预VSMC后,联合使用转录组测序(RNA-seq)、ac4C免疫共沉淀测序(acRIP-seq)及NAT10免疫共沉淀测序(NAT10-RIP-seq),以寻找受NAT10直接调控的下游靶基因。进一步的功能富集分析发现,受ac4C修饰转录本主要富集于细胞增殖、迁移、细胞外基质形成及细胞黏附等VSMC表型转换等生物过程。既往研究报道,NAT10通过mRNA ac4C修饰促进转录本稳定性增加,研究人员通过多组学联合分析聚焦于NAT10敲降后,与NAT10蛋白直接结合、ac4C修饰水平、表达量均下调的转录本,最终富集出十条潜在下游靶基因,其中包括已有报道的在血管重构中发挥重要作用的Itgb1和Col1a2。以Itgb1、Col1a2为例进一步验证,研究人员通过RNA降解实验发现NAT10高表达是通过增加Itgb1和Col1a2 mRNA的稳定性、增加蛋白表达,从而促进血管新生内膜形成。

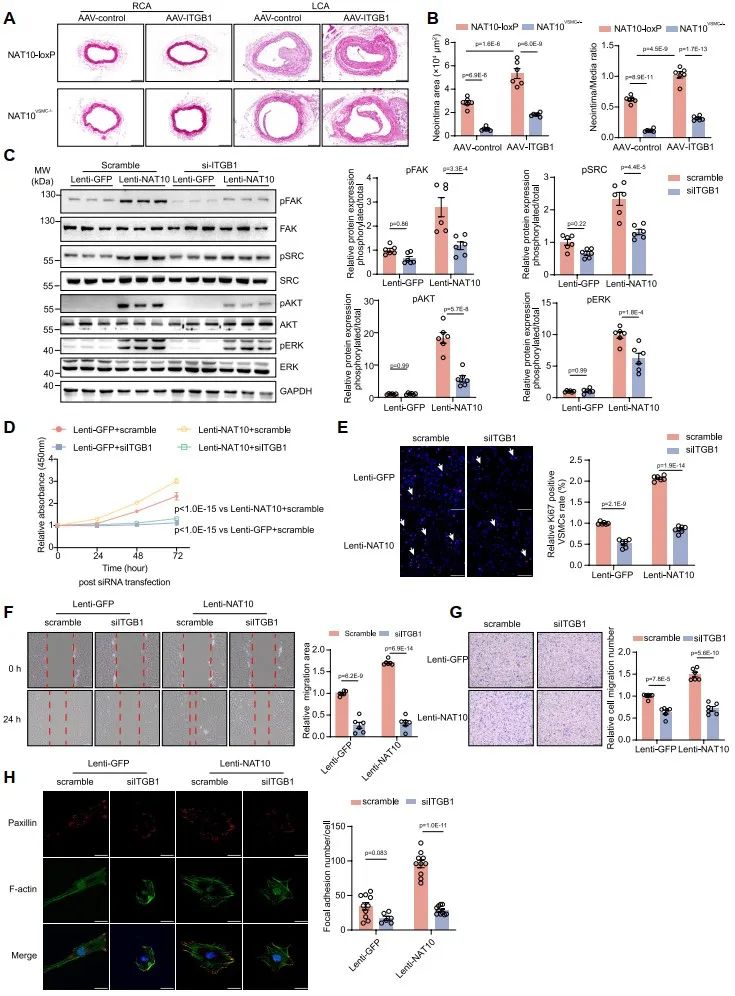
Itgb1基因编码整合素受体β1 (ITGB1),已有研究表明ITGB1作为细胞膜受体与Collagen I、Fibronectin及Laminin等细胞外基质结合后激活下游局灶黏着激酶(FAK)信号通路,促进VSMC表型转换和血管重塑。研究者构建了VSMC特异性ITGB1过表达腺相关病毒(AAV-ITGB1)感染小鼠颈动脉导丝损伤模型,发现VSMC过表达ITGB1后可逆转NAT10VSMC-/-抑制血管内膜新生的作用;细胞实验证实,敲降ITGB1表达后能够抑制NAT10高表达激活的FAK信号通路,从而抑制VSMC增殖、迁移及粘附作用。以上结果表明,NAT10促进VSMC表型转化的作用依赖于ITGB1及其下游FAK信号通路。
更为重要的是,为探索NAT10能否作为血管重构潜在的预防及治疗靶点,研究者分别在小鼠颈动脉导丝损伤同时或损伤后2周给予NAT10选择性抑制剂Remodelin干预,发现Remodelin能够显著抑制血管重构,提示了NAT10作为治疗靶点的转化前景。
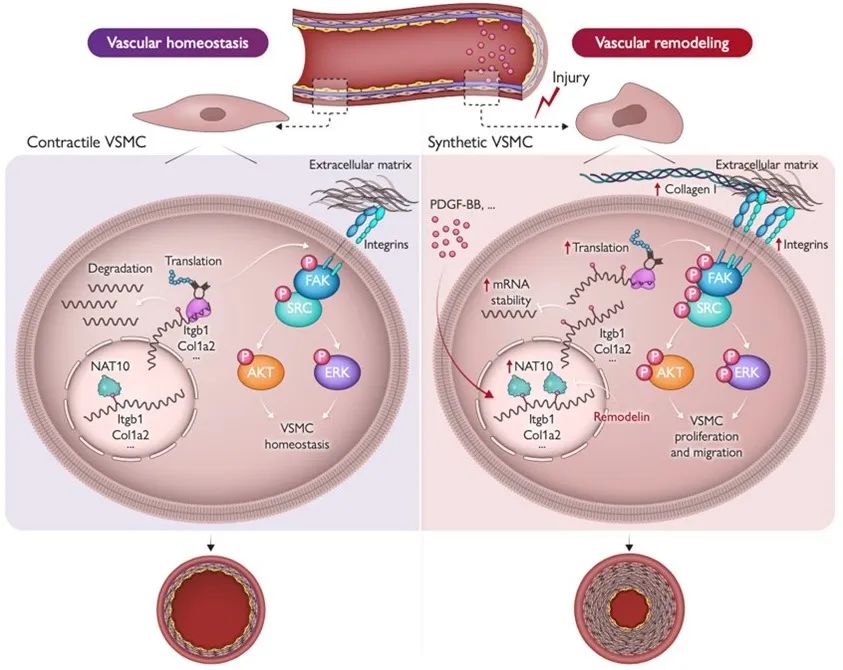
综上所述,本研究揭示了乙酰化转移酶NAT10通过mRNA ac4C修饰促进VSMC表型转换及血管重构的关键作用;绘制了血管重构中VSMC ac4C修饰图谱,并以Itgb1和Col1a2为例阐明NAT10介导VMSC中mRNA ac4C修饰促进VSMC表型转化、加重血管重构的分子机制,从而为血管重构相关疾病的防治提供了潜在新靶点。
陆军军医大学陆军特色医学中心(大坪医院)、老年心脑血管病教育部重点实验室曾春雨教授、余骏逸副教授和福建医科大学附属协和医院陈良龙教授为本文共同通讯作者。福建医科大学附属协和医院心血管内科余程博士、林威鸿硕士和陆军军医大学陆军特色医学中心陈悦博士、罗浩博士和林鑫博士生为本文共同第一作者。该工作得到国家自然科学基金、云南省重大科技项目、福建医科大学附属协和医院优秀青年培养项目、中国科协青年人才托举工程等资助。同时,该研究得到乔治华盛顿大学Pedro A. Jose教授的大力支持。
原文链接:
https://doi.org/10.1093/eurheartj/ehae707
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#血管重构# #乙酰化转移酶#
41