【协和医学杂志】影像学评估青少年儿童骨骼成熟度的应用现状和研究进展
5小时前 协和医学杂志 协和医学杂志 发表于陕西省
本文围绕X线、MRI及超声三种影像学技术评估青少年儿童骨骼成熟度的应用现状和最新研究进展进行综述,以期为临床提供有益指导。
骨骼成熟度是衡量个体发育程度的常用指标,并对未来生长潜力具有一定预测能力。骨龄(bone age)是骨骼成熟度的量化指标,比实际年龄(calendar age)可更清楚指示个体向成熟变化的发展进程[1]。临床上通常认为骨龄是一种定性而非定量的评估方法,可快速辅助临床医生判断性早熟或延迟,为了解青少年儿童个体发育情况提供有价值的诊断信息。
骨龄可借助多种影像学方法实现可视化,其中以骨龄X线片最为经典,其通过图像归纳法、计数法、计算机识别等方法测算骨龄。由于X线检查具有电离辐射,临床应用具有一定局限性,近年来MRI、超声、人工智能(AI)技术逐渐应用于骨骼成熟度的评估中,并衍生了相应的分期法和自动化识别系统,为临床医生评估青少年儿童生长发育状况提供了重要参考信息。本文围绕X线、MRI及超声三种影像学技术评估青少年儿童骨骼成熟度的应用现状和最新研究进展进行综述,以期为临床提供有益指导。
1 X线
1.1
手腕部X线片
X线检查是目前临床上最常用的骨龄测定方法,拍摄非优势侧手腕部X线片(即骨龄片)后,可通过计数法、图谱法或计分法评估个体骨骼发育水平[2],具有检查耗时短、技术普及率高、价格低等优势。
其中计数法是最早出现的读片方法。1926年美国Todd医生提出了腕部骨化中心计数法,即“骨龄=腕部骨化中心数目-1”,但此法受限于腕部骨化中心数目,仅适用于8岁以下儿童,且测定结果误差极大,目前基本已被临床所淘汰。
图谱法是先归纳各个年龄段正常发育儿童的手腕骨特征,制订出标准骨龄图谱,然后将个体的骨龄片与标准图谱进行对比,以获得其骨龄值。最早的骨龄图谱为Greulich-Pyle(GP)法,由美国医生Greulich和Pyle于1959年制定,该图谱收录了1931—1942年美国俄亥俄州正常儿童的骨龄片,年龄范围覆盖1~18岁女性及1~19岁男性,针对每个年龄段儿童收集100张X线片,并从中选取最具代表性的图片制定图谱[3]。
GP图谱法具有简洁、评估快速的优势,是国际上临床和放射科医生最常用的骨龄评估方法,但实际应用过程中的准确性在不同国家存在较大差异,这可能与不同地域人群的基因异质性、营养状况、社会经济水平等因素不同有关[3]。
计分法是先选定手腕骨的感兴趣区(ROI),然后给每个ROI的骨骼发育水平赋予一个数字评分,所有区域评分之和为总成熟度得分,最后与作为正常对照的骨成熟度评分中位数曲线进行比对,即可得到个体的骨龄数据[4]。Tanner-Whitehouse(TW)法是计分法的经典代表,由英国伦敦大学的Tanner和Whitehouse于1962年首次提出,相较于需要主观判断的GP图谱法,TW记分法更具客观性和可重复性,但平均耗时较长,约为GP图谱法的5.6倍。
由于后续观察到性早熟和肥胖儿童的桡骨、尺骨、掌指骨(RUS)较正常同年龄儿童发育更早,而生长发育迟缓者腕骨(carpal)成熟较晚,故针对不同营养状况的儿童分别进行评分具有必要性,并衍生出TW3法(包括TW3-RUS和TW3-C)[5]。
考虑到不同国家和民族人群骨骼发育上的差异性,我国研究者在TW3计分法的基础上,于20世纪90年代采集了5个城市、2万余名青少年儿童的生长发育资料,制定了《中国人手腕骨发育标准》(简称CHN标准),其更加符合中国儿童的骨龄评定标准,但对10~17岁青少年男性和12~14岁女性测得的骨龄仍大于实际年龄1岁或1岁以上。结合我国本土情况,2006年国内建立了《中国人手腕骨发育标准-中华05》,该法采用世界卫生组织生长发育曲线制定方法,将骨龄与实际年龄差值的平均值或中位数缩小至0附近,对骨龄的测定更加准确[6-8]。
1.2 其他部位X线片
除腕骨外,人体其他部位的骨骼成熟度亦可为青少年发育情况的评估提供一定线索。20世纪中期,整形外科医生Risser应用X线片观察髂骨骨骺的发育情况,并提出Risser征分期系统用以评估骨骼成熟度[9]。由于骨盆的骨骺一般在长骨骨骺闭合后仍有发育空间,因此该分期对于青春中晚期青少年骨龄的评估更有价值,可作为14~18岁青少年骨龄评估的参考指标。
在全身所有关节中,锁骨的次级骨化中心出现与骨骺愈合时间较晚,因此亦可用于青少年骨龄的评估。2004年,Schmeling等[10]通过观察16~30岁人群的胸部X线片,提出锁骨骨骺发育的5个分期,但在此群体中男性和女性最早在16岁时出现的锁骨分期均为3期,且在此年龄范围内几乎观察不到2期及以下人群,提示锁骨骨骺分期的年龄跨度大、精度低。其他长骨关节如膝关节、肘关节等部位的X线检查因增加辐射暴露量,目前逐渐被MRI和超声技术所代替。
1.3 X线片测定骨龄前沿进展
近十余年来,AI技术快速崛起,并在骨龄评估方面的应用价值受到越来越多的关注,其基本原理是计算机自动识别手腕骨图像,对ROI进行自动分割和勾画,将测量参数与标准数据库对比继而获取对应的骨龄。相较于人工评估法,AI技术评定骨龄快捷、方便、耗时短,且可避免评估者之间和评估者内部的主观性和异质性,准确率更高。
BoneXpert系统是全球第一款AI全自动骨龄评估系统,可特征性提取并分析左手X线片13块骨骼的形态以自动化测定骨龄,具有标准化和精确的阅片方法,能够克服人工阅片的主观性,显著提升骨龄测定的准确率,于2009年在欧洲获得许可后,如今已实现全球商业化推广。既往研究显示,BoneXpert系统评定骨龄具有较好的精确度、准确性和高效性,并可辅助个体最终身高的预测[11-12]。
随着深度学习(deep learning)技术的不断迭代,卷积神经网络(CNN)以其强大的图像识别和预测能力,在医学影像领域脱颖而出[13]。为提升更加复杂X线片图像的检测和分割能力,2023年Yang等[14]提出一种多尺度多接收注意力网络(MMANet),其可增强对关键区域特征的识别能力,抑制背景区域的干扰,实现最先进的图像分析性能,进一步提高了骨龄测定的准确性。但也有研究指出,基于深度学习的AI技术测定青少年骨龄的准确性在不同性别和年龄之间差异较大,需加以校正[15]。
因此,笔者认为AI技术为青少年骨龄的测定提供了一种更加客观、便捷的方法,在减轻临床医师工作量的同时可提高效率和测定准确性,具有巨大的应用潜力,但由于AI图像识别受限于前期图像标识工作的准确性,目前尚缺乏大样本高质量图像标识数据库,因此其大范围推广应用尚面临挑战。
2 MRI
2.1 手腕部MRI
虽然手腕骨X线片在临床应用最为广泛,是测定骨龄的金标准,但其存在一定的电离辐射,且适用对象年龄范围多集中于手腕骨尚未完全发育成熟的阶段,如儿童期及青春早期。MRI技术无电离辐射,对软组织成像效果好,可清晰展现骨骺软骨板的形态,且GP图谱法在MRI图像上亦具有良好的适用性,提示MRI有望成为评估骨骼成熟度的一种更加安全的新选择。
Widek等[16]应用GP图谱法评估了238名13~21岁青少年男性MRI图像的手腕骨骨龄,发现GP骨龄与实际年龄具有较好的一致性,且评估者内部的一致性良好;但该研究发现,使用MRI图像解读出的GP骨龄易造成青少年儿童的实际年龄被低估。
Urschler等[17]指出,X线图像的投影性质可在骨骺板区域出现叠加,而MRI图像对软组织成像性能更佳,以致X线片比非叠加的MRI图像评估的骨龄分期更高,提示有必要建立更适合MRI成像特点的骨龄阅片新方法。
Tomei等[18]招募了179名健康的青少年儿童,通过观察不同年龄儿童手腕骨MRI软骨外观、软骨空泡化、软骨初步钙化、进展性骨化、完全骨化的特征和程度,建立了计算MRI手腕骨骨龄的视觉评分法,经验证可获得与实际年龄具有良好相关性的骨龄数据,为青少年骨龄的测量提供了新选择。
2.2 膝关节MRI
2.2.1 评估骨龄
人体不同部位的骨化中心发育并非完全同步,手腕骨发育接近成熟的年龄约为女孩14岁、男孩16岁,而膝关节的胫骨、股骨骨骺的完全闭合时间则明显延迟。美国一项纳入859名受试者的研究显示,女性与男性胫骨近端骨骺完全闭合的中位年龄分别为16.2岁、18.0岁,腓骨骨骺完全闭合的中位年龄分别为16.75岁、18.1岁,股骨远端骨骺完全闭合的中位年龄分别为17.1岁、18.7岁[19]。由此可见,股骨远端骨骺是全身骨骼最晚闭合的部位,其一旦完全闭合,则意味着停止生长、身高不再变化[20]。因此,膝关节部位骨骺形态学变化贯穿于整个青春期,尤其在评价青春中后期儿童发育及骨骼成熟程度方面发挥重要作用。
现有的MRI用于评估骨骼成熟度的方法包括分期法、图谱法及图像测量法。MRI分期法最早应用于法医领域,近年来逐渐用于临床评估骨骼成熟度,其根据MRI图像下骨骺细线的特征和厚度,将骨骼成熟度划分为不同的阶段,目前共有6种不同的分期方法(表1)[21]:
(1)Jopp分期法[22];(2)Dedouit分期法[20];(3)Scheling & Kellinghaus分期法[23];(4)Vieth分期法[24];(5)Dedouit,Kellinghaus和Schmeling修正版分期法[25];(6)Schmeling分期法[26]。
表1 膝关节MRI分期特征
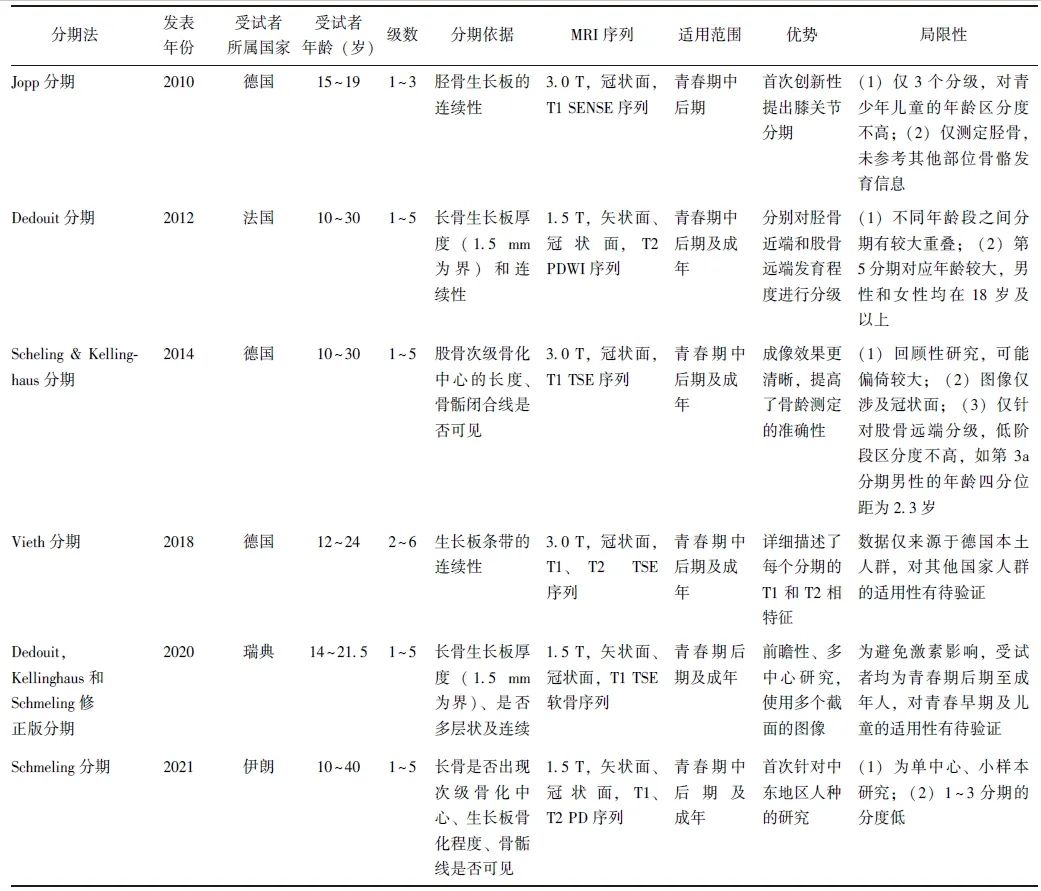
通过横向对比,有研究认为Scheling和Kellinghaus分期法最具简洁性和临床适用性[27]。与X线GP图谱法类似,美国一项研究收集年龄为12~24岁的344名男性和350名女性的膝关节MRI图像资料,对照年龄和膝关节图像特征建立了各年龄段青少年的标准骨龄图谱,且经统计学分析验证,膝关节MRI骨龄图谱与个体实际年龄的相关性极高(r=0.978, P<0.001)[19]。
该研究还对9~15岁女性、11~17岁男性的骨性标志进行总结并形成简化版膝关节MRI图谱,经验证与手腕骨X线GP图谱相比,简化版膝关节MRI图谱无论在阅片一致性、简洁性,还是准确性方面均有明显优势[27]。由于MRI的软组织成像效果及分辨率均明显优于X线,近年来不断涌现MRI的图像测量方法和技术,可测量长次级骨化中心生长板的形态学,应用于身高生长速度和终身高的预测。
2.2.2 预测生长速度和终身高
动物研究显示,骨骺软骨由柱状软骨细胞组成,柱状细胞越高则长骨生长速度越快;当骨骼接近成熟时,柱状结构的高度降低,软骨内逐渐骨化,细胞数量减少,以致生长空间减小[28-30]。因此,组成膝关节长骨骨骺的宽度、骨骺闭合的程度可反映骨骼成熟度,且骨骼生长速度和终身高相关。
以此理论为基础,Bai等[31]对Dedouit分期进行简化,并将青少年膝关节部位的长骨生长板发育情况分为生长板未闭合组、生长板少量闭合组、生长板接近愈合组;对接受重组人生长激素治疗的青春中晚期矮小身材人群随访后发现,简化的膝关节生长板Dedouit分期可预测其6个月生长速度和身高增量。
除T1WI和T2WI等传统序列外,Barrera等[32]研究发现,青少年股骨远端骨骺的MRI弥散张量成像(DTI)参数与生长速度亦具有正相关性。Jaramillo等[33]基于DTI测量了70名青少年儿童膝关节长骨的纤维束体积(tract volume),并结合随访数据建立了终身高的预测模型,此模型在交叉验证中未出现显著偏倚(P=0.51),较其他模型具有更强的稳健性。
MRI图像测量法具有直观、精准、应用性强等优势,但一些图像干扰因素,如运动尾影、可疑的人工假象、拍摄技术限制等,可能导致图像测量出现偏差。总体而言,MRI在骨骼成熟度评估及生长预测方面具有突出优势,但目前相关研究仍较匮乏,尤其缺少大样本队列研究,其应用价值有待进一步探索。
3 超声
超声是一种无创、无电离辐射、操作简便且价格低的检查方法,在临床广泛应用于多种疾病的辅助诊断和病情监测。超声波扫查可捕捉骨骼的高回声骨化中心、显示骨化中心的数目及骨骺宽度占骨干的比率,有望代替X线应用于骨龄的评估。
2003年Bilgili等[34]总结了超声图像下的手腕骨发育规律,并以X线GP图谱为参照建立了0~6岁健康儿童的超声GP骨龄图谱,经验证手腕骨超声图谱评估的骨龄与X线GP图谱和实际骨龄高度相关,84.4%的男性和88.5%的女性骨龄与实际年龄相差6个月以内。在GP图谱比对法的基础上,Torenek A irman等[35]将青少年儿童的手腕骨依次进行标号,对超声图像下每块手腕骨的发育情况进行评分,并将全部手腕骨评分相加获得总分,结果显示超声骨龄与实际年龄及传统的X线GP图谱法骨龄均具有较高的相关性。
irman等[35]将青少年儿童的手腕骨依次进行标号,对超声图像下每块手腕骨的发育情况进行评分,并将全部手腕骨评分相加获得总分,结果显示超声骨龄与实际年龄及传统的X线GP图谱法骨龄均具有较高的相关性。
考虑到骨骼成熟是一个连续的过程,Wan等[36]通过测量手腕骨骨化中心的直径(d)和骨骺直径(D)的比值(d/D)以呈现骨骼生长的连续过程,经与实际年龄相拟合,发现二者的相关性极高;后续以此建立中国武汉地区1~19岁青少年儿童的超声骨龄测定方法,并进一步将测量部位扩展至尺骨、桡骨、股骨和胫骨,从而有利于在更短的时间内获得和骨龄相关性更强的全身骨骼成熟系数[37];结果显示,桡骨、尺骨、股骨的超声测量系数总和与X线TW法测得的骨龄相关系数最高(r男性=0.97,r女性=0.96),且采集图像和测量共用时(2.6±0.6)min,较X线TW法更快捷。
由于d/D比值法在其他种族人群中缺乏标准参考,而TW3骨龄法在多个种族中建立了标准百分位图,基于此Lv等[38]将二者建立等效转换关系,建立了超声TW3骨龄法(USTW3 BA),该法测定骨龄平均用时(3 ±2)min,且结果与X线TW3法测量的骨龄差异无统计学意义(P=0.97)。
此外,MRI和US双模态影像方法也可应用于年龄及骨龄的评估。Herrmann等[39]在研究中纳入了33名14.4~19.3岁的健康男性,对其超声和MRI图像分别评估分期后发现,超声骨龄分期的年龄组间重合度更低、区分度更高、耗时更短。
整体而言,超声作为简便且安全的影像学方法,具有良好的临床应用价值和研究前景,尤其在青春期儿童骨骼生长的长期密切监测方面具有极大优势[40],且在医疗资源匮乏地区扮演着重要角色[41]。Nicholas等[42]利用平板式超声仪测量了厄瓜多尔农村儿童的骨龄并评估其与人体测量指标及饮食的关系,从而为贫困地区青少年生长发育的评估提供了便捷的操作方法。但目前该领域尚处于探索阶段,未来研究应重点关注超声标准切面的规则制定和规范化专科医师培训,以促进该检查的大规模推广应用。
4 小结与展望
骨龄是儿童内分泌领域重要的生物学指标,采用准确、安全、便捷的检查方法测定骨龄,有助于密切监测青少年儿童的发育进程,结合身高、实际年龄、性发育等方面资料,可为内分泌疾病的早期诊断及病因分析提供重要线索。本文对X线、MRI及超声在骨龄评估中的效能及其优缺点进行了总结(表2)。
表2 三种影像学技术测定青少年儿童骨龄的优缺点
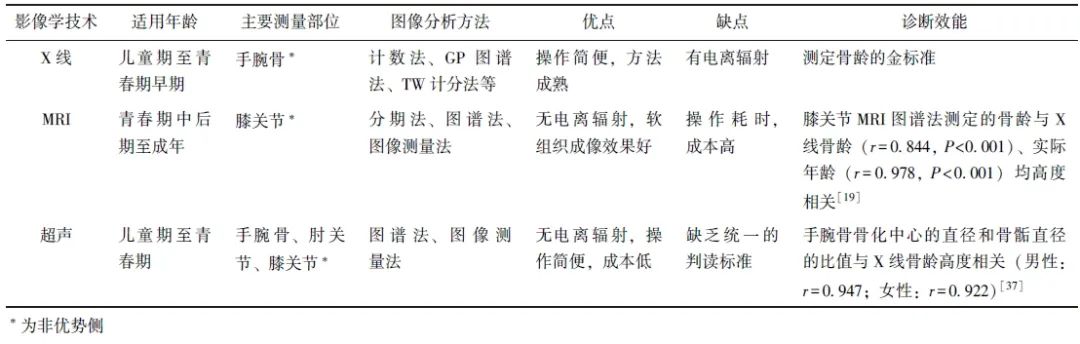
总体而言,X线检查是儿童和青少年早期评估骨龄的首选方法。此阶段手腕骨发育尚未完全,骨化中心的数量和形态可提供丰富的临床信息。结合AI技术后,X线图像识别能力显著提升。然而,由于X线检查存在低剂量的电离辐射,因此不宜频繁使用,除非有特殊需要外,通常建议每半年或1年检查一次。
对于青春期中后期的群体,由于此时手腕骨发育趋于成熟,且处于第二次生长高峰期,生长窗口缩短,X线手腕骨检查在骨龄识别方面的精确度降低,半年一次的检查可能错过生长窗口。因此,建议采用膝关节MRI检查,以便更直观地反映长骨生长板的剩余生长空间。
由于MRI无电离辐射,且对生长板软组织成像更加清晰,不仅能测定骨龄,还可预测生长速度和最终身高,但由于费用较高,检查耗时长,广泛推广的难度较大。超声成像技术可避免X线的辐射风险,且具有成本低、耗时短的优点,在儿童骨龄监测中具有极大应用潜力,是骨骼影像学研究的热点。研究者仍需开展高质量研究,以进一步完善超声评估骨龄的标准,推动其规范化应用。
参考文献
[1]Lazar L, Phillip M. Pubertal disorders and bone maturation[J]. Endocrinol Metab Clin North Am, 2012, 41(4): 805-825.
[2]周星旭, 袁红梅. 影像学方法评估骨龄的现状及研究进展[J]. 国际儿科学杂志, 2023, 50(12): 837-840.
[3]Dahlberg P S, Mosdøl A, Ding Y P, et al. A systematic review of the agreement between chronological age and skeletal age based on the Greulich and Pyle atlas[J]. Eur Radiol, 2019, 29(6): 2936-2948.
[4]Subramanian S, Viswanathan V K. Bone age[M/OL]//StatPearls[Internet]. Treasure Island: StatPearls Publish-ing, 2023: NBK537051[网络访问日期缺失]. https://pubmed.ncbi.nlm.nih.gov/30725736/.
[5]Prokop-Piotrkowska M, Marszałek-Dziuba K, Moszczyńska E, et al. Traditional and new methods of bone age assessment-an overview[J]. J Clin Res Pediatr Endocrinol, 2021, 13(3): 251-262.
[6]彭丽珍, 陈俊杰, 顾林, 等. 中华05法和G-P图谱法在儿童青少年骨龄评估中的效果对比研究[J]. 影像研究与医学应用, 2022, 6(20): 86-88.
[7]张绍岩, 马振国, 沈勋章, 等. 中国人手腕骨发育标准-中华05.Ⅳ.中国儿童手腕骨发育特征[J]. 中国运动医学杂志, 2007, 26(4): 452-455.
[8]潘其乐, 张洪, 周慧康, 等. Greulich-Pyle图谱法、CHN法和中华05法评估儿童青少年骨龄的比较[J]. 中国组织工程研究, 2021, 25(5): 662-667.
[9]程龙龙, 汤鹏, 罗方亮, 等. 应用医学影像学技术评定骨龄的研究进展[J]. 中国法医学杂志, 2019, 34(1): 62-66.
[10]Schmeling A, Schulz R, Reisinger W, et al. Studies on the time frame for ossification of the medial clavicular epiphyseal cartilage in conventional radiography[J]. Int J Legal Med, 2004, 118(1): 5-8.
[11]Thodberg H H. Clinical review: an automated method for determination of bone age[J]. J Clin Endocrinol Metab, 2009, 94(7): 2239-2244.
[12]Thodberg H H, Jenni O G, Caflisch J, et al. Prediction of adult height based on automated determination of bone age[J]. J Clin Endocrinol Metab, 2009, 94(12): 4868-4874.
[13]张义, 朱文文, 李凯, 等. 人工智能在儿童骨龄影像评估的应用进展[J]. 中华放射学杂志, 2023, 57(4): 420-423.
[14]Yang Z C, Cong C, Pagnucco M, et al. Multi-scale multi-reception attention network for bone age assessment in X-ray images[J]. Neural Netw, 2023, 158: 249-257.
[15]Beheshtian E, Putman K, Santomartino S M, et al. Generalizability and bias in a deep learning pediatric bone age prediction model using hand radiographs[J]. Radiology, 2023, 306(2): e220505.
[16]Widek T, Genet P, Ehammer T, et al. Bone age estimation with the Greulich-Pyle atlas using 3T MR images of hand and wrist[J]. Forensic Sci Int, 2021, 319: 110654.
[17]Urschler M, Krauskopf A, Widek T, et al. Applicability of Greulich-Pyle and Tanner-Whitehouse grading methods to MRI when assessing hand bone age in forensic age estimation: a pilot study[J]. Forensic Sci Int, 2016, 266: 281-288.
[18]Tomei E, Sartori A, Nissman D, et al. Value of MRI of the hand and the wrist in evaluation of bone age: preliminary results[J]. J Magn Reson Imaging, 2014, 39(5): 1198-1205.
[19]Pennock A T, Bomar J D, Manning J D. The creation and validation of a knee bone age atlas utilizing MRI[J]. J Bone Joint Surg Am, 2018, 100(4): e20.
[20]Dedouit F, Auriol J, Rousseau H, et al. Age assessment by magnetic resonance imaging of the knee: a preliminary study[J]. Forensic Sci Int, 2012, 217(1/3): 232.e1-232.e7.
[21]Ording Muller L S, Adolfsson J, Forsberg L, et al. Magnetic resonance imaging of the knee for chronological age estimation-a systematic review[J]. Eur Radiol, 2023, 33(8): 5258-5268.
[22]Jopp E, Schröder I, Maas R, et al. Proximale tibiaepiphyse im magnetresonanztomogramm: Neue Mglichkeit zur Altersbestimmung bei Lebenden?[J]. Rechtsmedizin, 2010, 20(6): 464-468.
[23]Krämer J A, Schmidt S, Jürgens K U, et al. Forensic age estimation in living individuals using 3.0T MRI of the distal femur[J]. Int J Legal Med, 2014, 128(3): 509-514.
[24]Vieth V, Schulz R, Heindel W, et al. Forensic age assessment by 3.0T MRI of the knee: proposal of a new MRI classification of ossification stages[J]. Eur Radiol, 2018, 28(8): 3255-3262.
[25]Kvist O F, Dallora A L, Nilsson O, et al. Comparison of reliability of magnetic resonance imaging using cartilage and T1-weighted sequences in the assessment of the closure of the growth plates at the knee[J]. Acta Radiol Open, 2020, 9(9): 2058460120962732.
[26]Daghighi M H, Pourisa M, Javanpour-Heravi H, et al. Application of knee MRI in forensic age estimation: a retrospective cohort[J]. Radiography (Lond), 2021, 27(1): 108-114.
[27]Politzer C S, Bomar J D, Pehlivan H C, et al. Creation and validation of a shorthand magnetic resonance imaging bone age assessment tool of the knee as an alternative skeletal maturity assessment[J]. Sports Med, 2021, 49(11): 2955-2959.
[28]Seinsheimer F 3rd, Sledge C B. Parameters of longitudinal growth rate in rabbit epiphyseal growth plates[J]. J Bone Joint Surg Am, 1981, 63(4): 627-630.
[29]Buckwalter J A, Mower D, Ungar R, et al. Morphometric analysis of chondrocyte hypertrophy[J]. J Bone Joint Surg Am, 1986, 68(2): 243-255.
[30]Farnum C E, Lee R, O'Hara K, et al. Volume increase in growth plate chondrocytes during hypertrophy: the contribution of organic osmolytes[J]. Bone, 2002, 30(4): 574-581.
[31]Bai X, Zhou Z B, Guo X Y, et al. Magnetic resonance imaging of knees: a novel approach to predict recombinant human growth hormone therapy response in short-stature children in late puberty[J]. World J Pediatr, 2024, 20(7): 723-734.
[32]Barrera C A, Bedoya M A, Delgado J, et al. Correlation between diffusion tensor imaging parameters of the distal femoral physis and adjacent metaphysis, and subsequent adolescent growth[J]. Pediatr Radiol, 2019, 49(9): 1192-1200.
[33]Jaramillo D, Duong P, Nguyen J C, et al. Diffusion tensor imaging of the knee to predict childhood growth[J]. Radiology, 2022, 303(3): 655-663.
[34]Bilgili Y, Hizel S, Kara S A, et al. Accuracy of skeletal age assessment in children from birth to 6 years of age with the ultrasonographic version of the Greulich-Pyle atlas[J]. J Ultrasound Med, 2003, 22(7): 683-690.
[35]Torenek Agirman K, Bilge O M, Milo g lu Ö. Ultrasono-graphy in determining pubertal growth and bone age[J]. Dentomaxillofac Radiol, 2018, 47(7): 20170398.
[36]Wan J, Zhao Y, Feng Q Q, et al. Potential value of conventional ultrasound in estimation of bone age in patients from birth to near adulthood[J]. Ultrasound Med Biol, 2019, 45(11): 2878-2886.
[37]Wan J, Zhao Y, Feng Q Q, et al. Summation of ossification ratios of radius, ulna and femur: a new parameter to evaluate bone age by ultrasound[J]. Ultrasound Med Biol, 2020, 46(7): 1761-1768.
[38]Lv P, Zhang C. Tanner-Whitehouse skeletal maturity score derived from ultrasound images to evaluate bone age[J]. Eur Radiol, 2023, 33(4): 2399-2406.
[39]Herrmann J, Säring D, Auf Der Mauer M, et al. Forensic age assessment of the knee: proposal of a new classification system using two-dimensional ultrasound volumes and comparison to MRI[J]. Eur Radiol, 2021, 31(5): 3237-3247.
[40]Daneff M, Casalis C, Bruno C H, et al. Bone age assessment with conventional ultrasonography in healthy infants from 1 to 24 months of age[J]. Pediatr Radiol, 2015, 45(7): 1007-1015.
[41]Dillman J R, Ayyala R S. Point-of-care bone age evaluation: the increasing role of US in resource-limited populations[J]. Radiology, 2020, 296(1): 170-171.
[42]Nicholas J L, Douglas K E, Waters W, et al. US evaluation of bone age in rural Ecuadorian children: association with anthropometry and nutrition[J]. Radiology, 2020, 296(1): 161-169.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









前往app查看评论内容
3 0