Labrune综合征:伴钙化与囊变的脑白质病(LCC)
2024-11-01 神经科学论坛 神经科学论坛 发表于上海
本文介绍伴钙化与囊变的脑白质病(LCC),包括临床表现、发病机制、影像学特征、诊断及鉴别诊断等,目前缺少病因治疗以对症为主,抗 VEGF 药物可能带来希望。
论坛导读:伴钙化与囊变的脑白质病(leukoencephalopathy with cerebral calcifications and cysts,LCC)由Labrune等于1996年首次报道,以影像学出现多发颅内钙化、囊变及脑白质病变三联征为主要特点,又称之为Labrune综合征,是一种罕见疾患,文献报道不足100例,国内学者报道了不足10例成人病例,其中仅个别病例于儿童期发病。
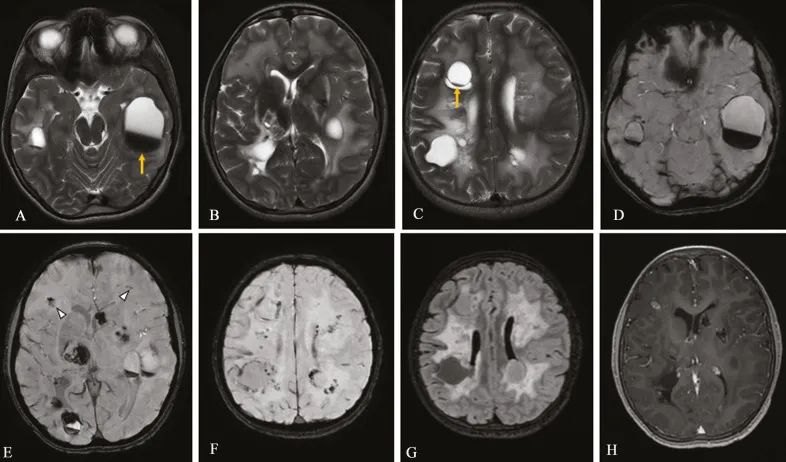
一个9岁男孩,因癫痫发作障碍和左上肢和下肢渐进性无力3年而就诊。癫痫发作为全身强直阵挛性发作,每月1-2次,无任何先兆。左侧轻偏瘫是渐进性发作,在病程中缓慢进行,已经严重到足以影响其日常运动活动,并与学习成绩差有关。他的家族中没有类似的病史。检查时,左上肢和下肢肌力为3级(MRC分级)。MRI显示双侧大脑半球的皮质下和深部白质中存在大小不等的囊肿。这些囊肿很少显示内出血,并伴有液体出血。磁敏感加权成像显示双侧基底神经节、囊肿壁和双侧半卵圆中心少量钙化。结节状强化出现在实质内较小的钙化区域。此外,弥漫性和不对称的T2/FLAIR高信号累及脑室周围和深部白质,不影响胼胝体和后颅窝结构。非增强CT证实了双侧基底节区结节状钙化的密集聚集。在双侧大脑半球的灰质-白质连接处发现了一些曲线状的、微弱的、脸红样的钙化。(J Pediatr Neurosci. 2021 Oct-Dec;16(4):277-280.)
伴钙化与囊变的脑白质病(leukoencephalopathy with cerebral calcifications and cysts,LCC)是一种罕见的,以脑内深部核团广泛钙化、脑实质内囊肿形成及脑白质异常改变为特征的综合征。LCC临床表现为一种进行性退变过程,文献报道发病年龄自1月龄至70岁不等,无明显性别差异,临床症状与颅内病变的部位和程度有关,主要包括肌张力障碍、肢体瘫痪、癫痫发作、共济失调和认知障碍等,脑内有大囊变者可出现视乳头水肿等颅高压征象。
LCC发病机制尚未明确,可能与以下因素有关:(1)微血管弥漫性血管瘤样发育异常,引起脑组织慢性缺氧,进而导致白质脑病、胶质增生、钙盐沉积和脑实质囊变;(2)微血管病变、脑白质脱髓鞘及水肿等多种发病机制共存。LCC病理改变包括:(1)微血管血管瘤样改变;(2)脑实质白质肿胀、胶质增生、钙盐沉积及Rosenthal纤维形成;(3)血管壁纤维素样坏死,管腔狭窄及血栓形成;(4)血管周围及脑实质内大量含铁血黄素沉积及出血。
LCC典型影像学表现为“三联征”:(1)大脑深部核团钙化;(2)广泛的脑白质信号异常;(3)多发脑内囊性病变。本例患者脑部MRI增强扫描见脑白质内多发结节样强化,与典型影像学表现不同,可能为小血管炎导致结节样强化,经大剂量激素冲击治疗后,结节样强化减轻。
颅内钙化、囊变及脑白质病变三联征为LCC头颅影像学的突出特点。钙化分布多不对称,少数可相对对称,常见于基底节、丘脑、皮层下白质,亦可见于小脑齿状核、脑干、脑室旁白质及囊壁等部位,形态往往不规则。囊变可见于脑实质的任何部位,以幕上居多;大小不等,可随病程延长而缓慢或迅速增大增多,少数亦可缩小;囊壁可有完整或不完整的环形增强,其内可有附壁结节(有病理证实为血肿合并机化)或出血信号。脑白质异常主要见于脑室周围及深部白质,皮层下白质亦可受累,可以对称,亦可非对称,甚至可仅限于单侧脑区。SWI可见脑内有多发微出血和钙化;正电子发射断层成像(PET)和单光子发射计算机断层扫描(SPECT)可显示病变脑组织呈低灌注与低代谢;脊髓一般不受累。
自从1996年Labrune和他的同事首次描述LCC以来,全世界已有超过100个报道的病例。LCC是一种脑微血管病,直到最近才被认为属于Coats plus综合征的疾病谱,称为脑视网膜微血管病伴钙化和囊肿(CRMCC)。后者的特点是与LCC相似的颅内病理,并伴有其他系统性损害,包括双侧渗出性视网膜病(Coats病)、骨骼异常、胃肠道和肝脏血管异常以及皮肤表现,如头发稀少和营养不良的指甲。Coats plus综合征是一种由CTC1突变引起的常染色体隐性(AR)疾病,CT C1编码CTS端粒维持复合物的一种成分。当没有全身受累的患者被发现缺乏CTC1突变时,这表明LCC实际上是一种独立的疾病。
病例1(Radiol Case Rep. 2022 Nov 28;18(2):584-590. )
一个23岁男性LCC的纵向病例,该病例在大约9年的影像学过程中表现出明显的疾病进展。患者最初在14岁时出现新的癫痫发作。最初的计算机断层扫描(CT)和磁共振成像(MRI)显示广泛的皮质下钙化和脑桥和左齿状核钙化;右额叶和颞叶内的几个囊肿;白质疾病包括累及中脑、脑桥和小脑中脚的半卵圆中心。最初诊断为Aicardi-Gouteire病,但在简单的文献回顾后,在确诊为LCC后,将其增加为LCC。
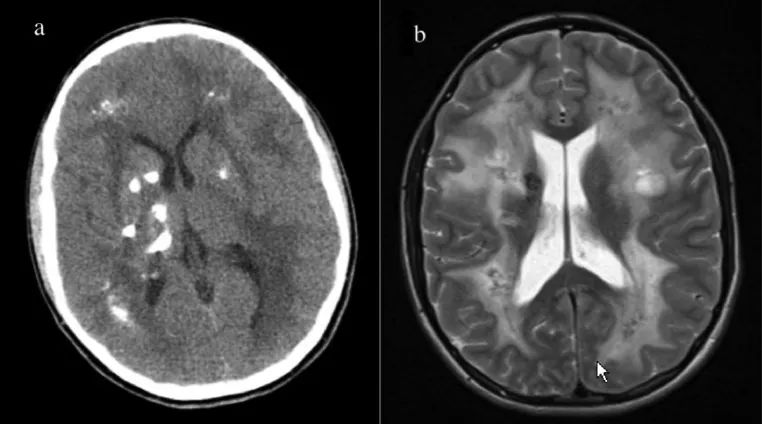
14岁时首次成像,CT成像显示皮质下分布广泛钙化(A),MR成像显示广泛白质疾病(B)。
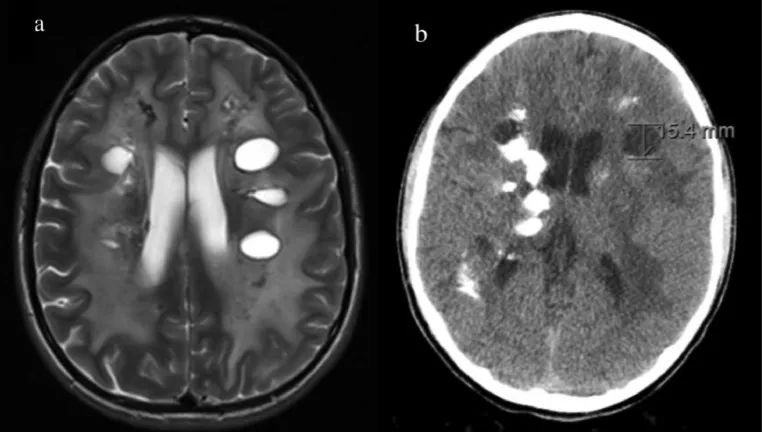
初次成像后2.5年的随访成像。磁共振成像显示皮质下白质的几个双侧囊肿伴有白质疾病(A)。与之前的CT (B)相比,CT成像显示钙化增加。
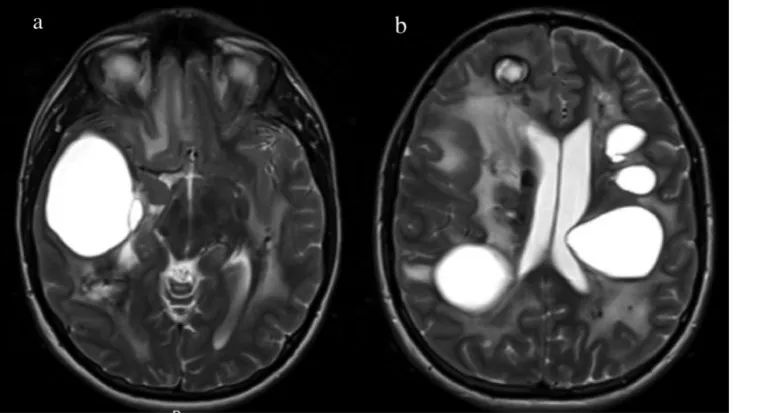
首次手术前的术前成像(首次成像后7.5年)。磁共振成像显示明显的囊肿进展,包括右颞叶(A)和整个大脑其余部分(B)。脑白质疾病和钙化也被可视化。
病例2(Neurology. 2024 Nov 12;103(9):e209936.)
一名52岁女性出现进行性脑病、四肢瘫痪和癫痫发作超过6个月。家族史不为人知。头部CT显示白质低密度,基底节钙化和后颅窝囊性病变。脑MRI显示弥漫性T2/FLAIR白质高信号,保留U纤维,基底节钙化和一个大的脑桥囊性病变。脑脊液检查正常。基于Trio的全外显子组测序揭示了先前报道的SNORD118中的致病变异,与伴有钙化和囊肿的脑白质病(LCC)的诊断一致。LCC是一种极其罕见的遗传性白质脑病,由SNORD118基因的常染色体隐性致病变异引起。典型的影像学表现是脑白质病变保留U形纤维、深部灰质钙化和囊性病变。病理发现包括血管瘤样血管胶质增生和罗森塔尔纤维沉积的微血管病。病例报告记录了对贝伐单抗的反应,尽管囊肿内出血的风险增加,并且一些患者会自发阻止疾病进展。
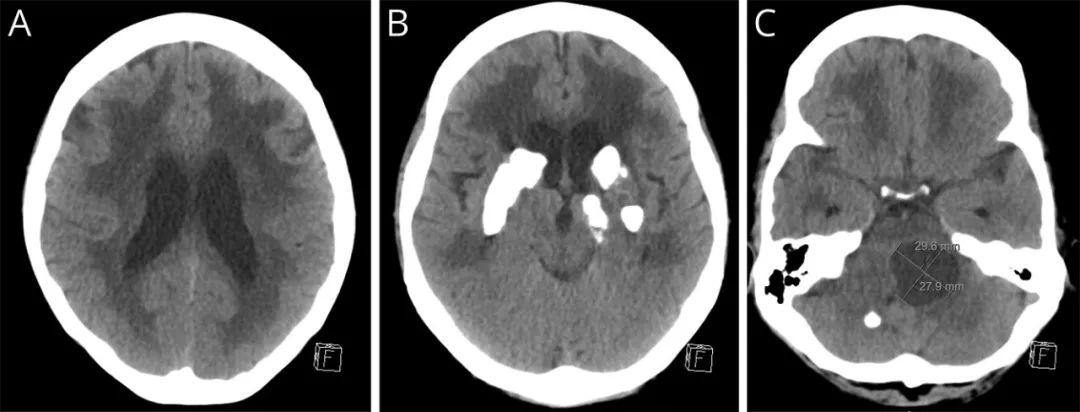
最初的CT头部显示弥漫性白质低密度(A),广泛的基底节钙化(B),后颅窝大的囊性病变引起肿块效应(C)。
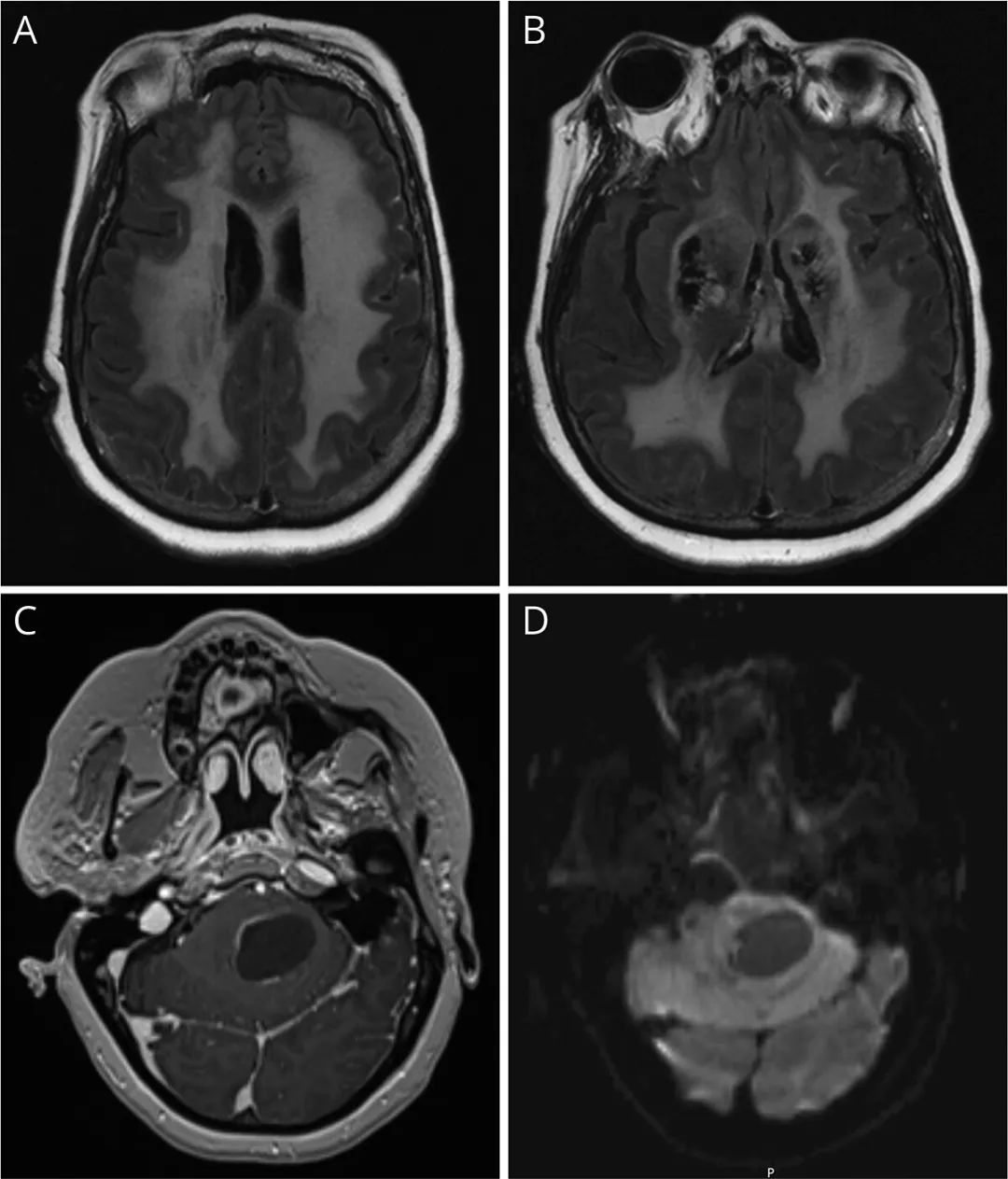
MRI脑显示弥漫性T2/FLAIR白质高信号,保留U纤维(A)和基底神经节钙化(B)。同样突出显示的是一个后颅窝囊性病变,增强后T1有薄的不连续的周边强化(C ), DWI无扩散限制(D)。
LCC病因未明,既往文献报道的病例大多为临床影像学诊断,部分有病理诊断。2016年,Jenkinson等总结33个家系共计40例LCC患者的遗传学资料,发现SNORD118基因变异是LCC的致病原因,指出LCC是一种呈常染色体隐性遗传方式的核糖体病。LCC是由SNORD118基因的双等位基因突变引起的,通常处于复合杂合状态。SNORD118基因的产物,box C/D小核仁RNA (snoRNA) U8,是一种非蛋白编码RNA,在特定核糖体亚单位的成熟中起重要作用。最近的斑马鱼模型显示,U8功能障碍导致有缺陷的中枢神经系统(CNS)发育和rRNA加工缺陷,并且是严重(无效)突变和较温和(畸形)突变结合的结果。虽然snoRNAs普遍表达,但SNORD118基因的功能缺失突变通过尚未完全阐明的机制表现为中枢神经系统的进行性微血管病。虽其确切的发病机制还有待进一步研究,但基因诊断已成为LCC确诊的有效手段。
LCC的临床表现缺乏特异性,病理资料又难以早期获得,且为有创检查,不宜作为确诊的必需条件,故影像学三联征就成了诊断本病的主要依据但还要做鉴别诊断。尽管LCC三联征有明确的影像学联系,但是三联征的确切病因仍然未知。尽管如此,LCC代表了一个特殊的可识别的临床放射学实体。最显著的组织病理学特征是脑血管瘤样改变。尽管有这些相对特征性的影像学和组织病理学发现,但临床特征并不一致。
鉴别诊断是困难的,尤其是在后续影像学研究中缓慢发生的变化。首先,CT上基底神经节的钙化提示了进一步的诊断测试。CT上的基底神经节钙化(在我们患者的第一次神经影像中发现)是非特异性的,可能在许多疾病中作为原发或继发体征出现。它们可能是特发性的、毒性的(一氧化碳、铅暴露)、感染性的(TORCH综合征、AIDS)、代谢性的(甲状旁腺功能减退症、假性甲状旁腺功能减退症、Cockayne综合征I和II、线粒体疾病(MELAS,MERRF)、神经铁蛋白病、伴有脑铁积聚的神经变性——NBIA)和遗传性的(染色体异常:SLC 20a 2 8p 11.21 PDGFRB 5q 32 PDGFB 22q 13.1 XP R1 1q 25.3 MYORG 9p 13.3)。
在Aicardi-Goutières综合征中,严重的症状在婴儿时期就已经出现。我们的病人是7岁,脑囊肿不是这种综合征的典型症状。RNASET-2缺陷性脑病的症状也可能出现在婴儿期。然而,经常观察到白质脑病、钙化和囊肿的三联征。我们患者的年龄和进一步基因检测的临床表现对鉴别诊断至关重要。在Cockayne综合征中,全身性变化与神经系统症状相关,这在我们的患者中是不存在的。脑萎缩、白质信号异常和钙化是神经影像学研究中最常见的。晚发性Krabbe病表现出不同的神经体征,包括共济失调、虚弱和痉挛。伴有钙化的囊性变需要排除寄生虫(包虫病、囊虫病和隐球菌病)的改变。没有发现寄生虫感染的血清学证据。寄生虫病通常不会出现脑白质异常。
迄今为止,在LCC中还缺少病因治疗,以对症为主,口服抗癫痫药对本病症状性癫痫的疗效往往欠佳;脑内囊变迅速膨大导致的颅高压是本病的手术指征,单纯囊变切除后可能复发,脑室-囊变-腹腔引流术可能效果更好。大多数临床症状是由脑微血管病如肿瘤样血管增生引起的。一种可能的疾病机制可能是血管内皮生长因子(VEGF)信号通路的功能障碍。2017年,Fay等人报告了用抗VEGF单克隆抗体贝伐单抗治疗的第一批数据。一名18岁患者接受贝伐单抗和VEGA信号通路抑制治疗一年后,作者观察到神经功能明显改善,脑MRI显示囊肿体积和白质病变明显减少,这为本病的治疗带来了希望,但该药尚无儿科适应证,其疗效与安全性也还有待更多的研究来证实。
参考文献
Jones FJ, Elser H, Mendez A, Fraser JL, Orthmann-Murphy J. Leukoencephalopathy With Calcifications and Cysts. Neurology. 2024 Nov 12;103(9):e209936. doi: 10.1212/WNL.0000000000209936.
Joshi AR, Kulkarni K, Shah AU. Labrune Syndrome: A Very Rare Association of Leukoencephalopathy, Cerebral Calcifications, and Cysts. Indian J Radiol Imaging. 2021 Nov 13;31(3):772-775. doi: 10.1055/s-0041-1736398.
Francis AG, Boca M, Urankar K, Cox A, Clatworthy P, Rice C. Leukoencephalopathy With Calcifications and Cysts Associated With SNORD118 Variants. Neurology. 2021 Oct 5;97(14):694-695.
儿童伴钙化与囊变的脑白质病四例临床特征及诊断.中华儿科杂志 2018年7月第56卷第7期
Waack A, Norris J, Becker K, Hoyt A, Schroeder J. Leukoencephalopathy, calcifications, and cysts: Labrune syndrome. Radiol Case Rep. 2022 Nov 28;18(2):584-590. doi: 10.1016/j.radcr.2022.11.026.
Shaikh M, Tiwari S, Yadav T, Garg PK, Khera PS. Leukoencephalopathy with Calcifications and Cysts in a Child with Progressive Hemiparesis-A Case Report. J Pediatr Neurosci. 2021 Oct-Dec;16(4):277-280. doi: 10.4103/jpn.JPN_113_20.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#钙化# #脑白质病#
46