【论著】流体剪应力对人脐静脉内皮细胞葡萄糖调节蛋白78和C/EBP同源蛋白表达的影响
2024-07-28 中国脑血管病杂志 中国脑血管病杂志 发表于上海
本研究拟设计流体动力学模拟实验系统,将不同的流体剪应力分别作用于HUVECs,检测不同流体剪应力作用下HUVECs中GRP78和CHOP的表达,以探讨流体剪应力对细胞和斑块的影响机制。
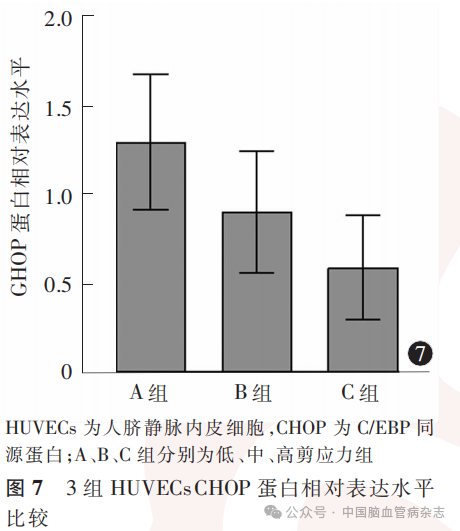
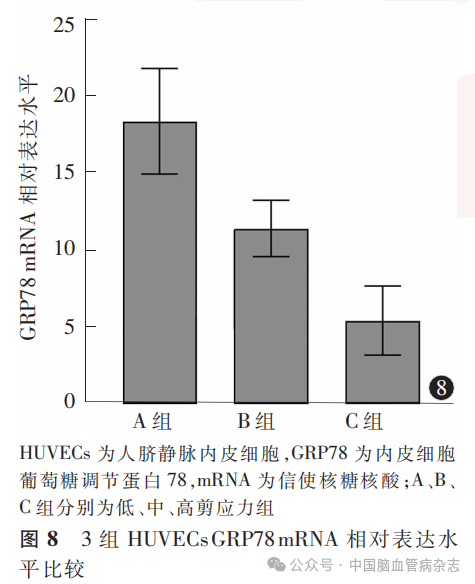
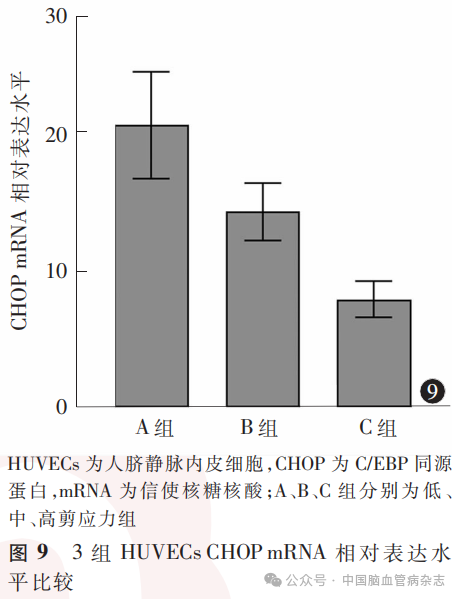
摘要:目的探索流体剪应力对人脐静脉内皮细胞(HUVECs)葡萄糖调节蛋白78(GRP78)和C/EBP同源蛋白(CHOP)表达的影响。方法以HUVECs作为实验细胞,设计并构建流体动力学模拟实验系统,控制流体动力学模拟实验系统中灌流液的流速,以实现对实验细胞施加不同的流体剪应力。按实验细胞在实验系统中所承受的不同流体剪应力,将实验细胞分为低剪应力组(A组;0.4Pa)、中剪应力组(B组;0.8Pa)和高剪应力组(C组;1.2Pa)。每组HUVECs包含3个细胞玻片,每个玻片经实验系统灌流液反复循环流经12h。采用蛋白质印迹法对各组细胞中GRP78和CHOP蛋白水平进行检测,采用实时荧光定量逆转录聚合酶链反应技术测定各组细胞GRP78和CHOP蛋白及其信使RNA(mRNA)相对水平。应用GraphPad Prism8.0软件对数据进行统计学分析。结果(1)A、B、C组HUVECs中GRP78蛋白相对表达水平分别为1.33±0.46、0.93±0.34、0.64±0.30;多组间比较差异有统计学意义(F=36.17,P<0.05)。A组GRP78蛋白相对表达水平高于B组、C组(均P<0.01),B组GRP78蛋白相对表达水平高于C组(P=0.0013)。3组HUVECs中CHOP蛋白相对表达水平分别为:A组1.29±0.38,B组0.90±0.34,C组0.59±0.29;多组间比较差异有统计学意义(F=41.27,P<0.05)。A组CHOP蛋白相对表达水平高于B组、C组(均P<0.01),B组CHOP蛋白相对表达水平高于C组(P=0.0004)。(2)A、B、C组HUVECs中GRP78 mRNA相对表达水平分别为18.3±3.4、11.3±1.8、5.4±2.2;多组间比较差异有统计学意义(F=189.20,P<0.05)。A组GRP78 mRNA相对表达水平高于B组、C组(均P<0.01),B组GRP78 mRNA相对表达水平高于C组(P<0.01)。3组HUVECs中CHOP mRNA相对表达水平分别为:A组20.4±3.8,B组14.2±2.1,C组7.8±1.3;多组间比较差异有统计学意义(F=171.80,P<0.05)。A组CHOP mRNA相对表达水平高于B组、C组(均P<0.01),B组CHOP mRNA相对表达水平高于C组(P<0.01)。结论低流体剪应力可能增加HUVECs中GRP78、CHOP的蛋白及其mRNA表达水平。
颈动脉斑块的稳定性在缺血性卒中的发生和发展过程中起决定性作用,临床上20%以上的缺血性卒中是由颈动脉分叉部的动脉粥样硬化斑块损伤脱落造成。内质网应激(endoplasmic reticulum stress, ERS)是动脉粥样硬化复杂病理过程中影响斑块稳定性的关键因素。葡萄糖调节蛋白78(glucose-regulated protein78, GRP78)是ERS的关键标志物,C/EBP同源蛋白(C/EBP homologous proteins,CHOP)在ERS过程中参与细胞凋亡,是ERS启动细胞凋亡的最具标志性的蛋白。流体剪应力在动脉粥样硬化进程中的作用越来越受到研究者的重视,但不同流体剪应力对GRP78、CHOP的表达和颈动脉粥样硬化斑块稳定性的影响及其作用机制尚未明确。
人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)具有分化潜能和新生血管内皮细胞的特性,更接近人体血管内皮细胞的生长特点,已成为血管内皮细胞体外实验的重要材料,是目前血管内皮细胞相关研究的主要细胞来源。本研究拟设计流体动力学模拟实验系统,将不同的流体剪应力分别作用于HUVECs,检测不同流体剪应力作用下HUVECs中GRP78和CHOP的表达,以探讨流体剪应力对细胞和斑块的影响机制。
1 材料与方法
1.1 实验细胞、主要材料及仪器
实验细胞为原代HUVECs(浙江美森细胞科技有限公司)。实验主要材料包括:内皮细胞培养基(ScienCell公司,美国)、T25细胞培养瓶(无锡耐思生命科技股份有限公司)、15ml无菌离心管(北京兰杰柯科技有限公司)、澳洲优级胎牛血清及胰酶(Gibco公司,美国)、全蛋白提取试剂盒(Bioseth公司,中国)、二辛可宁酸(bicinchonini cacid, BCA)蛋白浓度测定试剂盒(Bioseth公司,中国)、β-肌动蛋白单克隆抗体(Bioseth公司,中国)、微型无酶离心管(Axygen公司,美国)、0.45μm聚偏二氟乙烯膜(Merck公司,德国)、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polvacrylamide gel electrophoresis, SDS-PAGE)凝胶快速配制试剂盒(江苏凯基生物有限公司)、磷酸盐缓冲液(phosphate buffered saline, PBS;江苏凯基生物有限公司)、超敏化学发光检测试剂盒(江苏凯基生物有限公司)、Anti-GRP78抗体及Anti-CHOP抗体(Abcam公司,英国)、辣根过氧化物酶标记山羊抗小鼠或兔二抗(Thermofisher公司,美国)、核糖核酸(ribonucleic acid,RNA)提取试剂盒(TaKaRa公司,日本)、RNA反转录试剂盒(TaKaRa公司,日本)、RNA扩增试剂盒(TaKaRa公司,日本)。
实验主要仪器包括:金属浴锅(ABSON科学仪器有限公司,美国)、分光光度仪及荧光定量聚合酶链反应(polymerase chain reaction, PCR)仪(Thermofisher公司,美国)、电泳仪、转膜仪及T100-PCR仪(BIO-RAD公司,美国)、微量移液枪及低温高速离心机(Eppendorf公司,德国)、超声波细胞破碎仪(SONICS公司,美国)、超净工作台(青岛康净净化消毒设备有限公司)、旋涡混合器及恒温水浴箱(上海力辰仪器科技有限公司)、低速离心机(常州金坛良友仪器有限公司)、光学显微镜(麦克奥迪实业集团有限公司,中国)、细胞培养箱(上海一恒科学仪器有限公司)、恒流蠕动泵(保定融柏恒流泵制造有限公司)、潜水泵(浙江森森集团股份有限公司)、数据采集仪(Graphtec公司,日本)、细胞搭载台及旋转台(大连理工大学能源与动力学院)、铠装热电偶(沈阳市中色测温仪表研究所有限公司)、微生物燃料电池(microbial fuel cell,MFC)微生物反应器(POMEX公司,塞浦路斯)。
1.2 实验方法
1.2.1实验细胞准备:将含有原代HUVECs的冻存管从-80℃冰箱中取出,置于37℃水浴中晃动解冻,在超净工作台中用少量的内皮细胞培养基洗涤1~2次,一并收集至15ml离心管内,1000r/min,离心半径10cm,离心5min,弃去上清液,加入2ml内皮细胞培养基,轻柔吹打细胞沉淀,充分吹散、混匀后将细胞接种至含有5ml内皮细胞培养基的T25细胞培养瓶中,在37℃、5%CO2的培养箱中进行培养。此后每天更换细胞培养基,直至细胞约90%汇合,弃去培养瓶中上清液,加入PBS清洗2次,弃去PBS清洗液,加入1ml胰酶迅速铺匀,显微镜下观察细胞彼此分离,呈圆形,向培养瓶中加入2ml内皮细胞培养基,将脱落的细胞转移至15ml离心管中,1000r/min,离心半径10cm,离心5min,弃去上清液,加入2ml内皮细胞培养基,轻柔吹打细胞沉淀,充分吹散、混匀后将细胞接种至含有5ml内皮细胞培养基的T25细胞培养瓶中,在37℃、5%CO2环境的培养箱中进行培养,此后每日更换细胞培养基,直至细胞约90%汇合。
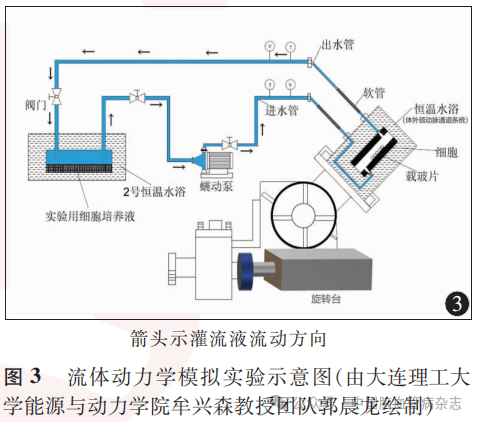
1.2.2 实验系统构建:设计并构建流体动力学模拟实验系统,该系统主要包括血液循环模拟和体外颈动脉通道模拟两部分,由恒温水箱、MFC微生物反应器、潜水泵、高精度恒流蠕动泵、旋转台、细胞搭载台、数据采集仪、铠装热电偶、CO2减压阀等组成。血液循环模拟系统以四通路MFC微生物反应器为人体血液环境模拟平台,反应器置于恒温水浴箱内,通道出口处设有铠装热电偶连接数据采集仪测温,进而维持环境温度,上部一通路连接CO2供给系统,下部两通路连接体外循环通道。体外颈动脉通道模拟系统以细胞搭载台为细胞生长实验平台,细胞搭载台由恒流腔、恒温腔两部分构成,潜水泵抽取恒温水为恒流腔提供恒温环境;恒流腔置于恒温腔内,为60.0mm×30.0mm×1.5mm的流体流通区域,内部可搭载细胞玻片,恒流腔入口设置在进入端底部,出口设置在出端顶部,以尽可能减小流体直接冲击细胞并实现流体循环。细胞搭载台放置在旋转台上,以实现流道立体角度(0°~90°)的变化,保证流体自下而上流过细胞,以模拟人体颈动脉血液流动。高精度恒流蠕动泵为流体流经细胞提供稳定、连续的动力,且可调节流速由0m/s至载玻片承载极限速度0.35m/s。流体动力学模拟实验系统及主要组成部件见图1,体外颈动脉通道模拟装置见图2。


1.2.3 实验中的流速及剪应力标定:由于实验过程中存在流动沿程损失,因此需要对进入恒流腔内流体的流速及剪应力进行标定,建立流量与实际流速、实际剪应力的关系。为此,本研究以0.1L/min为间隔调节高精度恒流蠕动泵,从而控制细胞搭载台入口的流体流速(范围:0.2~1.3L/min),再通过测量出口流速计算剪应力,剪应力τ=6ηQ/wh2(η为循环液黏度,Q为循环液流量,w为流室宽度,h为流室高度),记录并分析细胞搭载台入口流速与对应的剪应力,剪应力与流速呈现线性变化关系,即剪应力与流速成正比。
1.2.4 细胞分组:参考既往文献中HUVECs的流体剪应力承受范围及不同流体剪应力对HUVECs生理功能的影响,将制备的HUVECs按所承受的流体剪应力分为低剪应力组(A组;0.4Pa)、中剪应力组(B组;0.8Pa)、高剪应力组(C组;1.2Pa)。每组细胞包含3个细胞玻片,每个玻片的细胞约2.2×106个。
1.2.5 细胞模型建立:0.3L75%乙醇经恒流蠕动泵泵入实验系统管道内流动进行消毒,为实验系统提供无菌环境。将承载HUVECs的1个玻片放置于恒流腔中段,老虎夹紧固恒流腔。控制恒温水浴箱温度维持在36~37℃,恒温的四通路MFC微生物反应器内加入0.3~0.5L灌流液(含10%胎牛血清的内皮细胞培养液),将预先配置的成分为5%CO2+95%空气的气体经减压阀通入四通路MFC微生物反应器上部通路,以模拟血液环境中细胞生长的气体条件,待气体与灌流液混合后,利用潜水泵抽取恒温水实现恒温腔恒温水浴循环。利用高精度恒流蠕动泵将灌流液泵入恒流腔中,通过测量并控制入口段温度和流速,控制流体剪应力。灌流液以设定的剪应力流经HUVECs玻片后由恒流腔出口流出,重新进入恒温水浴中的MFC微生物反应器中。每个HUVECs玻片经灌流液反复循环流经12h。实验过程中测量恒流腔出口段温度和流速,以保证实验精度。实验示意图见图3。
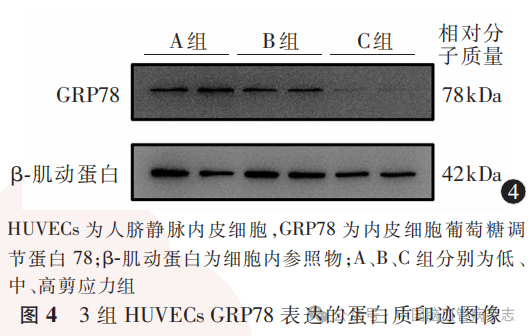
1.2.6 各组细胞GRP78和CHOP蛋白水平测定:采用蛋白质印迹法对各组细胞中GRP78和CHOP蛋白水平进行检测,每组细胞重复3次,每次检测取2个检测样。具体操作及检测步骤如下:各细胞玻片完成实验后经PBS漂洗,加入放射免疫沉淀法缓冲液,使用细胞刮将细胞收集至微型无酶离心管中,冰上静置30min,15000r/min,离心半径10cm,4℃离心20min后,取上清液,用BCA检测蛋白浓度并统一定量,取等量蛋白样品经10%SDS - PAGE进行蛋白分离,将蛋白用半干转膜法转移至0.45μm聚偏二氟乙烯膜上,5%脱脂牛奶封闭2h,洗膜,4℃Anti-GRP78抗体及Anti-CHOP抗体孵育过夜,漂洗后室温辣根过氧化物酶标记山羊抗小鼠或兔二抗孵育1h,洗涤后经超敏化学发光检测试剂盒显色。蛋白质印迹条带灰度值用Image J软件进行分析,以β-肌动蛋白作为细胞内参照物。蛋白相对表达水平为GRP78、CHOP分别与细胞内参照物β-肌动蛋白的蛋白质印迹灰度比值。
1.2.7 各组细胞GRP78和CHOP信使RNA(messenger RNA, mRNA)水平测定:采用实时荧光定量逆转录PCR技术测定各组细胞GRP78和CHOP信使RNA(mRNA)水平,每组细胞重复3次。具体操作及检测步骤如下:全部操作冰上进行,将细胞放入离心管中,采用Trizol法经RNA提取试剂盒提取采集到的各组细胞总RNA后,用RNA反转录试剂盒建立互补DNA文库,GRP78、CHOP以及细胞内参照物甘油醛-3-磷酸脱氢酶(glyceralde hyde-3-phosphate dehydrogenase, GAPDH)引物探针引物序列如下: GRP78的上游引物5′-AACCTTCGATGTGTCTCTTCTCAC-3′,下游引物5′-ACATCTTTGCCCGTCTTCTTTT-3′; CHOP上游引物 5′-TCTAAGGCACTGAGCGTATCATGT-3′,下游引物5′-TTTCAGGTGTGGTGATGTATGAAG-3′; 细胞内参照物GAPDH的上游引5′-TGGCACCCAGCACAATGAA-3′,下游引物5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。使用基因扩增仪进行定量,通过RNA扩增试剂盒应用TB Green嵌合荧光法进行实时荧光定量基因扩增,分析扩增曲线和溶解曲线,以GAPDH作为细胞内参照物,采用2(-ΔΔCt)法分别计算GRP78和CHOP mRNA相对表达水平。
1.3 统计学分析
采用GraphPad Prism 8.0软件对数据进行统计分析。每组细胞重复3次蛋白质印迹和实时荧光定量逆转录PCR检测。采用Shapiro-Wilk法对计量资料进行正态性检验,符合正态分布的计量资料以x-±s表示,组间比较采用独立样本t检验;非正态分布的计量资料以中位数及四分位数[M(P25,P75)]表示,组间比较采用独立样本非参数检验。多组间比较采用单因素方差分析或Mann-Whitney U检验,组间两两比较采用最小显著差异法(post least significant difference, LSD)。以P<0.05为差异有统计学意义。
2 结果
2.1 各组HUVECs GRP78、CHOP蛋白相对表达水平比较
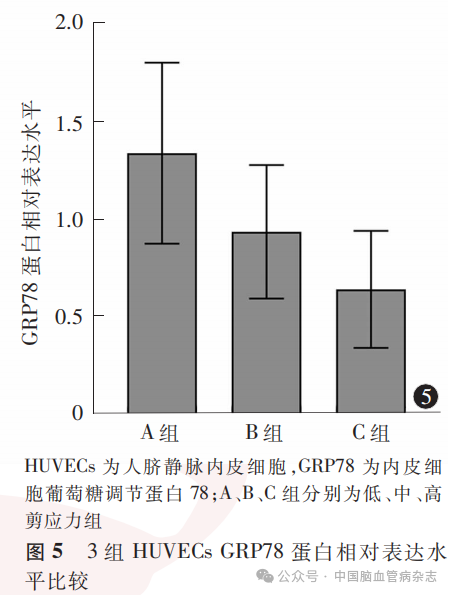
经检测,3组HUVECs中GRP78蛋白相对表达水平分别为:A组1.33±0.46,B组0.93±0.34,C组0.64±0.30;多组间比较差异有统计学意义(F=36.17,P<0.05)。A组GRP78蛋白相对表达水平高于B组、C组(均P<0.01),B组GRP78蛋白相对表达水平高于C组(P=0.0013)。见图4,图5。
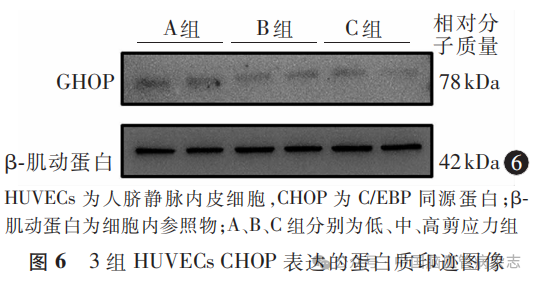
3组HUVECs中CHOP蛋白相对表达水平分别为:A组1.29±0.38,B组0.90±0.34,C组0.59±0.29;多组间比较差异有统计学意义(F=41.27,P<0.05)。A组CHOP蛋白相对表达水平高于B组、C组(均P<0.01),B组CHOP蛋白相对表达水平高于C组(P=0.0004)。见图6,图7。
2.2 各组HUVECs GRP78、CHOP mRNA相对表达水平比较
经检测,3组HUVECs中GRP78 mRNA相对表达水平分别为:A组18.3±3.4,B组11.3±1.8,C组5.4±2.2;多组间比较差异有统计学意义(F=189.20,P<0.05)。A组GRP78 mRNA相对表达水平高于B组、C组(均P<0.01),B组GRP78mRNA相对表达水平高于C组(P<0.01)。见图8。
3组HUVECs中CHOP mRNA相对表达水平分别为:A组20.4±3.8,B组14.2±2.1,C组7.8±1.3;多组间比较差异有统计学意义(F=171.80, P<0.05)。A组CHOP mRNA 相对表达水平高于B组、C组(均P<0.01),B组CHOP mRNA相对表达水平高于C组(P<0.01)。见图9。
3 讨论
血流剪应力在动脉粥样硬化病变的发生和发展过程中发挥重要的调控作用。血管内皮细胞覆盖整个血管腔,血流剪应力的变化直接刺激内皮细胞,使其功能紊乱并传递相关信号。Davies等研究表明,血流剪应力是影响血管重塑、动脉张力和动脉粥样硬化的主要因素。低剪应力可使血管内皮细胞出现功能性损伤,导致血液中颗粒物质积聚和血栓形成,其主要机制是通过血管内皮细胞表面的整合素、受体酪氨酸激酶、离子通道以及G蛋白机械力感受器,将机械刺激信号逐渐转化为生物化学信号,从而使细胞内相关的信号通路激活,不同程度地影响细胞黏附、炎症反应以及细胞迁移、凋亡等过程,从而导致血管壁重塑和动脉粥样硬化形成。低血流剪应力还能激活核因子-κB,上调大量促炎和促动脉粥样硬化介质,启动CHOP途径促进细胞凋亡。CHOP即CCAAT增强子结合蛋白同源蛋白,也称DNA损伤转录诱导因子3,其在ERS发生时表达上调,是ERS开启细胞凋亡的最具标志性的蛋白。内质网作为最大的膜结合细胞器,可调节膜蛋白折叠、钙稳态和脂质合成。ERS是内质稳态遭到破坏时的细胞状态,是动脉粥样硬化复杂病理过程中影响斑块稳定性的关键因素。GRP78是一种促进正常细胞蛋白质成熟,维持细胞机能的重要分子伴侣,内质网膜上功能正常的GRP78与新生多肽结合并快速松开,促使蛋白质正确折叠、装配,并转运到特定的部位。研究表明,未折叠蛋白反应是一种由ERS激活的适应性机制,与斑块不稳定性有关。
本研究团队的前期研究对进行过病理分型的人体颈动脉斑块内膜标本行免疫组化、蛋白质印迹和实时荧光定量逆转录PCR,检测ERS分子标志物GRP78和CHOP在稳定和不稳定斑块组中的表达,结果显示,不稳定斑块组的GRP78和CHOP水平均高于稳定斑块组(均P<0.05)。本研究选取HUVECs作为研究对象,检测并比较不同剪应力下HUVECs中GRP78和CHOP的表达水平,结果显示,低流体剪应力可能增加HUVECs中GRP78和CHOP蛋白及其mRNA的表达(均P<0.05)。GRP78作为一种钙结合蛋白,在发生ERS时其基因的转录活性可提高数十倍,使其表达量显著增高,一定程度上维持内质网稳定。GRP78通过与双链RNA依赖的蛋白激酶样内质网激酶、转录激活因子6和跨膜丝氨酸/苏氨酸激酶1这3种信号转导蛋白的分离与结合,调控ERS。当ESR无法缓解时,细胞则会启动凋亡程序,多个通路参与其中,CHOP通路即为其中之一。CHOP是ERS诱导细胞凋亡的特异性转录因子,广泛表达于哺乳动物机体细胞,在细胞非应激状态下,CHOP主要存在于细胞浆内,含量很低;当ERS时,CHOP被活化并大量表达于细胞核内。大量表达的CHOP通过下调Bcl-2表达,耗竭谷胱甘肽,使内皮细胞凋亡,进而引起动脉粥样硬化斑块破裂。
综上所述,低流体剪应力可使HUVECs中GRP78和CHOP的蛋白及其mRNA的表达量增高,低流体剪切力可能通过影响GRP78、CHOP的表达,引起颈动脉斑块失稳定。目前已有小样本临床试验对流体剪应力与冠状动脉粥样硬化病变发生发展关系进行探索,深入了解流体剪应力影响GRP78和CHOP表达的机制,有助于建立动脉粥样硬化性血管疾病危险分层体系,了解动脉粥样硬化斑块稳定程度,寻找疾病治疗靶点。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#流体剪应力# #人脐静脉内皮细胞# #葡萄糖调节蛋白78# #C/EBP同源蛋白#
34