晚期NSCLC单药免疫治疗三周后的液体活检能提前揪出“疗效差”的人群,咋做到的?
2024-11-11 苏州绘真医学 苏州绘真医学 发表于上海
本研究对接受免疫检查点抑制剂治疗的晚期非小细胞肺癌患者进行前瞻性研究,分析液体活检与结局关系,构建列线图分类风险组,强调早期监测对预测结局的作用及模型未来临床应用潜力。
非小细胞肺癌(NSCLC)使用免疫检查点抑制剂(ICI)的临床获益情况存在高度异质性。我们前瞻性地招募了 113 例接受 ICIs 治疗的晚期 NSCLC 患者,在 ICI 开始时(T1)、3 周后(T2)和影像学评估时(T3)进行液体活检。将分子变量与结局终点相关联:cfDNA 定量、其动态变化(∆T2–T1)、基线 NGS 检测到的变异丰度(VAF)最高的基因变异的 VAF(maxVAF)及其动态变化(∆T2–T1)。在多变量分析中,PD-L1 阴性、T1 cfDNA、cfDNA 升高(∆T2–T1)和 T2 VAF 与较短的无进展生存期(PFS)显著相关;PD-L1 阴性、鳞状组织学、T1 cfDNA、cfDNA(∆T2–T1)升高和 T2 maxVAF 影响总生存期(OS)。在接受一线治疗的 PD-L1 高表达患者中,较高的T2 maxVAF 和 cfDNA 升高(∆T2–T1)与较差的 PFS 相关;较高的 T2 maxVAF 和 cfDNA 升高(∆T2–T1)与较差的 OS 相关。使用衍生的综合模型构建列线图,对不同的风险组进行分类。
研究背景
在晚期非小细胞肺癌(NSCLC)治疗中引入免疫疗法是改善患者预后和生活质量的最重要进展之一。目前,大多数被诊断为晚期 NSCLC 的患者接受免疫检查点抑制剂(ICI)治疗,但一个重要的例外是癌基因成瘾疾病。
在临床实践中,NSCLC 患者至少需要接受已知可靶向用药基因检测,包括 EGFR、ALK、ROS1、RET、MET、NTRK、BRAF、HER2 和 KRAS 可靶向用药变异。标准评估方法以组织检测为代表,尽管液体活检正用于分子诊断。除了支持精准肿瘤学外,液体活检还有多种研究应用,包括在寻找免疫疗法的预测性生物标志物方面具有潜在用途。
目前,包含 ICI 的不同治疗策略可用于一线治疗:抗 PD-1/PD-L1 单药治疗,化疗联合抗 PD-1 抗体,抗 PD-1 加抗 CTLA4 加短程化疗。现在,治疗选择基于 PD-L1 表达(临床实践中唯一可及的预测性生物标志物)和毒性分析。已观察到缓解和缓解持续时间的巨大异质性。特别是,一部分患者免疫单药治疗产生有害影响,而 15-20% 的患者取得长期临床获益,被定义为长期生存者,即使没有使用毒性更强的联合策略。
为了阐明临床获益的异质性,已经探索了几种生物标志物,总体而言,研究结果表明,对免疫治疗的反应可能与单一生物标志物无关,而是与宿主、肿瘤和微环境相关因素之间的动态相互作用有关。因此,我们推测循环肿瘤 DNA(ctDNA)或可作为肿瘤负荷和早期治疗相关生物学变化的替代物,也许能够预测 ICIs 后的反应和临床获益。
我们对接受单药 ICIs 治疗的晚期 NSCLC 患者进行了一项前瞻性研究,综合了临床病理特征和 ctDNA 监测结果,以建立预测模型。
研究方法
2017 年 1 月至 2019 年 8 月期间,在威尼托肿瘤研究所 IOV-IRCCS(意大利帕多瓦)接受 ICI 治疗的晚期 NSCLC 患者入组名为 MAGIC 的前瞻性研究。主要入组标准是 EGFR-ALK-ROS1 野生型 NSCLC 的组织学诊断、根据临床实践进行 ICI 治疗的可行性、适当的临床和影像学随访的可能性以及签署知情同意书。据意大利批准的适应症,2017 年 1 月至 7 月期间,ICIs 用于化疗后疾病进展的患者,无论 PD-L1 表达如何。2017 年 7 月之后,肿瘤活检显示至少 50% 的肿瘤细胞存在 PD-L1 表达的患者接受一线帕博利珠单抗治疗,PD-L1 低于 50% 的患者接受二线 ICI(纳武利尤单抗、帕博利珠单抗和阿替利珠单抗)治疗。PD-L1 表达水平和 EGFR/ALK/ROS1 可操作改变检测均由病理科根据临床实践进行评估。使用 DAKO 22C3 常规评估 PD-L1。
在 ICI 期间,在预先计划的时间点收集液体活检样本:在首次给药的同一天(基线或 T1),根据治疗方案在 2 周或 3 周后(T2),在第一次影像学评估时(T3)。根据临床实践进行影像学和临床随访。对每个时间点收集的液体活检样本、血液 gDNA 和 FFPE 组织活检样本肿瘤 DNA 进行靶向下一代测序(NGS)。仅对致病性或可能致病性变异和意义未明的变异(VUS)进行纵向分析。
影像学反应(RR)、无进展生存期(PFS)和总生存期(OS)是分析考虑的主要终点。根据 RECIST 1.1 标准,RR 分级为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。
关于分子变量,考虑了血浆 cfDNA 浓度(ng/ml)和变异丰度(VAF)。对于在肿瘤组织中未发现的 cfDNA 基因变异,评估分离了血浆的血液,以排除克隆性造血(CH)相关变异。存在多个突变的情况下,选择基线时 VAF 最高的突变作为 NGS 分析的参考,在文中称为 maxVAF。
当检测到的所有肿瘤相关基因变异的 VAF 低于 0.5%(被认为是 NGS 检测的检出限(LOD))时,值被替换为 0.025,对应 LOD/2。为了定义 LOD,我们根据 NGS 分析了携带 KRAS 突变的样本,并通过微滴式数字 PCR(ddPCR)证实:ddPCR 证实的最低 VAF 为 0.5%。
研究结果
患者、治疗和结局
在符合临床入组标准的 149 例晚期 NSCLC 患者中,基于完整临床病理数据(包括 PD-L1 评估)和液体活检结果的可及性,考虑对 113 例患者进行预测分析(表 1)。鉴于其已确定 PD-L1 的预测价值,PD-L1 数据未知的患者(24%)被排除在模型之外。研究人群的主要临床特征总结于表 1。
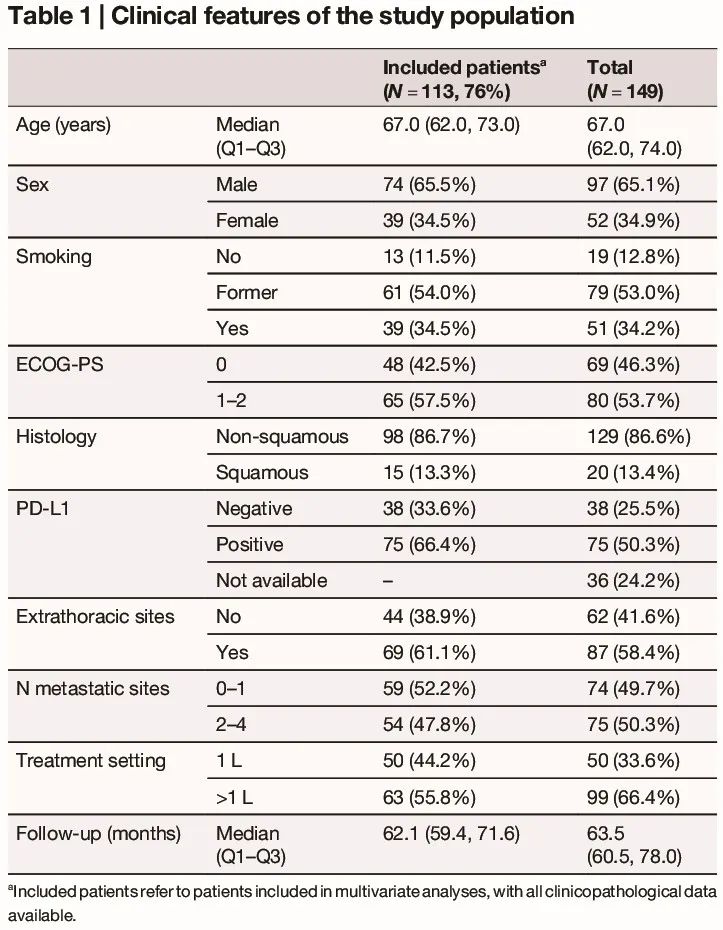
表1
50 例患者接受一线帕博利珠单抗治疗,63 例患者在一线化疗疾病进展后接受 ICIs 治疗。总体而言,PR 率为 27.4%,43 例(38.1%)患者的最佳反应是 PD。在 50 例一线治疗患者中,34 例实现了疾病控制(PR + SD)(表 2)。在整个研究人群中,中位随访时间为 63.5 个月,中位 PFS 为 6.3 个月(95% CI:5.3,8.1),中位 OS 为 12.0 个月(95% CI:8.1,14.6)(表 2)。在整个研究人群中,17 例患者在 ICIs 开始后 12 周内死亡,2 例符合影像学超进展标准。
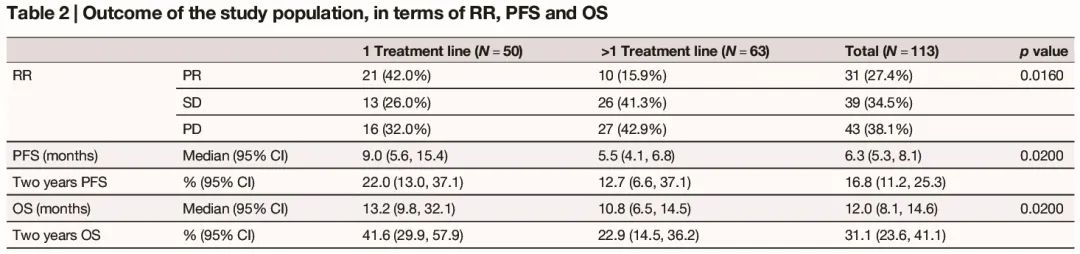
表2
单变量分析显示,在评估的临床病理特征中,不存在潜在可靶向用药基因变异、PD-L1 水平和接受免疫治疗作为一线治疗显著影响 PFS 的概率。影响 OS 的因素包括年龄、PD-L1 水平、转移部位的数量和接受免疫治疗作为一线治疗。
纵向液体活检结果
最初,我们试图探索用于检测 SNV 的 NGS 检测的批间变异和 LOD。为此,我们在多个(n = 9)文库制备和测序运行中分析了阳性对照,包含 11 个 VAF 已知的突变。总体显示实验 VAF 值与预期 VAF 值相比存在微小偏差,从而证实了该方法适用于跟踪微小的 VAF 变化。关于 LOD,我们通过 ddPCR 对 cfDNA 样本中 NGS 检测到的 KRAS 突变进行了正交验证,确认低至 0.5% 的 VAF。出于这个原因,我们的模型包括了NGS 检测到的 maxVAF 低至 0.5% 的致病性突变或 VUS。
基线时中位 ctDNA 浓度为 10.03 ng/ml(Q1–Q3:6.68-15.18,表 3a)。67/110 例患者(60.9%)在基线时检测到突变。在 43 例(39.1%)基线时未检测到突变的患者中,9 例在 T2 时检测结果呈阳性,4 例在 T3 时呈阳性。每个时间点的 cfDNA 浓度与 VAF 水平显著相关。
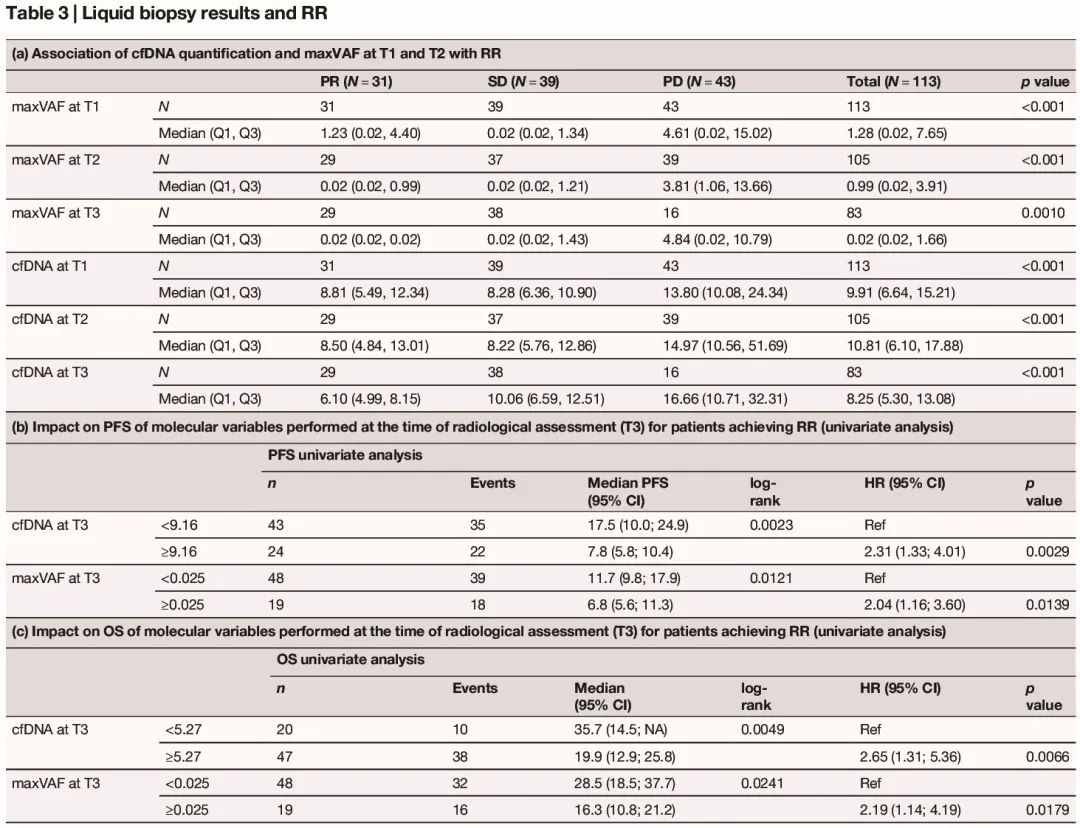
表3
分析基线液体活检结果,探索与临床特征和肿瘤负荷的潜在关联。在既往吸烟者患者的 cfDNA 浓度较高(p = 0.0250),未观察到与肿瘤负荷相关因素的关联。另一方面,具有两个或多个转移部位的患者具有显著更高的 VAF(p = 0.05)。
组织与血浆NGS结果的一致性
在一部分患者中,我们探索了 cfDNA 与匹配的肿瘤样本检测到的基因变异的一致性。在我们的 113 例患者队列中,11 例患者进行了组织检测作为常规诊断。在一例病例(#238)中,液体活检检出的 maxVAF 突变在组织中未发现,然后分析了血液样本看是否可能为 CH 来源。此外,39 例(34.5%)患者有 FFPE 肿瘤组织可用于NGS 56 基因 panel检测。3/39 例由于 DNA 质量差,文库制备失败。在 36 例患者中,文库制备和测序成功。在 1 例患者中,组织活检和液体活检(T1)均未发现相关突变。20/36 例患者(55.5%)至少有 1 个突变在组织和液体活检(T1)中均检出。在 36 例患者中组织和液体活检共发现 79 个突变。15 个突变(10 例患者)仅存在于液体活检,34 个突变(18 例患者)仅存在于组织。如果只考虑基线 maxVAF 突变,18/23(78.3%)在组织中也发现。在组织中未发现的基因变异被评估为潜在 CH 相关基因。
CH相关基因分析
为了评估潜在的克隆性造血相关基因的问题,我们对分离了血浆的血液进行 NGS 检测,以纠正我们模型关于基线时 VAF 最高的基因变异的潜在 CH 来源方面。对于 CH 分析,我们选择了没有组织信息的患者(n = 43)及组织和液体活检不一致的病例(n = 5),而组织和液体活检一致的患者(n = 35)和液体活检没有发现相关突变的患者(n = 31)被排除在外。在进行 CH 分析的 48 例患者中,在 6 例患者中 VAF 最高的突变也存在于血液。在三例病例(#230、#320 和 #325)中,没有其他可追踪的突变。在另外三例病例(#132、#278、#313)中,VAF 第二高的突变在血液中未检测到 ,被选为可追踪的突变。
液体活检和结局
基线(T1)和 T2 cfDNA 和 maxVAF 与 RR 显著相关,特别是经历 PD 的患者,因为与经历 SD 或 PR 的患者相比,最好的 RR 具有更高的 cfDNA 和更高的 maxVAF(表 3a)。
对于生存分析,根据 bootstrap 验证的中位袋子内阈值对生物标志物进行分类,以确定用于后续分析的每个变量的高水平与低水平的阈值。
在单变量生存分析中,基线和 T2 时较高的 cfDNA 和基线和 T2 时较高的 maxVAF,以及 cfDNA(ΔT2-T1)和 maxVAF(ΔT2-T1)相对于基线的升高,与进展风险和较短的生存期显著相关。
我们还考虑了在 RR 评估(T3)时进行液体活检的潜在作用,以进一步对达到 RR 的患者的结局进行分层(表 3b,c)。特别是,T3 时高 maxVAF 患者的中位 PFS 为 6.8(95% CI:5.6-11.3)个月,而 T3 时低 maxVAF 患者的中位 PFS 为 11.7(95% CI:9.8-17.9)个月(p:0.0139,表 3b)。T3 时高和低 maxVAF 患者的中位 OS 分别为 16.3(95% CI:10.8-21.2)和 28.5(95% CI:18.5-37.7)个月(p:0.0241,表 3c)。
液体活检结果和临床特征的综合模型
在包括临床病理和分子特征的多变量分析中,PD-L1 阴性、基线 cfDNA、cfDNA 升高(ΔT2-T1)和 T2 maxVAF 与较短的 PFS 显著相关(表 4);此外,PD-L1 阴性、鳞状组织学、基线 cfDNA、cfDNA 升高(ΔT2-T1)和 T2 maxVAF 与较差的 OS 显著相关(表 5)。
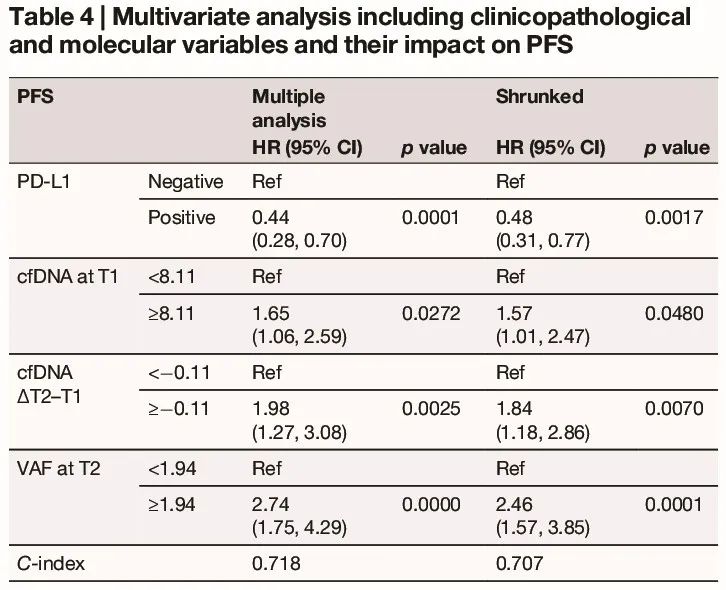
表4
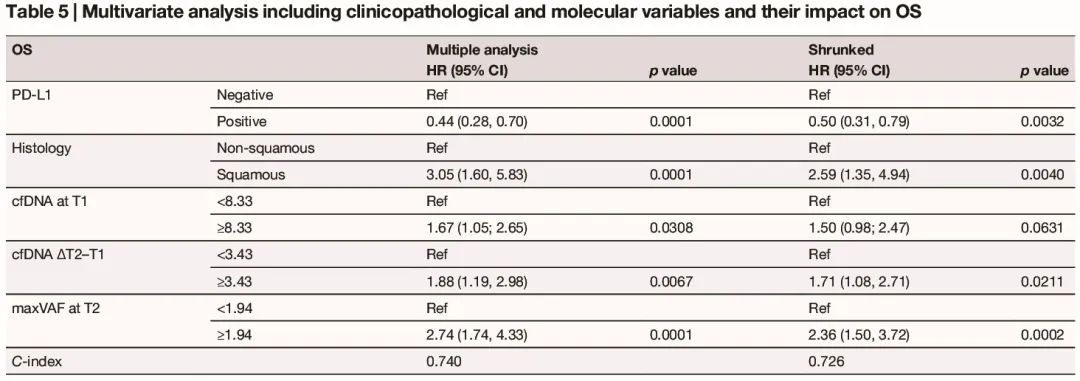
表5
使用列线图评估风险因素并潜在预测临床实践中免疫治疗后的结局。基于列线图中每位患者的总分,将患者分为三个风险组,以便及早识别快速进展和结局不佳的可能性较高的患者、具有中等临床获益的患者和可能获得持久临床获益的患者(图 1A、B)。特别是,低风险组的中位 PFS 和 OS 分别为 20.5(95% CI:10.3-NA)和 30.1(95% CI:28.2-NA)个月,中风险组的中位 PFS 和 OS 分别为 6.6(95% CI:5.8-8.6)和 11.4(95% CI:8.0-13.5)个月,高风险组患的中位 PFS 和 OS 分别为 2.5(95% CI:1.8-4.2)和 3.5(95% CI:2.3-6.5)个月。
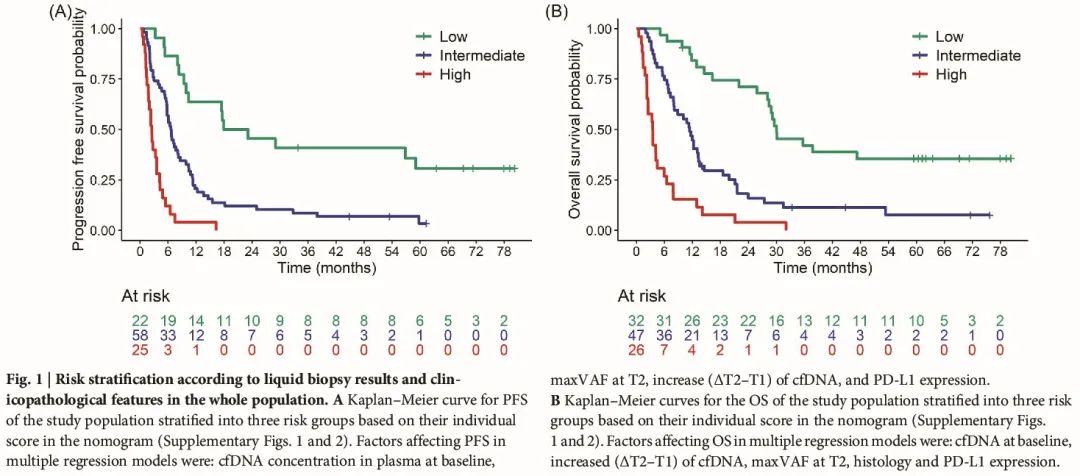
图1
综合模型和一线治疗
随后,我们试图在更同质的临床环境中验证我们的综合预测模型。50 例接受一线帕博利珠单抗治疗的患者被纳入分析。中位 PFS 为 9.0 个月(95% CI:5.6-15.4),中位 OS 为 13.2 个月(95% CI:9.8-32.1)。21 例(42.0%)患者达到 PR,而 16 例患者最佳反应为 PD(表 2)。
在多因素 Cox 模型中,T2 时高 maxVAF(HR = 2.25,95% CI:1.15─4.41)和 cfDNA 升高(ΔT2–T1)(HR = 2.25,95% CI:1.17─4.33)仍然与较差的 PFS 显著相关。类似地,T2 时高水平的 maxVAF(HR = 2.09,95% CI:1.07─4.11)和 cfDNA 升高(ΔT2–T1)(HR = 2.18,95% CI:1.08─4.38)仍然与较差的 OS 显著相关。
图 2 描述了一个三组风险分层模型,该模型基于为一线治疗创建的列线图。特别是,在被认为高风险的患者中,中位 OS 为 3.3(95% CI:1.5-NA)个月,在被认为中风险的患者中为 6.9(95% CI:5.5-21.2)个月,在被认为为低风险的患者中为 29.5(95% CI:14.6-NA)(图 2)。
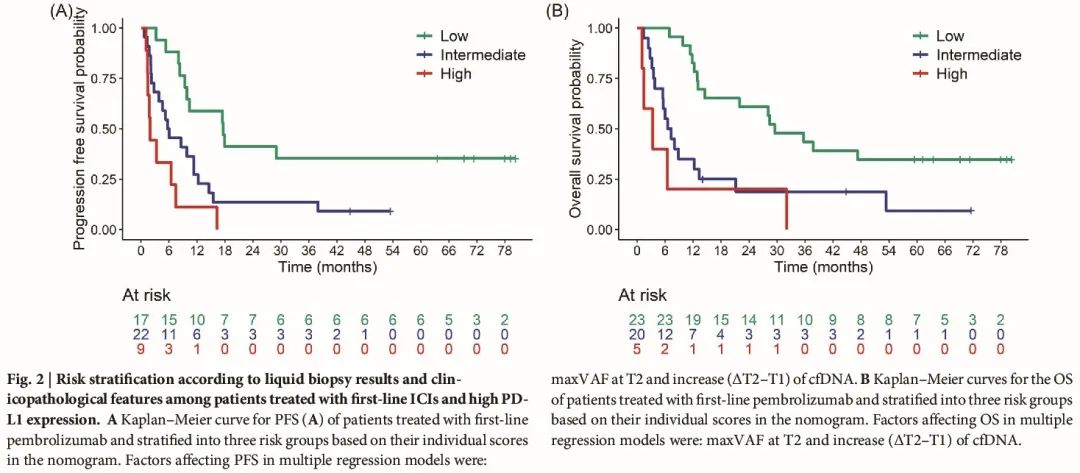
图2
在达到 RR(根据 RECIST V1.1)的患者中,在影像学评估(T3)时进行的液体活检结果能够预期长期临床获益。特别是,T3 时高 maxVAF 患者的中位 PFS 为 7.0(95% CI:12.2-32.1)个月,中位 OS 为 12.8(95% CI:6.5-NA)个月,而 T3 时低 maxVAF 患者的中位 PFS 为 17.5(95% CI:10.3-37.90)个月,中位 OS 为 35.7(95% CI:14.6-NA)个月。
讨 论
预测免疫疗法对晚期 NSCLC 的临床疗效被认为是肿瘤学临床和转化研究的主要挑战之一。
在 ICI 治疗期间使用动态液体活检的潜力已在其他地方讨论过。已经发表的一些数据表明,在晚期 NSCLC 和其他实体瘤中,ICI 治疗期间 ctDNA 的变化可能与预后相关。尽管使用 ctDNA 早期监测作为治疗期间肿瘤负荷的替代标志物的观点在科学界得到越来越多的认可,但现有数据的特点是方法、治疗期间时间点评估、患者群体和临床终点的高度异质性。最近的一项分析汇总了五项试验中 200 例患者的数据,证实了 ctDNA 动态分析的预测作用。尽管如此,仍在等待一个实际模型在介入性临床试验中测试,然后应用于临床实践。
本研究前瞻性地纳入了根据临床实践(介入性临床试验外)治疗的单中心晚期 NSCLC 患者。所有患者在预先设定的时间点进行了液体活检,我们仅在综合分析中纳入了有临床病理数据的患者,包括基线时组织 PD-L1 表达和没有驱动基因变异,通常在临床实践中使用组织检测。
就分子变量而言,我们首先评估了多个候选者(所有突变基因的平均和中位 VAF 作为参考,maxVAF 作为参考 ,ctDNA 和 VAF 的绝对和相对变化,通过不同方法评估),它们都与临床结局终点相关(数据未显示),并选择了最有可能适用于临床实践的候选者(cfDNA 和 maxVAF 作为静态参数,ctDNA 和 maxVAF 的绝对变化作为动态参数)。始终使用覆盖肿瘤高频突变基因的靶向 NGS panel 检测,以专注于血浆的定量变化并提高我们结果在临床实践中的潜在适用性。此外,液体活检时间点的选择考虑了临床可行性(当患者来医院进行常规血液评估时)。T2 被选为最早的时间点,就计划的治疗给药时间点而言,不需要额外的就诊,最终目的是尽早识别没有从 ICI 中获益的患者。T3 设在影像学评估时,主要在两个周期之后,在其他研究中被认为是最佳时间点。
选定的液体活检变量与标准公认的终点(根据 RECIST v1.1 的 PFS、OS、RR)相关联,然后与能够影响相同终点的临床病理特征相结合。
值得注意的是,即使在根据 RECIST v1.1 达到 RR 的患者中,液体活检结果也能够进一步对患者进行分层,识别临床获益持续时间不同的患者,从而强调了使用 RR 作为替代终点和作为治疗期间临床沟通和随访计划的指标的局限性。
此外,在我们的综合模型中,我们清楚地证明,当常用的临床病理预测因素可及时,纵向 cfDNA 分析增加更多信息。同时,我们证明了评估 cfDNA 浓度和 NGS 结果的作用。在此背景下,最近一篇文章讨论了早期识别可能从 ICI 治疗中获得“有害影响”的患者,我们之前证明 cfDNA 定量可作为治疗诱导的肿瘤负荷或生物变化的替代物。另一方面,本研究表明,NGS 结果,包括maxVAF 值和变化,能够进一步对死亡和复发风险进行分层。
本研究最重要的优势是入组方法和模型的潜在适用性。值得注意的是,选择早期时间点(T2,ICI 开始后 3 周)可以明确一线全身治疗期间的早期变化,最终目标是最大限度地提高治疗效果并避免在不需要时给予更多毒性的联合策略。
另一方面,本研究最重要的局限性是缺乏一套验证分析来证实结果。然而,我们在数据集中进行了交叉验证以评估最佳阈值的稳健性,并使用 bootstrap 收缩程序估计了阈值的校正后 HR,以减少过度拟合。
此外,可以通过在模型中包含有关分子特征的定性信息来提供进一步的预测信息,以探索特定基因变异(例如 STK11、KEAP1 和 KRAS 突变)对免疫治疗反应的潜在影响。无论如何,我们相信从临床实践中普遍可及的信息开始可能有助于模型的适用性。
该模型在晚期 NSCLC 患者中的潜在未来临床应用包括个体化定制一线治疗的可能性:仅对较短 PFS 和 OS 风险较高的患者在前两个周期后强化治疗。我们还在更同质的人群(至少 50% 的肿瘤细胞存在 PD-L1 表达并接受一线帕博利珠单抗治疗的患者)中评估了我们的模型。第二个潜在应用包括根据 T3 液体活检结果,对复发风险高的非进展患者早期改用二线治疗的可能性。
总之,本研究表明了在接受 ICIs 治疗的患者中,早期监测血浆 cfDNA 浓度和 maxVAF 定量在预测结局方面的作用。需要进一步验证我们的综合模型作为非癌基因成瘾 NSCLC 个体化治疗的工具。
参考文献:
Boscolo Bragadin A, Del Bianco P, Zulato E, Attili I, Pavan A, Carlet J, Marra L, Guarneri V, Indraccolo S, Bonanno L. Longitudinal liquid biopsy predicts clinical benefit from immunotherapy in advanced non-small cell lung cancer. NPJ Precis Oncol. 2024 Oct 17;8(1):234. doi: 10.1038/s41698-024-00704-9. PMID: 39420036; PMCID: PMC11486993.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#非小细胞肺癌# #免疫检查点抑制剂#
3