黄维院士、卢晓梅教授最新AM:仿生光敏剂实现肿瘤热阻逆转以优化乳腺癌的非创伤性轻热光热疗法
2024-07-30 BioMed科技 BioMed科技 发表于上海
介绍了一种用亮氨酸修饰的仿生光敏剂(CP-PLeu纳米粒子(NPs)),旨在实现肿瘤中快速均匀的积累。
轻度高温光热疗法(mPTT)具有治疗潜力,因为其对正常组织的损伤非常小。然而,血管化不良的肿瘤区域严重阻碍了光热剂(PTA)的渗透,导致其分布不均,随后在mPTT过程中也会导致局部温度不均。低于治疗性42°C阈值的区域可能会最终致使肿瘤消融不完全和潜在的复发。此外,肿瘤抗凋亡和细胞保护途径,特别是激活的耐热性,也可以消除轻度高温诱导的肿瘤损伤。
有鉴于此,南京工业大学黄维教授、卢晓梅教授和浙江省农业科学院Wen Wang等人介绍了一种用亮氨酸修饰的仿生光敏剂(CP-PLeu纳米粒子(NPs)),旨在实现肿瘤中快速均匀的积累。此外,CP-PLeu表现出了光动力效应,可以逆转肿瘤的耐热性和生理修复机制,从而抑制肿瘤对高温的抵抗力。随着NIR-II激光照射的加入,CP-PLeu优化了mPTT的治疗效果,并有助于癌症的微创治疗过程。这种治疗策略利用仿生光敏剂均匀分布治疗温度和光活化逆转肿瘤热阻,通过无创mPTT过程成功实现了有效的乳腺肿瘤抑制。相关工作以“A Bioinspired Photosensitizer Performs Tumor Thermoresistance Reversion to Optimize the Atraumatic Mild-Hyperthermia Photothermal Therapy for Breast Cancer”为题发表在Advanced Materials。

【文章要点】
尽管TME对mPTT有负面影响,但TME中的某些不利因素有望可以逆转为治疗优势。L型氨基酸,如支链氨基酸(BCAA、缬氨酸、亮氨酸和异亮氨酸),由跨膜L型氨基酸转运蛋白(LAT)转运,LAT在乳腺肿瘤中的表达明显高于正常组织。有鉴于此,在这项研究中,作者设计了一种亮氨酸修饰的共轭聚合物(CP-PLeu)作为光敏剂。具体而言, CP-PLeu由两部分组成:一个疏水共轭骨架,带有实现光转换效应的电子“供体/受体”对,以及一个水溶性侧链,密集接枝亮氨酸以增强生物相容性和肿瘤特异性(图1)。CP-PLeu可在水溶液中进行自组装,从而显示出良好的光转换特性,该特性提供了产生ROS的光动力效应和产生热量的光热效应,可用于抑制乳腺肿瘤。
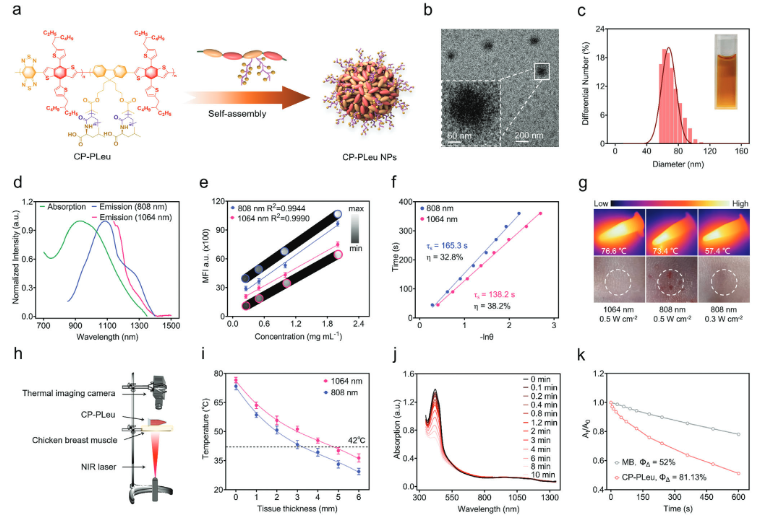
图1 CP-PLeu的物理化学性质
在生理环境中,氨基酸可以通过氢键和范德华力等非共价相互作用形成簇。由于其侧链上丰富的亮氨酸部分,两亲性CP-PLeu可以自组装成具有富含亮氨酸外层的纳米结构。这些富含亮氨酸的CP-PLeu纳米颗粒(NP)可以被癌症细胞识别,促进实体瘤中的快速积累。在氙(Xe)灯照射激活后,CP-PLeu NPs发挥光动力效应,产生大量ROS以抑制局部HSP并损伤DNA和线粒体,从而改造TME。同时,在近红外(NIR)激光照射下,CP-PLeu产生热量,优化了TME内的mPTT过程,并在第二NIR窗口(NIR-II)区域内产生荧光,以指导治疗过程(图2)。这种仿生光疗实现了无创治疗过程,为乳腺肿瘤提供了一种独特的治疗策略,同时将副作用降至最低。
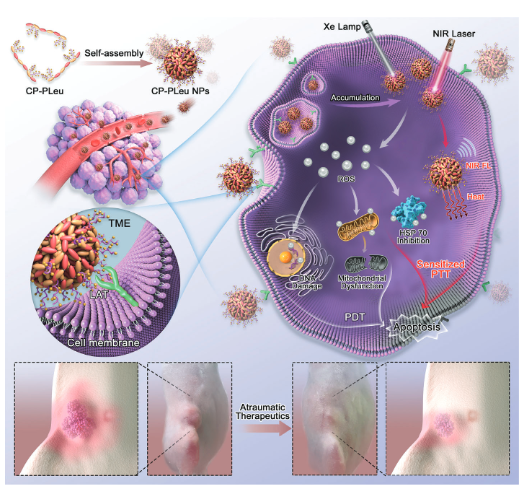
图2 CP-PLeu NP的作用机制
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202405890
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#乳腺肿瘤# #仿生光敏剂# #轻度高温光热疗法#
57