赵彦利教授/张洪杰院士最新Chem:单位点纳米酶,通过协调先天免疫和血管正常化治疗肿瘤
2024-09-27 BioMed科技 BioMed科技 发表于上海
这种在激活先天免疫和适应性免疫的同时使肿瘤血管系统正常化的协同策略为癌症免疫疗法提供了一种有前景的途径。
基于cGAS-STING通路的免疫疗法
免疫治疗被认为是癌症治疗最有前景的方法之一,具有显著的治疗效果和有效预防肿瘤转移和复发的能力。环状鸟苷单磷酸(GMP)-AMP合酶(cGAS)-干扰素基因刺激因子(STING)通路因其在协调先天免疫反应和促进适应性免疫后期激活方面的关键功能而引起广泛关注。通常,cGAS识别细胞质中的损伤相关双链DNA(dsDNA),并催化产生环状GMP-AMP(cGAMP),其可与STING结合并进一步触发I型干扰素(IFN-I)驱动的炎症反应。目前,STING激活在促进抗原呈递细胞刺激和激发抗肿瘤T细胞反应中的作用已被广泛研究。而为了实现外源性STING激活,许多研究都已致力于开发环二核苷酸模拟物。然而,肿瘤内注射方法限制了这些STING激动剂的治疗效果和临床适用性。尽管最近已经出现了可用于全身给药的小分子STING激动药,但药物运输和靶向特异性仍有待改善。因此,开发创新方法来提高STING激动药物的药理作用,提高药物输送效率,降低脱靶毒性仍然是一个迫切的需要。
此外,由于实体瘤的免疫原性低,以及存在异常和功能失调的肿瘤血管系统,阻碍了效应T细胞的浸润和抗肿瘤功能,临床患者对免疫疗法的反应往往有限。最近的研究揭示了STING信号传导与T细胞血管迁移之间的关键联系。肿瘤内STING激活已被证明可以使肿瘤血管正常化,增加内皮细胞对T细胞粘附分子的表达,从而大大增强T细胞浸润和抗肿瘤功能。因此,为了提高免疫治疗的疗效,将STING激活与VEGF/VEGFR阻断相结合,研究其对血管重编程、T细胞浸润和免疫反应的协同作用是有价值和意义的。
新型单位点纳米酶
在此,南洋理工大学赵彦利教授和中科院长春应化所张洪杰院士、王樱蕙副研究员等人的研究表明,具有暴露不饱和Cu-O2位点的缺陷铜基金属有机框架单位点纳米酶(F@D-CHTP SN)可以催化细胞内活性氧的产生,从而引发铜死亡和铁死亡,提高肿瘤的免疫原性。同时,瘤内激活干扰素基因刺激因子和阻断血管内皮生长因子受体可协同促进肿瘤血管系统正常化,重塑免疫抑制微环境,增强T细胞浸润。这种在激活先天免疫和适应性免疫的同时使肿瘤血管系统正常化的协同策略为癌症免疫疗法提供了一种有前景的途径。相关工作以“Single-site nanozyme with exposed unsaturated Cu-O2 sites for tumor therapy by coordinating innate immunity and vasculature normalization”为题发表在Chem。

【文章要点】
一、F@D-CHTP SN
MOF因其丰富且均匀分散的单金属位点而表现出与天然酶相似的催化活性。因此,MOFs可以被设计用于催化特定的生物反应,如氧化还原反应或特定底物的转化,从而在癌症的诊断和治疗中发挥重要作用。然而,MOF中单金属位点的非极性配位环境表现出对称的电子分布,导致吸附能力和催化活性无法进一步改善。为了应对这些挑战,可通过在MOFs中加入缺失的连接子或缺失的节点缺陷来形成具有不对称电子分布的单金属催化位点。此外,丰富的缺陷结构还可以有效地增加金属位点的暴露,从而增强其吸附能力和类酶催化活性。因此,在这项研究中,作者利用Cu2O纳米球作为模板和铜离子源,通过模板辅助和氧化还原蚀刻策略合成了一种具有暴露不饱和Cu-O2位点的缺陷铜基MOF单位点纳米酶(F@D-CHTP SN)。该纳米酶负载在Fe(OH)x空心纳米球表面,可进一步与MSA-2(STING激动剂)和呋喹替尼(VEGFR抑制剂)共负载形成F@D-CHTP SN-MF(图1)。
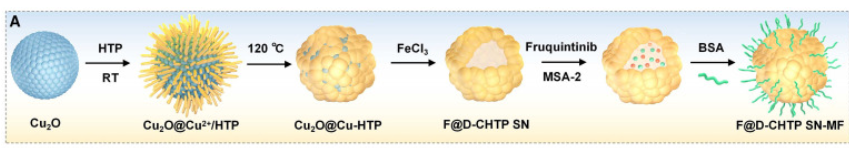
图1 F@D-CHTP SN-MF
二、纳米酶性能
共轭有机配体(HTP)和大量高度暴露的不饱和Cu-O2单原子位点赋予了F@D-CHTP SN优异的ROS生成活性,其中氧化还原中间体中存在的半醌自由基可以有效地催化O2转化为·O2-。而与Cu-O4催化位点相比,不饱和Cu-O2催化位点表现出不对称的电子分布和局部电子极化,表现出更强的催化位点暴露和过氧化物酶(POD)样催化活性。此外,中空多孔F@D-CHTP SN还表现出谷胱甘肽(GSH)响应性解离行为,能够在肿瘤微环境(TME)下按需释放Cu2+和药物,从而实现肿瘤特异性离子和药物递送(图2)。
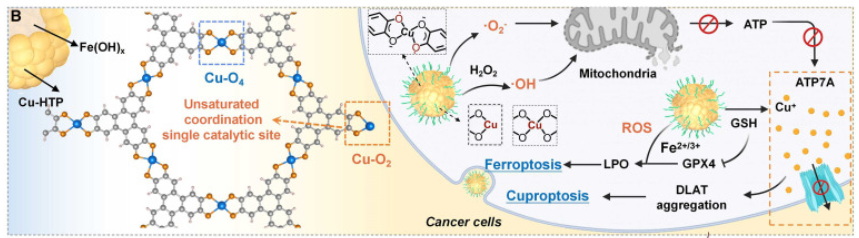
图2 F@D-CHTP SN-MF的纳米酶活性
三、治疗机制及效果
ROS的激增可导致细胞线粒体功能障碍和ATP供应不足,直接影响ATP7A功能,进而导致DLAT寡聚体介导的铜死亡。此外,各种ROS风暴以及GSH/GPX4的耗竭也会导致LPO和铁死亡。而同时诱导铜死亡和铁死亡有效地增强了肿瘤的免疫原性,进一步促进了树突状细胞的成熟和效应T细胞的激活。此外,ROS诱导的癌症细胞dsDNA泄漏促进了DC的DNA传感过程,并最终与响应GSH释放的MSA-2一起作用,以促进STING途径的激活。因此,F@D-CHTP SN-MF治疗有效地激活了先天免疫和适应性免疫。更重要的是,F@D-CHTP SN-MF治疗通过瘤内STING激活和VEGFR阻断协同促进肿瘤血管系统正常化,重塑免疫抑制性TME,增强T细胞浸润和功能,有效抑制肿瘤生长(图3)。
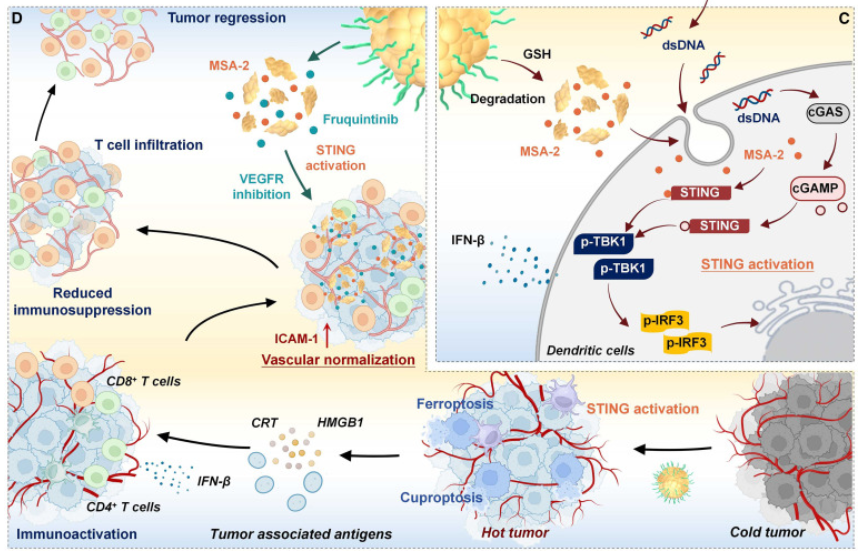
图3 F@D-CHTP SN-MF的治疗机制
【结论与展望】
该研究成功开发了一种有缺陷的铜基金属有机框架单位点纳米酶F@D-CHTP SN,其可共负载MSA-2(干扰素基因刺激剂[STING]激动剂)和福奎替尼(血管内皮生长因子受体[VEGFR]抑制剂)。F@D-CHTP SN具有优异的活性氧生成活性,可以破坏细胞氧化还原平衡,损害线粒体功能,最终诱导铜死亡和铁死亡,增强肿瘤免疫原性。同时,瘤内STING激活和VEGFR阻断协同促进肿瘤血管正常化,进一步重塑免疫抑制微环境,增强T细胞浸润,实现有效的肿瘤抑制。该工作证明了通过将铜死亡和铁死亡与STING激活和肿瘤血管正常化相结合来启动级联增强免疫的可行性和显著的协同作用。
原文链接:
https://www.cell.com/chem/fulltext/S2451-9294(24)00435-2
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#免疫治疗# #单位点纳米酶#
119