遗传性癌症筛查检出疑似致病性TP53嵌合体,该如何区分克隆性造血和嵌合性李-法美尼综合征?
2024-08-13 苏州绘真医学 苏州绘真医学 发表于上海
TP53致病变异在实体恶性肿瘤检测中带来难题,NCCN指南提出管理策略,文中通过病例探讨其诊断困境及处理,强调长期数据和技术对解决不确定性的重要性。
随着下一代测序(NGS)panels在实体恶性肿瘤中的应用日益广泛,以及人们对克隆性造血(CH)的认识不断提高,TP53致病变异(PV)给执业肿瘤学家和血液学家带来了越来越多的难题。
TP53基因位于17p染色体上,编码肿瘤抑制蛋白p53,与泛肿瘤致病性有关。TP53的胚系变异定义了李-法美尼综合征(LFS),该综合征使男性和女性一生中罹患恶性肿瘤的风险很高。值得注意的是,乳腺癌是LFS中最常见的恶性肿瘤,发病年龄中位数为33岁。
与胚系变异不同,体细胞变异在第一次合子分裂后的任何时间点出现,并可能导致不同组织中出现不同的突变谱,这种现象称为合子后嵌合体(PZM)。TP53中的体细胞PV同样与多种癌症的发病机制有关,通常预示着更糟糕的预后。CH,即造血干细胞和祖细胞中存在的体细胞变异,是造血区内PZM的一个例子。不确定潜能CH(CHIP)是指不伴有血液病的可检出CH,随年龄增长自然发生,增加全因死亡和血液系统恶性肿瘤的风险。
鉴于诊断考虑的范围和各自的风险,必须了解 NGS平台上检测到外周血(PB)或唾液中的TP53 PV的意义。高变异丰度(VAF)可能会引起对胚系起源的怀疑,当VAF在30%到70%之间时,则考虑杂合性。皮肤活检进行成纤维细胞培养是胚系确认的金标准。然而,对于已知恶性实体肿瘤且PB或唾液中高VAF TP53 PV但成纤维细胞检测阴性的患者,可能需要担心多个组织中存在PZM ,也称为嵌合性LFS。在这些情况下,PV组织分布的不确定性会给患者带来不透明的风险,也给医护人员的适当管理带来了困惑。
美国国家综合癌症网络(NCCN)在其最新发布的指南中首次认识到这种模糊性对筛查的重要影响。在尝试梳理每一种潜在情况时,他们提供了一个近似诊断的标准和后续筛查的指南,包括建议像筛查真正的胚系LFS一样筛查疑似嵌合性LFS。此类筛查方案繁琐且昂贵,包括定期全身和脑部磁共振成像(MRI)、全血细胞计数(CBC)、乳房MRI和乳房X线摄影、上和下消化道内窥镜检查以及全面的身体、皮肤病和神经系统检查。鉴于缺乏确定性,必须严格评估疑似病例,以避免给潜在CH患者带来过度的经济和心理负担。在此,研究者通过该诊所的几个病例来将这些建议情境化,这些病例说明了这种诊断困境在现实生活中是如何展开的,并且经常导致不令人满意的结论,以及需要哪些额外的工具来区分这些实体并设计个性化的管理策略。
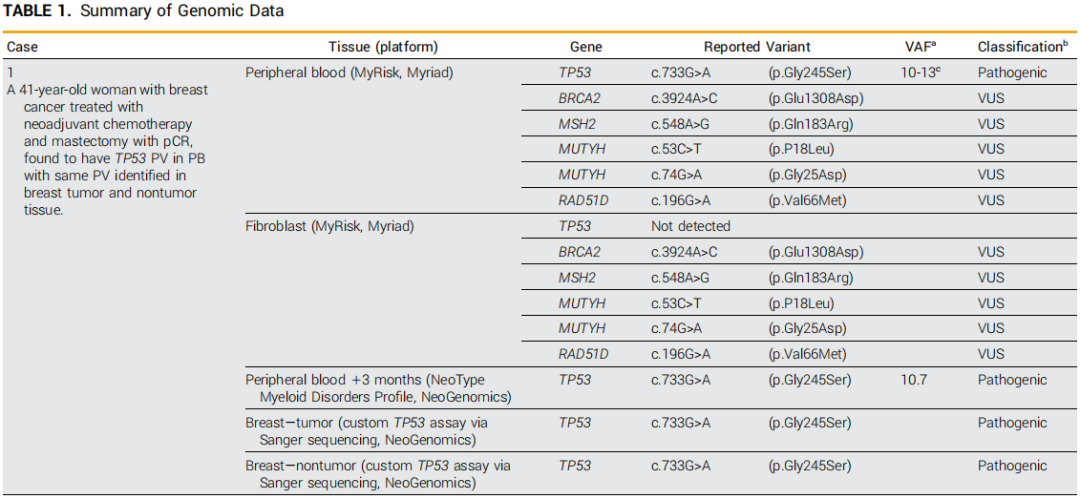
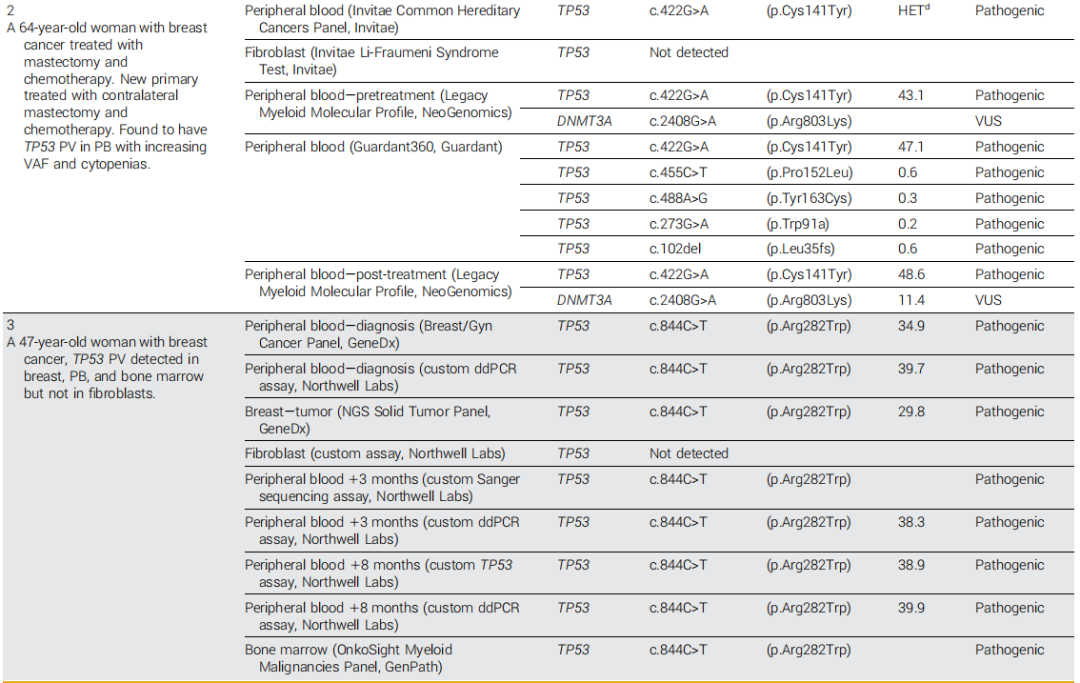

表1
病例1:默认保守
一名41岁的亚裔女性被诊断出患有三阳性IB期左乳腺癌。基于PB样本的遗传性癌症筛查发现了报告为不确定杂合性的TP53 PV,以及其他意义未明变异(VUS)。成纤维细胞检测未发现TP53 PV,但检测到了其他VUS(表1)。3个月后,在轻度血小板减少的情况下,对PB中髓系相关基因进行靶向测序,以量化和捕获克隆多样性,检测到TP53 PV,VAF为10.7%。她接受了新辅助化疗和双重人表皮生长因子受体2抗体治疗,乳房切除术显示病理完全缓解(pCR)。乳腺切除术时PB的随访NGS证实了TP53 PV的持续存在,并且在诊断活检和非肿瘤乳腺切除术组织中均发现了相同的PV。由于仅对乳腺组织进行了批量Sanger测序,因此无法明确排除造血污染,并且未报告VAF。尽管如此,血液、肿瘤和正常乳腺组织中存在PV表明嵌合性LFS,与NCCN考虑一致。对她孩子的PV检测结果为阴性,这是LFS遗传风险的重要考虑因素,但不是先证者嵌合性的决定性因素。本病例的另一个考虑因素是不存在CH的风险因素,包括她年轻、没有吸烟史以及存在TP53 PV而之前没有细胞毒性化疗史。根据当前的NCCN指南,建议她进行保守的LFS监测方案,包括考虑进行降低风险的预防性对侧乳房切除术。
病例2:临床背景的使用
一名圭亚那和东亚血统的女性在57岁时被诊断出患有右侧乳房II期三阴性浸润性导管乳腺癌。她接受了基于蒽环类和紫杉烷的辅助化疗和乳房切除术治疗,但2年后被诊断出患有对侧新发原发性肿瘤。当时,她接受了基于PB样本的基因检测,结果显示TP53 PV,被报告为杂合的,没有具体的VAF,但在确认成纤维细胞检测中未发现。没有乳腺组织样本可用于测序,也没有后代可用于级联检测。她接受了新辅助和辅助铂类和紫杉烷化疗以及左乳房切除术。基于髓系相关基因panel的靶向测序确定了VAF为43%的TP53 PV和一个额外的DNMT3A VUS。2年后随访测序中TP53 VAF增加到 48.6%。用于肿瘤监测的液体活检检测在TP53中发现了另外四个PV,VAF<1%(表1)。应用 NCCN 指南并不能缩小鉴别诊断的范围,因为有可能是CH,她肿瘤的PV状态未知,并且第二个原发癌可疑为嵌合体。这强调了在诊断时无法获得基因组评估的患者追溯应用这些建议的困难。考虑到她的年龄、化疗史和明显的克隆扩增,研究者得出结论,CH是一种可能的诊断并据此推荐了治疗。在5年的随访期间,她每3-4个月接受一次系列CBC,结果显示血细胞减少症归因于同时进行的抗肿瘤治疗,最近她被转诊到专门的CH诊所。计划在完成治疗后进行骨髓活检以排除意义不明的克隆性血细胞减少症(CCUS)或其他血液病的诊断,同时每年进行PB的NGS以评估她在之前接受细胞毒性化疗的情况下TP53突变克隆的生长情况。
病例3:结果的疑问
一名47岁的欧洲裔女性被发现患有I期激素受体阳性浸润性乳腺导管癌。该患者的家族史显著,祖母在30岁时被诊断出患有乳腺癌。对PB进行了遗传性癌症风险NGS检测,并确定一个TP53 PV,VAF为35%。她被转介到遗传咨询处,以帮助辨别PV的病因。送检乳腺活检组织并发现TP53中的相同PV呈阳性,VAF为30%;然而,成纤维细胞检测显示PV阴性(表1)。虽然通过现有的检测不能排除乳腺组织的造血污染,但NCCN指南表明有几种潜在的诊断可能。在研究者的评估中,在乳腺组织中观察到的高VAF和现有的乳腺癌诊断使嵌合性LFS成为一种可能的诊断;然而,由于PB中的VAF高于检测的肿瘤中的,因此CH也是一个考虑因素。对父母双方的证实性PV检测结果均为阴性,并为她的孩子提供了检测,但她将检测推迟到成年。全血细胞计数显示血细胞减少,因此她被转诊进行骨髓活检,证实其抽吸物中的PV和VAF与PB相同。在就LFS患者是否会出现新发原发性乳腺癌进行共同决策后,她接受了预防性双侧乳房切除术,随后进行雌激素阻断,并且没有出现疾病复发或新的血细胞减少。NCCN管理建议同意这种方法,但不针对没有共识诊断的个案,并且可能进一步建议扩大筛查范围,包括影像学、结肠镜检查和皮肤检查。对所有PB样本进行的随访数字液滴聚合酶链反应(ddPCR)检测确定了一致的38%-40%的VAF。值得注意的是,尽管她的PB中存在高VAF TP53 PV并且担心存在嵌合性LFS状态,但经过8年的随访,患者仍然没有患上血液系统癌症,也没有出现癌症复发,这进一步强调了未知个体变异和患者层面的因素有助于TP53 PV预后。
讨 论
总之,实体肿瘤测序检测中TP53 PV的解释和结果充满不确定性。NCCN对这些病例提出了明确管理策略的建议。毫无疑问,在成纤维细胞检测中证实与LFS一致的胚系TP53 PV应被参考为适当的筛选方案。当成纤维细胞检测在PB或唾液中发现的PV呈阴性时,存在重大挑战,这些病例需要进一步区分CH或嵌合性LFS,以确定适当的筛查。
值得注意的是,每个病例都是乳腺癌;然而,这反映了(1)LFS中乳腺癌的高患病率和(2)真实世界中年轻乳腺癌女性的转诊模式,她们接受来自PB的遗传性癌症检测筛查,随后转诊进行评估。然而,必须对其他肿瘤类型保持高度怀疑,因为LFS和CH都可能表现为多种原发性恶性肿瘤。
甚至在这些NCCN指南发布之前,我们就已经发现临床医生的判断、家族史、临床背景以及与临床遗传学家和遗传咨询师的合作是衡量每种情况可能性的关键。某些典型的TP53变异与LFS高度相关,而祖先背景在基因组数据库中没有得到很好体现的个体中可能会发现特征不太明显的变异。对肿瘤或非肿瘤组织的现有或计划活检进行测序可以为筛查方案提供信息,尽管造血元素的污染和无法全面绘制每个器官的体细胞图谱可能会分别限制这种方法的特异性和敏感性。选择最佳测序平台也很重要,因为Sanger测序不提供用于组织间比较的VAF,如病例1中所述,而更灵敏的技术(如ddPCR)可能有助于精确测量克隆负荷。尽管目前可用技术存在局限性,但未来在测序之前应用商业免疫表型单细胞分析或大块组织显微切割可能有助于明确PB以外远处组织部位是否存在PV。在此之前,对疑似嵌合性LFS的LFS筛查是最保守和默认的建议,与对其他嵌合性遗传疾病的筛查一致。然而,PB中每个可疑的TP53 PV是否可能存在于其他组织中令人怀疑,更不用说在每个作为癌症筛查目标的组织中了,而且嵌合性LFS应考虑的VAF范围明显较宽(0%-100%)。尽管NCCN指南是提高对这些挑战的认识的重要一步,但面对这种不确定性,共同决策制定个性化筛查方案似乎不够,而且如果没有保险覆盖,用于区分诊断可能性的检测的财务成本可能会很沉重。关于TP53嵌合体患者的长期前瞻性数据对于合理建议和告知这些患者各自部位特定癌症风险以及制定完善的指南以扩大所有类似病例的保险覆盖范围至关重要。
对于血液系统恶性肿瘤,TP53 CH的风险高度依赖于环境,在细胞毒性或放射治疗后最为令人担忧,但在没有外部选择压力的情况下风险较低。研究者监测CHIP和CCUS的做法是每3-6个月收集一次CBC,每年重复一次NGS,并进行骨髓检查以调查任何无法解释的血细胞减少症。TP53 CH也是心血管疾病的一个新兴风险因素,强调了这些患者需要进行复杂的纵向随访,鉴于TP53相关髓系恶性肿瘤的不良结果,这些患者也应转诊至专门的CH诊所进行监测和临床研究。
NGS在恶性肿瘤的筛查、诊断和治疗方面前景广阔。关于基于PB样本的TP53 PV检测如何为高危人群的未来筛查计划提供参考,还有待进一步了解。最近的NCCN指南提供了重要的第一步,但证据和获取证据所需的技术还缺乏患者寻求的确定性,无法消除恶性肿瘤的恐惧。
参考文献:
Nathan DI, Brander T, Gold J, et al. Diagnostic and Practical Challenges in Applying National Comprehensive Cancer Network Guidelines for Suspected Pathogenic TP53 Mosaicism. JCO Precis Oncol. 2024;8:e2400006. doi:10.1200/PO.24.00006

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#实体恶性肿瘤# #TP53致病变异#
35