Adv Sci:郑州大学李青等团队合作研究提出功能单体配备微凝胶系统通过干预趋化因子轴介导的神经细胞通讯来治疗帕金森病
2024-12-29 iNature iNature 发表于陕西省
该研究提出的功能单体微凝胶递送系统通过干预趋化因子轴介导的神经元和小胶质细胞之间的通讯,代表了一种有希望的治疗策略,可以控制神经炎症和促进PD患者的神经发生。
帕金森氏病(PD)的复杂病理需要全面的认识和多管齐下的干预神经细胞之间的通讯。尽管纳米技术在帕金森病的治疗中有了新的发展,但对其生物学效应的深入探索,特别是对炎症抑制的具体机制还缺乏。
2024年12月25日,郑州大学李青,李楠,中国计量大学金伟伟共同通讯在Advanced Science 在线发表题为“Functional Monomers Equipped Microgel System for Managing Parkinson's Disease by Intervening Chemokine Axis-mediated Nerve Cell Communications”的研究论文。该研究提出的功能单体微凝胶递送系统通过干预趋化因子轴介导的神经元和小胶质细胞之间的通讯,代表了一种有希望的治疗策略,可以控制神经炎症和促进PD患者的神经发生。
研究利用聚多巴胺(PDA)、咪唑基团和Cu离子形成的稳定级联催化通道,提出了一种由功能单体[双键超氧化物歧化酶(SOD)、PDA、2-甲基丙烯酰氧基乙基磷酸胆碱(MPC)和Cu离子]组成的微凝胶体系,用于控制PD。在MPC的辅助下,微凝胶可以有效地递送到大脑,然后启动针对神经元和小胶质细胞的多层次调控策略。SOD和Cu离子引发的催化活性级联可通过缓解氧化应激调节小胶质细胞的抗炎表型转化。同时,PDA释放的多巴胺(DA)促进DA的储存和神经发生,抑制小胶质细胞上CX3CL1的释放和CX3CR1受体,进而调节小胶质细胞内CX3CL1/CX3CR1-NF-κB-NLRP3信号通路,抑制神经炎症。

帕金森病(PD)是一种逐渐恶化的神经退行性疾病,影响65岁以上人群的1%,预计到2030年患病率将翻一番。PD的后果超出了个人的痛苦,导致了相当大的经济和社会成本。PD以黑质致密部(SNpc)多巴胺能神经元的降解为特征,与α-突触核蛋白(α-Syn)的生成和沉积以及神经炎症有关。临床上PD的治疗策略主要有深部脑刺激和化学药物。目前,技术障碍限制了深部脑刺激的应用。因此,药物治疗仍是帕金森病的首选。PD药物主要靶向DA,包括左旋多巴(多巴胺[DA]前体药物)、DA受体兴奋剂和单胺氧化酶B抑制剂。然而,在治疗后期,由于多巴胺能神经元的丧失,上述药物引起运动障碍和精神症状。有限的药物剂型和单一的治疗策略是限制PD治疗的主要障碍。因此,有必要开发先进的PD无创治疗方法。
为了开发有效的治疗干预措施,了解帕金森病的潜在发病机制至关重要。PD患者的大脑以小胶质细胞功能障碍为特征。小胶质细胞通过测量大脑微环境来消除病理蛋白和其他有害物质,从而负责大脑的内稳态;然而,过度活跃的小胶质细胞加剧了活性氧(ROS)引起的神经炎症。神经元与小胶质细胞之间的通讯在PD的病理过程中起着至关重要的作用,如ROS、炎症因子和α-Syn之间的传递和相互作用。趋化因子是一种蛋白质配体,通过与其同源的趋化因子受体结合,在免疫细胞的募集和激活中起着至关重要的作用。作为CX3CR亚家族的唯一成员,CX3CR1通过识别其唯一的配体CX3CL1介导神经元和小胶质细胞之间的通讯。此外,CX3CL1/CX3CR1轴参与许多人类疾病,包括神经退行性疾病。
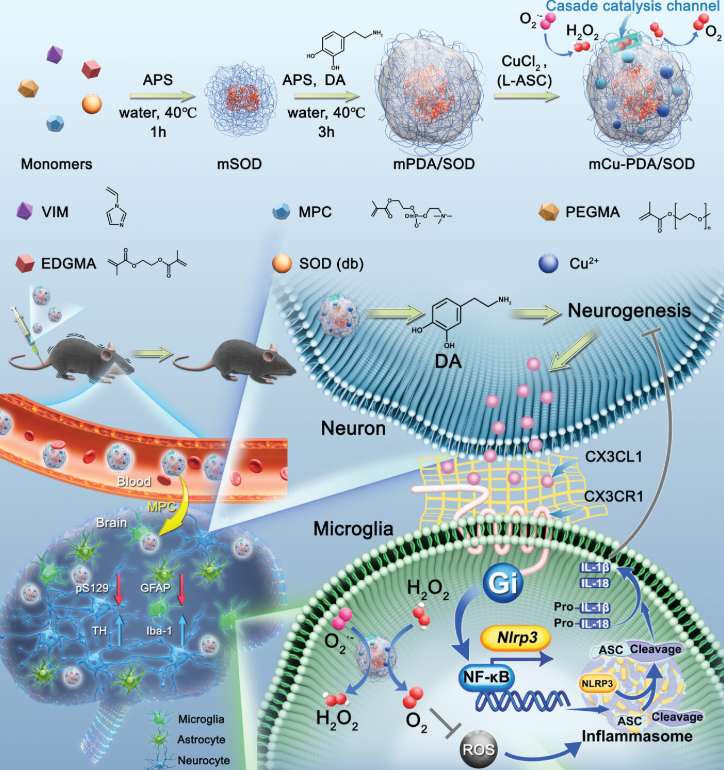
基于CX3CL1/CX3CR1介导的神经元与小胶质细胞间通讯的mCu-PDA/SOD微凝胶体系的制备过程及其治疗PD的机制(图源自Advanced Science )
纳米医学的进步,特别是在药物传递、免疫调节和氧化应激控制领域,为帕金森病的治疗提供了新的有效方法。然而,尽管针对PD发病机制,旨在保护多巴胺能神经元和调节小胶质细胞抗炎表型转化的纳米材料的发展,但通过调节不同神经细胞之间的通讯来实现PD多方面症状缓解的纳米材料尚缺乏。此外,有限的血脑屏障(BBB)渗透性和由于过度刚性导致细胞损伤的可能性限制了大多数治疗性纳米材料在PD中的临床应用。水凝胶是一种具有柔性和可修饰性的高分子纳米材料。水凝胶在PD治疗中的优势体现在以下几个方面:1)水凝胶可以形成神经细胞存活和生长的3D支架。2)水凝胶可以包封具有多种功能的抗PD药物,包括神经保护、炎症抑制、促进神经生长等。3)水凝胶可递送多巴胺能细胞等功能细胞,提高组织再生效率。此外,还开发了具有令人满意的柔韧性和高血脑屏障渗透率的微凝胶系统。然而,PD抗氧化治疗依赖于理想的电荷转移效应。微凝胶通常包含不导电的长碳链聚合物,这不利于通过级联催化清除自由基。聚多巴胺(PDA)作为一种导电聚合物,与聚合物微凝胶相容,可以有效地嵌入凝胶中,提高微凝胶的催化效果,特别是与金属离子配位时。
研究设计了一种基于多种功能单体的超氧化物歧化酶(SOD)和Cu离子的微凝胶体系,该体系在PD模型中表现出SOD和过氧化氢酶(CAT)样的催化活性,同时促进神经发生和调节神经炎症相关信号。由于乙酰胆碱受体存在于脑内皮血管中,乙酰胆碱被广泛用于脑靶向和药物递送。得益于2-甲基丙烯酰氧基乙基磷酸胆碱(MPC)和聚乙二醇(PEG)基团的存在,该微凝胶体系具有理想的体内循环时间,出色的脑靶向性,并且由于MPC中的乙酰胆碱基团而具有令人满意的脑富集性能。此外,PDA和咪唑基团可以与Cu离子配合,形成快速稳定的级联催化通道,降解SOD催化产生的H2O2。值得注意的是,酯键用于交联,允许微凝胶系统降解DA释放,并进一步促进DA补充和神经发生。神经元修复联合微凝胶系统抗氧化治疗可有效抑制CX3CL1等趋化因子的释放,进一步调节CX3CL1/CX3CR1轴及下游NF-κB-NLRP3通路,通过抑制炎症小体的组装和形成,减轻PD模型的神经炎症。因此,研究旨在开发神经元修复和抗炎治疗PD的策略。为通过CX3CL1/CX3CR1-NF-κB-NLRP3通路调节神经细胞通讯的多功能微凝胶系统提供了新的思路,具有潜在的临床应用价值。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202410070
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#帕金森氏病# #神经炎症#
6