北京宣武医院唐毅教授领衔阿尔茨海默病新药国际研究,首例中国患者已于近日完成入组
2024-12-30 小药说药 网络 发表于陕西省
该研究评价AR1001治疗早期AD临床试验,已于2024年12月19日完成中国首例患者首次给药。
阿尔茨海默病(AD)是当今世界上主要的神经退行性疾病之一,约占所有痴呆病例的60%~80%。据《中国阿尔茨海默病报告2024》数据显示,中国现存的AD及其他痴呆患病人数近1700万。随着老龄人口的逐渐增多,以及AD患病率随年龄增长而增加,迫切需要更多能够预防和延缓AD进展的治疗方法。
近年来,各国监管部门大力支持AD药物的临床开发,以期改善多年来AD患者缺乏治疗手段的局面。与此同时,科学界对AD机理认知加深和对不同药物靶点的多元研究的深入开展,助力推动针对AD药物的开发亦进入全新阶段,研究人员致力于通过更多样化的机制和路径,寻找更有效的AD治疗方案。公开资料显示,截至2024年12月,全球范围内预计近20款AD药物正处于临床3期的关键开发阶段。研发焦点除了专注对症治疗AD的药物外,也逐渐转向能缓解疾病发展进程,以期为患者提供更全面的治疗效果。
近日,韩国AriBio CO.,Ltd(AriBio)公司和纽科智联(上海)制药有限公司共同宣布,由双方在中国共同发起的一项评价AR1001治疗早期AD临床试验,已于2024年12月19日完成中国首例患者首次给药。首都医科大学宣武医院常务副院长、神经内科唐毅教授为该试验全球联合主要研究者,首都医科大学宣武医院作为中国的组长单位,中国近三十家医院参加本研究。

AR1001是一款旨在用于延缓阿尔茨海默病(AD)疾病进程的小分子口服药物,具有强效、高选择性抑制磷酸二酯酶-5(PDE-5)的作用。临床前研究显示AR001可清除AD相关的淀粉样斑块病抑制Tau蛋白的异常磷酸化,同时抑制炎症反应,并提供神经保护作用。此前经FDA(食品药品监督管理局)批准在美国完成的临床II期研究结果显示,AR1001口服片剂(30mg)具有良好的安全性特征,有望为早期AD人群(包括AD引起的轻度认知功能障碍和轻度痴呆)提供治疗获益。
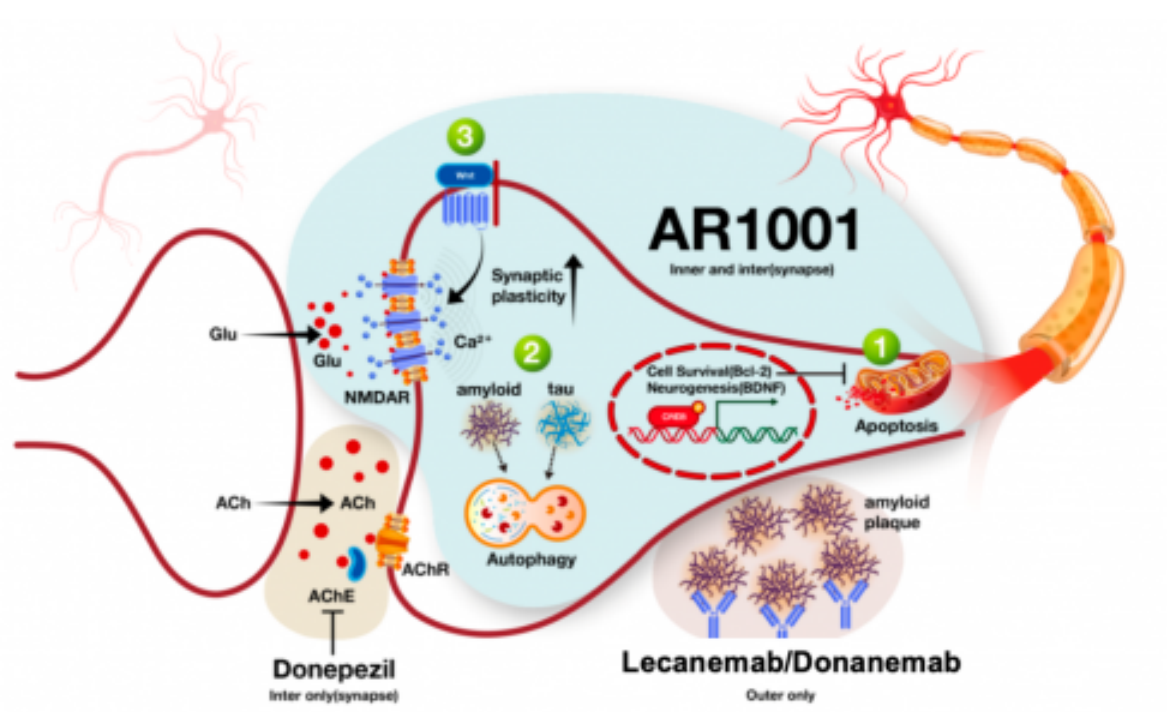
作为目前阿尔茨海默疾病领域全球范围内最受关注的治疗药物之一,AR1001 III期临床试验计划在包括中国、美国、欧洲、英国、韩国等全球多地近200个研究中心开展,拟入组1150名患者。截至目前该试验已入组患者人数过半。
唐毅教授介绍:“AD是一种多致病因素的老年疾病。近年来,随着诊断技术和病理研究的迅速发展,AD的治疗领域也迎来了新的曙光。AR1001作为一款安全性优良的口服多机制小分子药物,有望为AD的治疗提供全新的思路和方向,期待其临床效果能尽快得到验证,早日满足人口老龄化带来的日益增长的临床需求,尽早服务广大AD患者。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







