重大突破!吉林农业大学揭示神奇人参成分如何修复老年痴呆症小鼠大脑屏障
2024-10-20 梅斯循证中医药 MedSci原创 发表于上海
本研究论文阐述了G-Rg2在改善AD相关BBB通透性方面的科学发现与成果。
阿尔兹海默症(AD)是一种神经退行性疾病,在病理演变过程中,血脑屏障(BBB)的功能通常表现出显著的异常。具体表现为BBB的完整性遭受损害,其内皮细胞间的紧密连接结构可能出现松动,这一变化允许了本不应进入大脑组织的外周免疫细胞、炎症介质以及血液中某些有害的蛋白质分子,跨越BBB进入脑部环境。BBB的破坏进程在AD的发展中起到了加速作用。因此,对药物在AD病程中对BBB作用机制的详尽探讨,对于探索和开发针对AD的有效治疗策略具有极其重要的战略意义。
人参具备调节血糖水平、增强心脏功能及调控中枢神经系统活动的显著能力,人参皂苷Rg2(G-Rg2)是一种从人参中分离得到的重要三醇型皂苷,在神经系统疾病的改善方面展现出优异的疗效。研究表明,G-Rg2可能通过维护线粒体功能的稳定,有效延缓大脑的自然衰老过程。此外,近期一项科学研究指出其可能对AD诱发的神经血管损伤产生保护性作用,并能促进脑出血后脑部损伤的修复。尽管G-Rg2在多个方面表现出治疗潜力,但目前尚缺乏确凿证据来明确其是否能有效改善AD相关的BBB损伤。
日前,一篇题为“Ginsenoside Rg2 alleviates astrocyte inflammation and ameliorates the permeability of the Alzheimer’s disease related blood-brain barrier”的研究论文阐述了G-Rg2在改善AD相关BBB通透性方面的科学发现与成果。

图1 论文首页
G-Rg2可改善AD小鼠BBB损伤和记忆损伤
该研究用G-Rg2(10 mg kg-1和20 mg kg-1)治疗AD小鼠4周后,观察小鼠BBB的紧密性,炎症通路改善情况等,具体参见图2A-B。径向臂迷宫实验结果显示,氯化铝联合dgal诱导了小鼠的记忆损伤,而G-Rg2则显著提升了小鼠的记忆能力(图2B-D)。
HE染色观察表明,对照组细胞排列紧密且有序,细胞间距均匀,细胞核形态清晰。相较之下,模型组细胞排列紊乱,神经细胞出现破裂,细胞核明显收缩。值得注意的是,经G-Rg2(10 mg kg-1)处理的组别中,细胞形态变化较小,细胞核虽有少量收缩,但细胞排列更为紧密。进一步地,G-Rg2(20 mg kg-1)组展现出接近正常的细胞形态,细胞排列紧密且有序(图2E)。
尼氏染色结果揭示,模型组内的Nissl小体数量显著减少;然而,G-Rg2干预促进了Nissl小体的增加(图2F)。透射电镜分析进一步确认了G-Rg2的保护作用,对照组基底膜结构正常,连接紧密,星形细胞形态健康。模型组中,血脑屏障的基质膜出现轻微溶解,星形细胞端足水肿。而G-Rg2预处理显著减轻了这些病理变化,外周细胞清晰,基底膜结构恢复至正常状态(图2G)。综上所述,研究表明,G-Rg2预处理对AD小鼠的认知功能障碍具有显著的改善作用,能够有效保留神经元的正常形态与功能,并促进BBB损伤的修复。
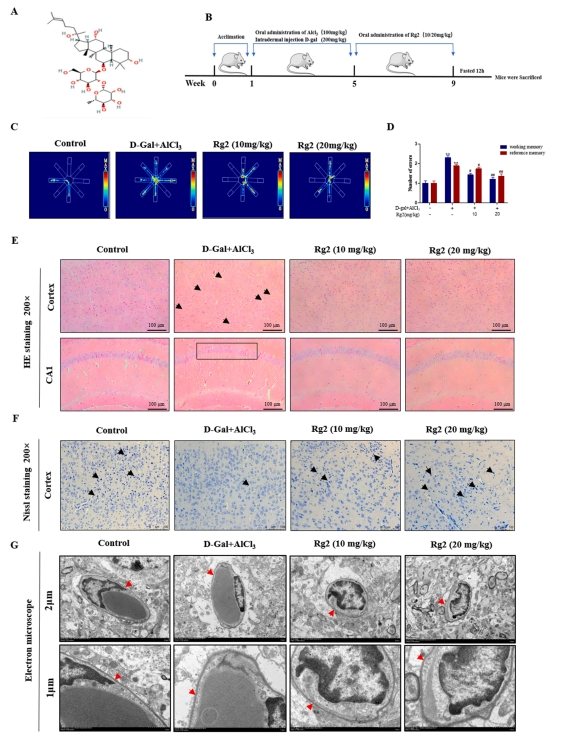
图2 G-Rg2可改善AD小鼠BBB损伤和记忆损伤
G-Rg2可改善AD小鼠脑组织血脑屏障的损伤
免疫blot分析明确揭示了模型组中紧密连接蛋白(TJs)的表达水平呈现显著下降趋势,与此同时,基质金属蛋白酶2(MMP2)和基质金属蛋白酶9(MMP9)的表达水平则出现上调。进一步观察发现,经过G-Rg2处理后,紧密连接蛋白及粘附连接蛋白的表达显著增强,而MMP2与MMP9的表达则受到抑制(图3A-D)。此结果与免疫组化染色分析所得结论相吻合。具体而言,在模型组小鼠的脑微血管样本中,Occludin与ZO-1的棕色染色强度明显减弱,而MMP2与MMP9的染色强度则相对较高。
这些差异直接反映了模型组中TJs含量较低,而MMP2与MMP9的含量则相对较高。相反,在G-Rg2处理组小鼠的脑组织中,TJs中的ZO-1与Occludin的棕色染色显著加深,而MMP2与MMP9的染色则明显减弱。这一变化进一步证实了G-Rg2能够提升脑组织中ZO-1与Occludin的表达水平,并降低MMP2与MMP9的含量。免疫荧光染色结果显示,在G-Rg2治疗组中,小鼠脑组织中ZO-1与Occludin的绿色荧光染色强度显著增加,进一步验证了G-Rg2对小鼠脑组织中ZO-1与Occludin表达具有促进作用(图3E-H)。
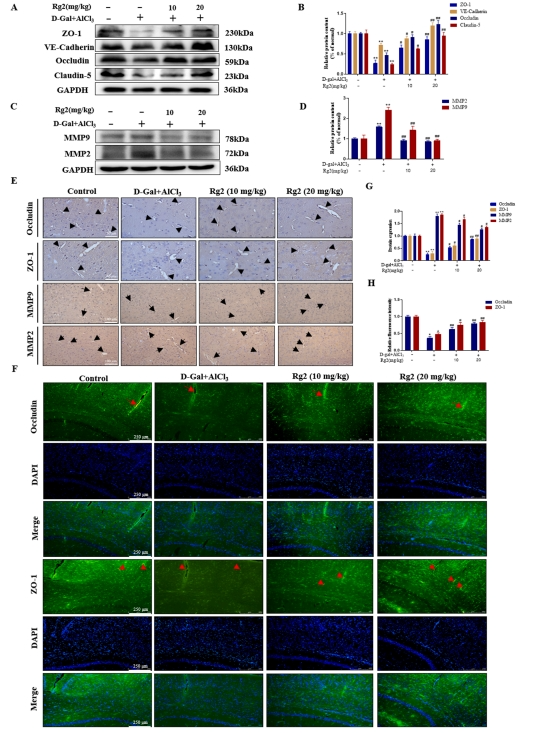
图3 G-Rg2可改善AD小鼠脑组织BBB损伤
G-Rg2对AD小鼠脑组织炎症反应的影响
TLR4与G-Rg2分子对接的自由能测定结果为-5.63千卡/mol,表明两者间结合效果较佳(图4A)。研究通过分子动力学分析,发现其平均均方根偏差(RMSD)及均方根波动(RMSF)值分别维持在0.115 ± 0.015 nm与0.106 ± 0.039 nm的稳定水平,证实了TLR4与G-Rg2分子间的稳定结合状态(图4B)。Western blot实验结果显示,在模型组中,TLR4与MyD88的蛋白表达均显著上升,同时伴随着NF-κB p65与IκBα磷酸化水平的显著增强。然而,经G-Rg2治疗后,这些效应得到了明显缓解,表现为炎症相关蛋白表达水平的下调(图4C-D)。
此外,ELISA分析揭示,模型组小鼠脑组织中的TNF-α与IL-1β含量显著升高;而G-Rg2给药后,这两种促炎细胞因子的浓度则呈现下降趋势(图4E-F)。免疫荧光染色技术进一步证实了上述发现,模型组小鼠脑组织内观察到NF-κB p65的核易位现象,提示脑组织内存在炎症反应;而G-Rg2治疗组中,NF-κB p65的核易位显著减少,大部分仍保留在细胞质中,表明G-Rg2有效减轻了小鼠脑组织内的炎症反应(图4G-H)。
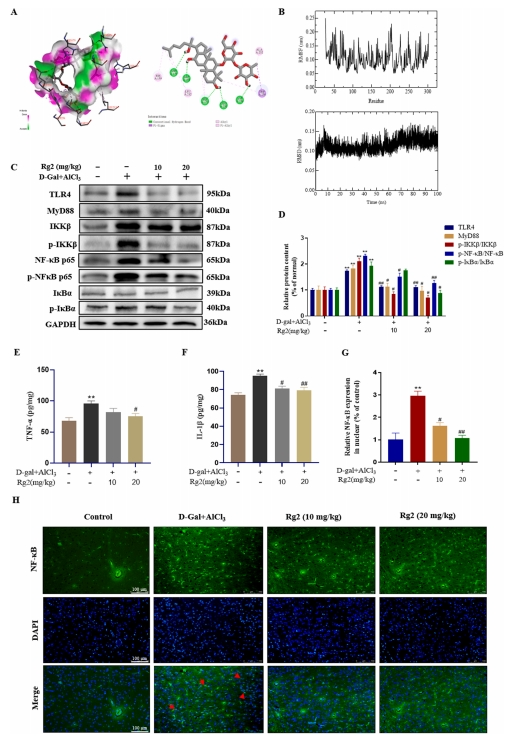
图4 G-Rg2对AD小鼠脑组织炎症反应的影响
G-Rg2减弱了OA诱导的bEnd3细胞中TJs的减少
免疫印迹分析亦揭示了OA刺激引发的bEnd3细胞中TJs的降解现象。结果显示,G-Rg2(在浓度分别为5 μM、10 μM、20 μM时)的预处理措施显著增强了TJs的稳定性,具体表现为claudin-5、occludin、ZO-1以及载体粘附连接蛋白表达水平的上调(图5A-B)。而免疫荧光染色技术也验证了这一发现,模型组中的bEnd3细胞显示出TJs关键组分ZO-1、occludin以及claudin-5的显著降解。当细胞经G-Rg2预处理后,这些TJs的表达量得到了明显的增加(图5C-D)。
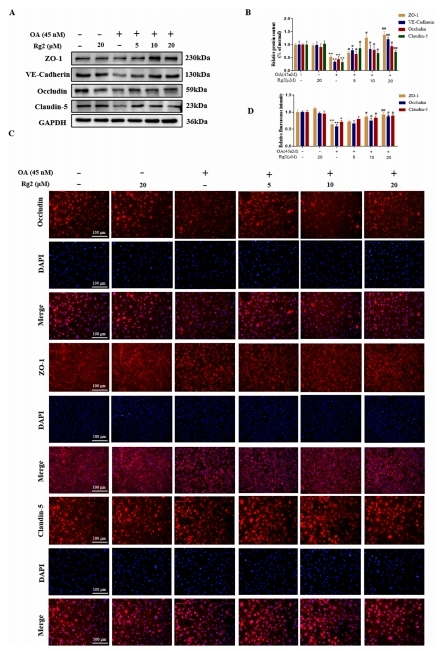
图5 G-Rg2可以促进OA诱导的bEnd3细胞中紧密连接蛋白的降解
结论
该研究深入探索了G-Rg2在维护BBB功能方面的作用,不仅为理解G-Rg2如何影响AD相关的BBB损伤提供了新视角,还坚实地证明了G-Rg2作为AD辅助治疗手段的潜在价值。
参考文献:
Lu YW, Wang YJ, Wang Z, Ren S, Gong XJ, Hu JN, Zhang JT, Li W. Ginsenoside Rg2 alleviates astrocyte inflammation and ameliorates the permeability of the Alzheimer's disease related blood-brain barrier. Phytomedicine. 2024 Sep 16;135:156063. doi: 10.1016/j.phymed.2024.156063
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#阿尔兹海默症# #人参皂苷Rg2#
19