JACC Basic Transl Sci:从生物质角度观察肺动脉高压的发病机制和改善疾病的治疗机会
2024-11-16 刘少飞 MedSci原创 发表于上海
通过生物量这一概念来探讨PAH的病理生物学,不仅为该疾病的早期诊断提供了新的标志物,也为药物研发提供了潜在的靶点。

远端肺动脉小动脉的纤维增生性重塑是肺动脉高压(PAH)最为显著和基础的病理特征之一。随着PAH的进展,肺血管的结构发生显著改变,导致肺循环阻力增高,最终引发右心衰竭和患者死亡。近年来,基于定量影像学的现代数据揭示,PAH的血管重塑过程并非单纯的血管壁增厚或结构改变,而是由一系列细胞和分子层次上的变化驱动,具体来说,是由于大分子底物的合成发生异常,进而导致血管壁的纤维化和增生。这些大分子底物在本文中被统称为“生物量”(biomass),它们包括DNA、胶原蛋白、细胞骨架成分和脂质膜等结构分子。
生物量的合成和降解之间的平衡,是维持正常细胞功能和组织稳态的关键。在PAH的发生过程中,病变的血管内皮细胞、平滑肌细胞和间质细胞等通过过度合成生物量,进而导致了血管的异常重塑。具体来说,DNA的合成和修复、胶原蛋白和细胞外基质的过度沉积,以及细胞骨架和脂质膜成分的异常变化,共同促进了血管的增厚、硬化及功能失调。这一过程的关键在于生物量的合成途径过度活跃,而降解途径的效率不足。因此,PAH的病理特征不仅仅是血管结构的改变,还涉及到细胞内代谢途径的异常调控。
在PAH的治疗研究中,改变生物量的合成与降解平衡成为了一个新的策略。理论上,如果能够通过调控生物量的合成与降解途径,倾斜这一平衡,增强内源性降解机制的活性,而抑制合成路径的过度活跃,就有可能有效地减缓或逆转血管的重塑,从而改善肺动脉高压的临床症状。然而,这一目标的实现并非易事,它需要更加精细和特异的药物干预,才能在不损害正常组织功能的情况下,调节这一平衡。
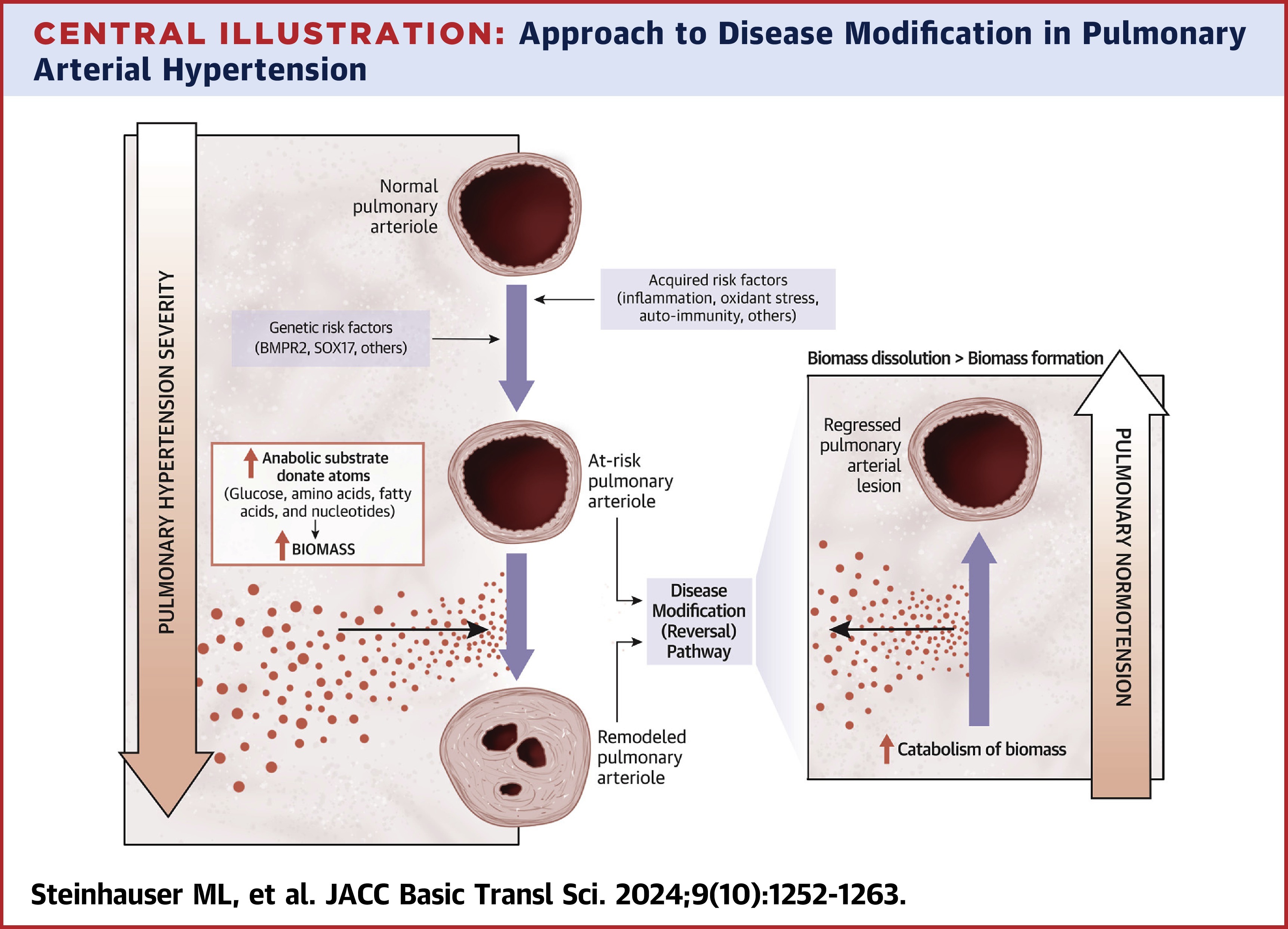
通过生物量这一视角来审视PAH的发病机制,提供了一种全新的思路。传统上,PAH的治疗研究主要集中在血管舒张、抗炎、抗血栓等方面,尽管这些方法在一定程度上能够缓解症状,但尚未能根本改变疾病的进程。相反,如果能够通过改变生物量的合成与降解机制,干预细胞内的分子动态,可能会开辟出一种全新的治疗方式。这种治疗不仅有望减缓血管重塑的进程,还可能通过逆向重塑(reverse remodeling)实现血管功能的恢复,甚至改善右心功能,从而大幅提升患者的生存质量和预期寿命。
目前,基于这一思路的研究尚处于初期阶段,但已有一些 promising 结果。比如,某些药物通过抑制胶原蛋白合成或促进其降解,已经在动物模型中显示出一定的疗效。除此之外,针对DNA修复、细胞骨架重构及脂质膜代谢等方面的干预,亦逐步成为研究热点。这些研究成果不仅为PAH的治疗提供了新的方向,也为我们理解疾病的基本机制提供了更深入的见解。
总之,通过生物量这一概念来探讨PAH的病理生物学,不仅为该疾病的早期诊断提供了新的标志物,也为药物研发提供了潜在的靶点。未来的研究将需要进一步阐明生物量合成与降解的精细调控机制,探索更多可逆转血管重塑的治疗策略,并推动相应药物的临床转化。随着对PAH病理生物学理解的深化以及技术手段的进步,或许我们能够在不久的将来,见证首个真正能够改变PAH病程的药物问世,从而为广大的患者带来福音。
参考文献:
Steinhauser ML, Maron BA. Viewing Pulmonary Arterial Hypertension Pathogenesis and Opportunities for Disease-Modifying Therapy Through the Lens of Biomass. JACC Basic Transl Sci. 2024 Jul 3;9(10):1252-1263. doi: 10.1016/j.jacbts.2024.04.009. PMID: 39534642; PMCID: PMC11551874.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#肺动脉高压# #生物质角度#
47