【醉翁之艺】甘露聚糖结合凝集素与2型糖尿病小鼠模型中的炎症和肾脏损伤相关
2024-10-20 古麻今醉网 古麻今醉网 发表于上海
研究补体因子 MBL 在糖尿病肾病中的作用,发现 OB 小鼠 MBL 及 C3 水平升高,肾脏病变加重,慢性炎症及 MBL 结合在 DN 发展中有重要作用。
研究背景
糖尿病肾病是糖尿病患者肾功能衰竭的主要原因,慢性高血糖后的内皮功能障碍与糖尿病肾病的进展密切相关。补体系统是先天免疫系统的中心组成部分,在人体的第一道防线中起着重要作用。已有研究表明补体系统与糖尿病微血管并发症有关。补体系统通过三种不同的途径之一被激活:经典途径、旁路途径和凝集素途径。当与表面结合时,补体的凝集素途径由模式识别分子激活,包括两种碳水化合物识别凝集素,甘露聚糖结合凝集素(MBL)和凝集素LK,以及三种ficolins(H-、L-和M-ficolin)。例如,MBL与其靶标的上调结合,MBL相关丝氨酸蛋白酶(MASP)启动下游补体激活。在此过程中,几种补体因子被切割,导致过敏毒素C3a和C5a的形成,以及调理因子C3b和iC3b在细胞膜上的沉积。此外,补体激活会启动膜攻击复合物(MAC)的形成,从而破坏细胞膜。
补体系统的自身反应性表明,糖尿病可能是由高血糖诱导的表面胺酸的糖基化引发的,形成非酶促糖基化终产物(AGEs)。1型糖尿病(T1D)患者的血清MBL水平高于健康人,高MBL水平与微血管并发症有关。1型糖尿病(T1D)患者的血清MBL水平高于健康人,高MBL水平与微血管并发症有关。此外,在12年的随访中,与高MBL水平相关的MBL基因型转换与T1D患者的死亡率增加有关。最近研究发现,MBL基因型高表达的T2D患者表现出肾功能受损。本研究使用的是2型糖尿病和肾病的动物模型( BTBR.Cg- Lep ob/ WiscJ;菌株#004824)(OB),该模型的进行性蛋白尿和肾小球组织病理学与人类糖尿病肾病非常相似。这是一种动物模型,表现为肥胖和暴饮暴食,发展为严重的胰岛素抵抗和高胰岛素素血症,并发展为糖尿病。
研究结果
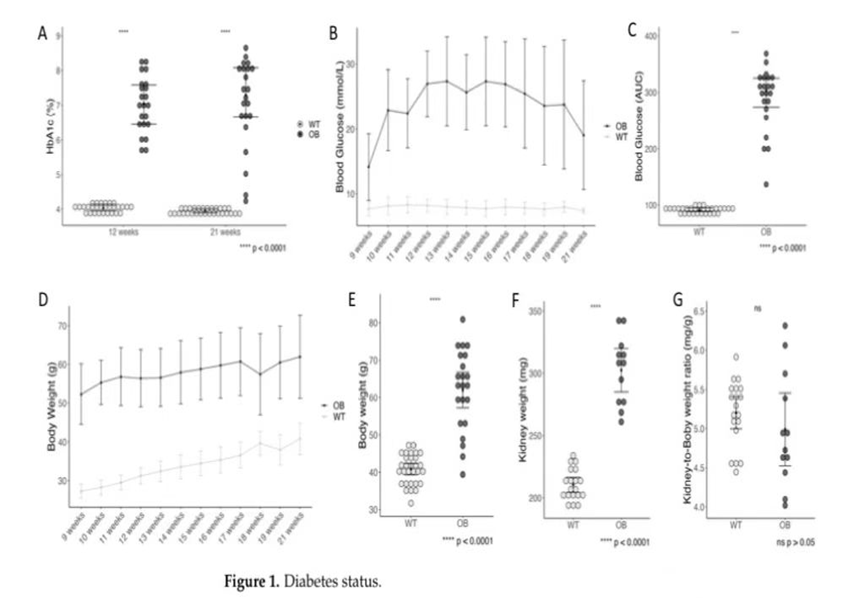
1.糖尿病状况、肾脏体重和肾-体重比水平
在第12周和研究结束时,TheOB小鼠呈现出糖尿病表型,糖化血红蛋白高于非糖尿病野生型小鼠(图1A).OB小鼠的血糖水平高于WT小鼠(图1B).与曲线下面积(AUC)相比,研究期间血糖水平的发展情况(图结果表明,OB小鼠的葡萄糖水平显著高于wt小鼠。与预期的一样,OB小鼠的体重迅速增加(图1D),导致在研究结束时各组间的深刻差异(p<0. 0001)(图1E).OB组的肾脏重量明显升高(图1F).然而,当肾脏重量与体重恢复正常时,没有观察到差异(图1G)。
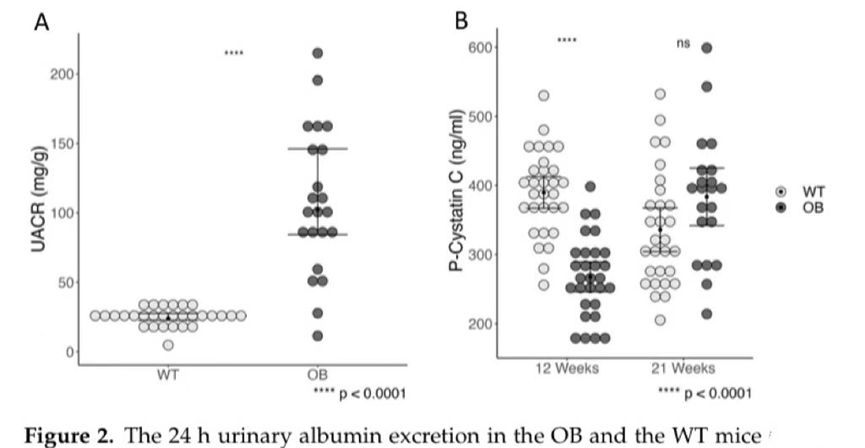
2.白蛋白-肌酐比值和血浆胱抑素C水平
与非糖尿病的WT小鼠相比,OB小鼠的尿白蛋白-肌酐比值(UACR)显著升高。这些发现与第21周血浆胱抑素对肾功能的评估一致,显示OB组血浆胱抑素C有升高的趋势(图2B)。然而,它们在统计学上并不显著(p=0.07)。WT小鼠的血浆胱抑素C水平随时间降低,而OB小鼠的水平升高。为了评估血浆胱抑素C的差异是否在该动物模型的早期阶段就已经很明显,我们测量了5周龄小鼠的血浆血浆胱抑素C,但OB和WT小鼠之间没有观察到差异。
3.免疫组化
通过肾脏形态和免疫组化评估糖尿病的肾脏变化(图3A)。肾小球反应被用作衡量肾小球肥大的指标,与WT相比,OB组的肾小球面积显著增加(p<0.0001)(图3C)。此外,与野生型小鼠相比,OB小鼠的系膜区分数显著增加(p<0.001)(图3B)。
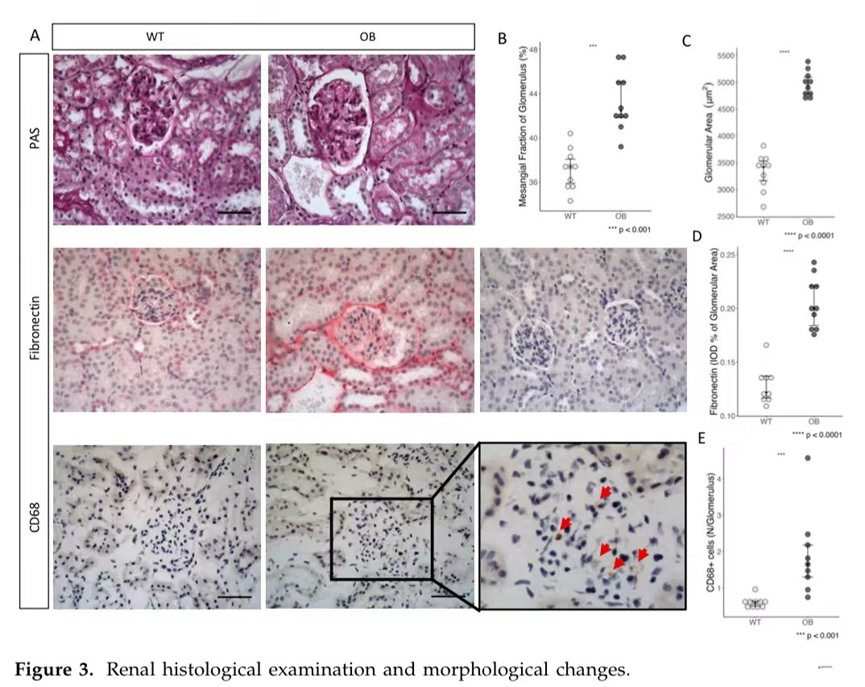
4.纤维化
我们通过连接蛋白外和肾小球胶原蛋白的沉积来评估纤维化的形态学改变。与野生型小鼠相比,我们发现OB小鼠肾小球区域的纤维连接蛋白沉积在统计学上显著增加,p<0.0001(图3D)。相比之下,胶原蛋白沉积没有差异。
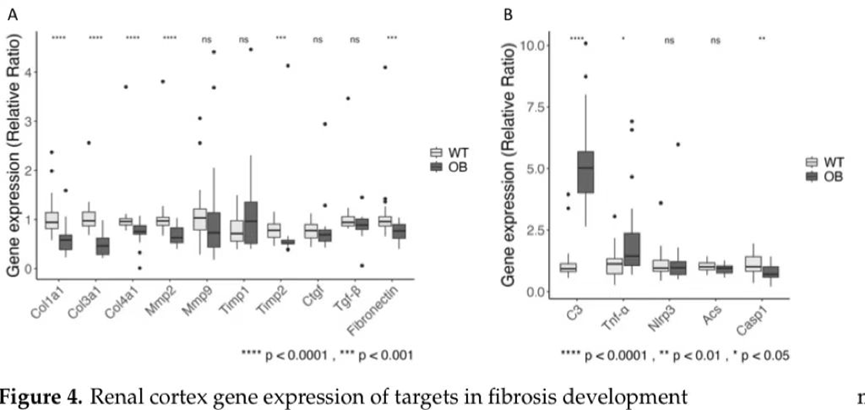
为了评估糖尿病对纤维化相关基因mRNA表达的影响,我们分析了编码胶原1、3和4(Col1a1、Col3a1、Col4a1)、纤维连接蛋白(Fn1)、基质金属蛋白酶-2和-9(Mmp2和Mmp9)、金属蛋白酶-1和-2的组织抑制剂(Timp1和Timp2)的mRNA表达,以及纤维生成介导因子TGF-β(Tgfb1)和TGF-β作用结缔组织生长因子(Ctgf)的介导因子(图4A)。与野生型小鼠相比,我们发现OB小鼠胶原基因和纤维连接蛋白基因的表达下调。OB小鼠中编码MMP2和TIMP2的mRNA表达降低,而与WT小鼠相比,编码MMP9、TIMP-1、TGF-β和CTGF的基因表达没有显著差异(图4A)。
5.补体系统和炎症反应
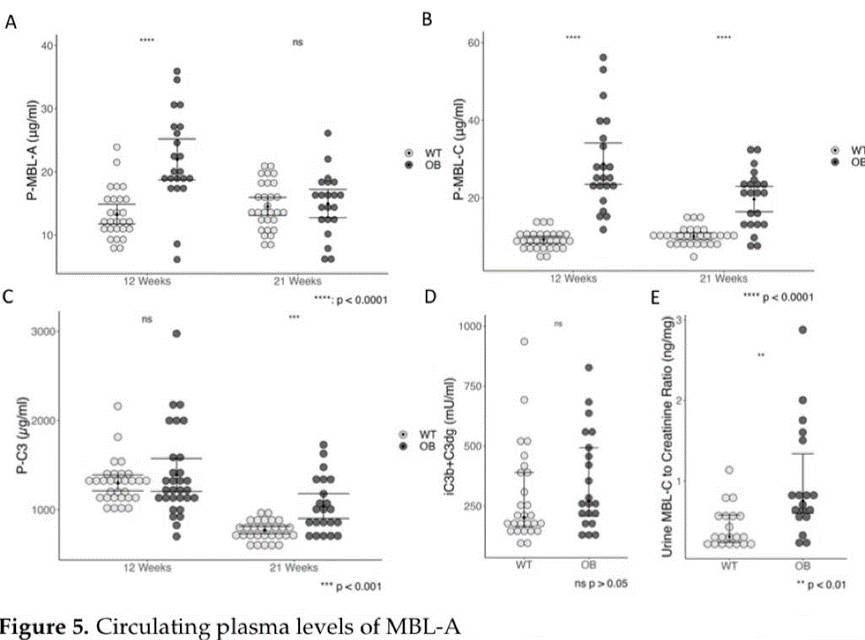
我们发现OB小鼠在第12周时血浆中MBL-A水平显著升高,,而在第21周时没有发现差异。在第5周时,OB小鼠的MBL-A的浓度几乎是WT小鼠的两倍。WT小鼠的MBL- A水平没有随时间而变化 (图5A)。同样,与WT 相比,OB组在12周和21周时血浆MBL-C水平显著高于WT。对于MBL-A,血浆MBL- C的浓度为5周龄野生型小鼠的两倍。我们研究了尿液中MBL- C的排泄情况,发现OB小鼠的浓度比WT小鼠增加了一倍多 (图5E)。
在5周或12周时未检测到总C3水平的差异(图5C),但我们发现OB小鼠在21周时的血浆C3水平显著升高(p<0.001),尽管在比较第12周(WT:1295;IQR=214和OB:1233;IQR=406)和第21周(WT:761;IQR=135和OB:990;IQR=449)的总C3水平时,WT(p<0.0001)和OB小鼠(p<0.001)在21周的水平显著降低(图5)。这些数据与基因表达分析一致,表明OB小鼠中C3 mRNA的表达较高(图4B)。在WT组和OB组中,C3水平在12至21周时均有所下降(p=0.01)。补体C3片段C3d和iC3b的水平被定量作为补体激活的指标。我们发现WT组和OB组之间的C3片段水平没有统计学差异,无论是5周龄的小鼠还是21周龄的老鼠(图5D),C3片段/总C3比率也没有差异(数据未显示)。
我们分析了与补体系统激活和肾组织炎症相关的选定基因的表达。除了OB小鼠中C3 mRNA的增加外,我们还发现与WT小鼠相比,OB小鼠中编码TNF-α的mRNA表达增加(p=0.014)。与野生型小鼠相比,OB小鼠中Casp-1的表达显著降低,p=0.006(图4B)。我们分析了Nlrp3基因的表达,因为该炎症小体是caspase-1 激活所必需的,而表达含有CARD(ACS)基因表达的凋亡相关斑点样蛋白则与炎症小体 形成的相互作用有关。然而,Nlrp3和Acs基因的表达在糖尿病小鼠中都没有明显的改变(图 4B).
通过测定血浆中的血清类囊体A3(SAA-3)来评估全身炎症。OB小鼠的SAA-3水平显著升高(p<0.0001)(图6),这在5周时就已经存在(p=0.002)(补充表S1)。WT小鼠(p<0.0001)和OB小鼠(p=0.021)的SAA3水平在12至21周内显著降低。SAA-3与MBL-A或MBL-C之间没有相关性。

6.肾小球的补体染色及炎症反应
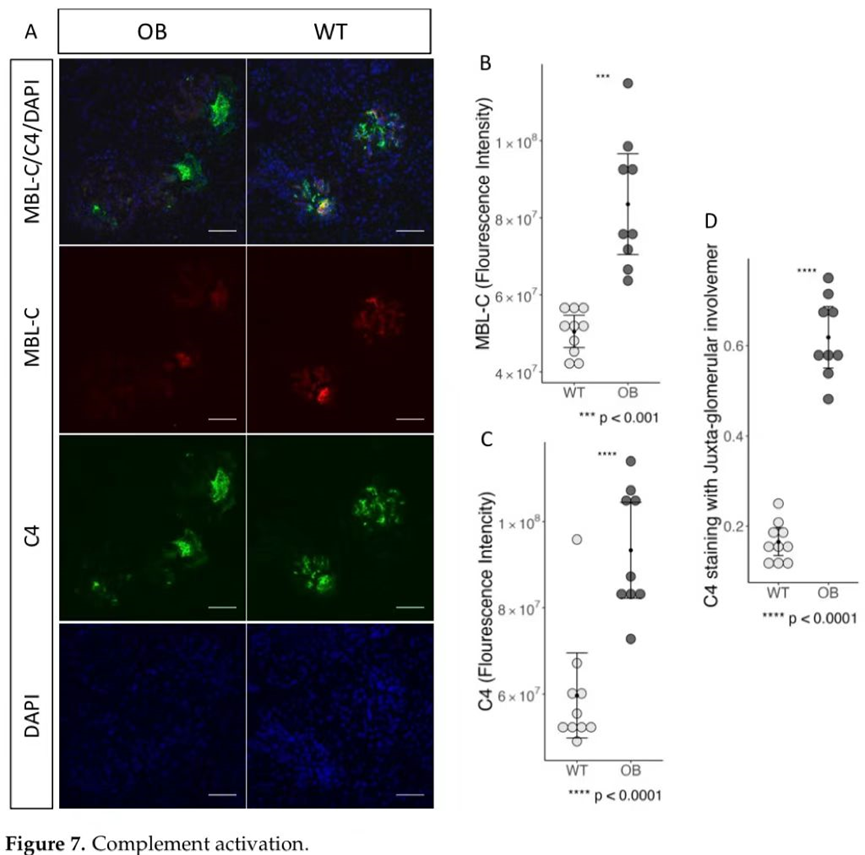
在研究MBL-C和C4的免疫荧光染色时,我们发现了肾小球中MBL结合增加和补体系统激活的证据(图7A)。与野生型小鼠的染色相比,OB小鼠的MBL-C染色更为强烈(图7B),p=0.0003。随后,我们对C4沉积(C4b形式)进行了染色,作为通过凝集素和/或经典途径进行补体激活的指示。我们发现,与野生型相比,OB小鼠的C4荧光强度增加,p<0.0001(图7C)。此外,我们观察到,与WT相比,OB组的C4染色主要位于肾小球旁区域,WT组的染色均匀分布在整个肾小球区域(图7D)。
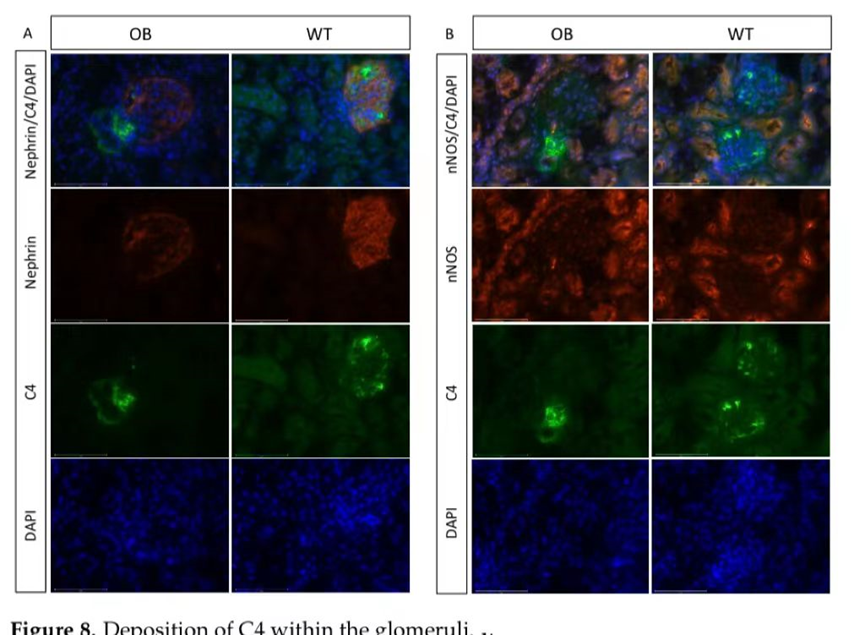
通过足细胞染色评估C4染色在肾小球中的定位(图8A)。OB小鼠中C4沉积的增加似乎并不位于足细胞附近。然而,nNOS染色显示管状区域和致密斑区域,显示系膜区域可能受累,靠近致密斑区域和附近的管状结构(图8B)。
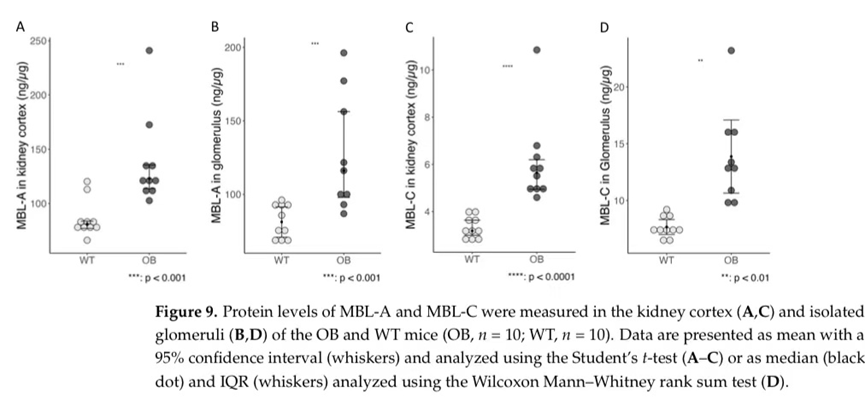
随后,我们分析了均质化的快速冷冻肾皮质和快速冷冻、过滤器分离的肾小球中MBL-A和MBL-C蛋白的存在。我们发现MBL-a和MBL-C在肾皮质和肾小球中的积累显著增加(图9)。我们进一步分析了肾脏MBL的表达,以研究检测到的MBL-A和MBL-C是否起源于局部表达。然而,在基因表达分析中,两组的mbl1(编码MBL-A)和mbl2(MBL-C)Ct水平均高于32,表明表达非常低,因此统计分析无意义。因此,肾组织中不存在相关水平的局部MBL-A或MBL-C产生,检测到的MBL来源于循环MBL的沉积。
7.MBL在体外的粘附性
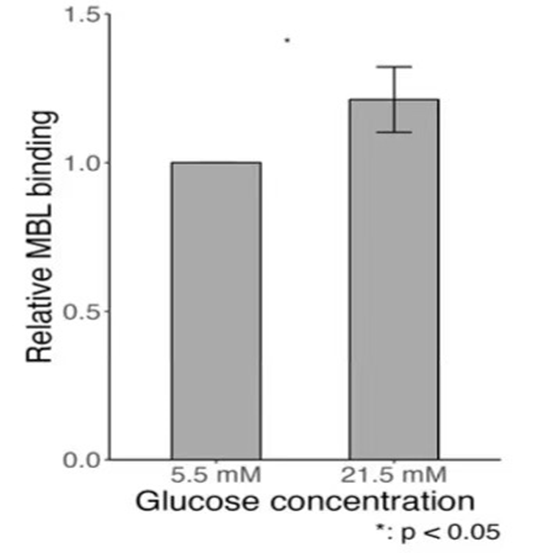
在体外实验中,人血管内皮细胞分别在高血糖(21.5mM葡萄糖)或正常血糖(5.5 mM葡萄糖)条件下培养15天(+/−5天)。与我们的体内研究结果表明MBL自反应性一致 ,我们发现与高血糖环境相比,在高血糖环境中培养时,MBL与HUVECs的结合更高, p=0.03(图10)。
研究小结
补体系统的自身反应性可能会加剧视网膜肾病的发展。我们使用BTBR OB 2型糖尿病小鼠模型来研究补体因子甘露聚糖结合凝集素(MBL)在糖尿病肾病中的作用。其中包括雌性BTBR OB小鼠 (n = 30)和BTBR非糖尿病WT小鼠(n = 30)。对血浆样本(第12周和第21周)和尿液样本(第 19周),分析MBL、C3、c3片段、SAA3和肾功能标记物。分析肾组织切片的纤维化、炎症和补体沉积。分析肾皮质的基因表达(补体、炎症和纤维化),并检测分离的肾小球细胞的MBL蛋白。用流式细胞术分析在正常和高血糖条件下培养的人血管内皮细胞。我们发现,与野生型小鼠相比,OB小鼠血 浆和尿液中MBL-C浓度分别升高(p < 0.0001和p<0.001)和血浆C3水平升高(p < 0.001)。OB小鼠肾冷冻切片显示肾小球中MBL-C和C4沉积增加,巨噬细胞浸润增加(p = 0.002)。与OB和WT小鼠相比,分离的肾小球显示MBL蛋白水平明显升高(p < 0.001),且未检测到肾脏MBL的表达。总结来说,慢性炎症通过MBL与高血糖暴露的肾小球细胞的结合,在DN的发展中起着重要作用。
原始文献
Gry H. Dørflinger, Charlotte B. Holt, Steffen Thiel,et al. Mannan-Binding Lectin Is Associated with Inflammation and Kidney Damage in a Mouse Model of Type 2 Diabetes.International Journal of Molecular Sciences.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#糖尿病肾病# #补体因子# #甘露聚糖结合凝集素#
36