解码中国阿尔茨海默症现状
2024-11-27 小药说药 小药说药
本文介绍阿尔茨海默病(AD)及其他认知障碍疾病,阐述其流行病学特征(患病率、发病率和死亡率、经济负担)、影响因素、诊断和治疗现状,展望未来加强方向,以应对疾病带来的挑战。
前言
阿尔茨海默病(Alzheimer′s disease,AD)及其他认知障碍疾病是发生于老年期和老年前期的一组神经系统退行性疾病,起病隐袭且病程呈进行性发展,临床表现以获得性认知功能损害为核心症状,涉及记忆、学习、定向、理解、判断、计算、语言和视空间等认知域,不同程度地影响日常生活能力及社会职业功能,最终进展为全面性痴呆。在痴呆患者中AD最常见,约占65%。疾病进程通常可由主观认知功能下降(subjective cognitive decline,SCD)➝ 轻度认知功能障碍(mild cognitive impairment,MCI)➝痴呆(dementia)逐渐进展。
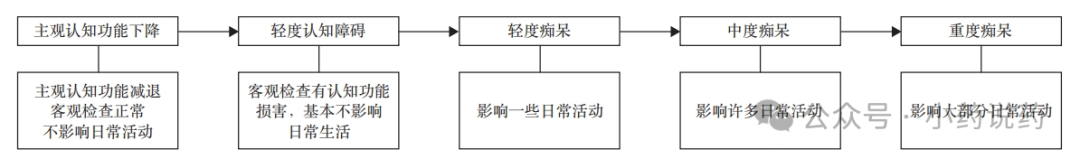
随着我国人口老龄化加剧,AD及其他认知障碍疾病的患病率和死亡率均不断上升,已成为严重危害人民群众健康和影响社会可持续发展的重大疾病之一。然而,我国AD及其他认知障碍疾病的诊疗资源仍严重不足,疾病的就诊率、诊断率和治疗率偏低,诊疗专科和专业诊疗人员不足。此外,AD及其他认知障碍性疾病患者的基本生活自理能力下降,不仅严重影响患者的生命健康,还需要长期照料服务,给家庭和社会带来了沉重的经济和照料负担。因此,AD及其他认知障碍疾病不仅是医务人员需要面对的难题,更需要整个社会的关注和支持。
流行病学特征
一、患病率
根据GBD数据,2019年全球AD及相关痴呆的患病人数达到5162万,总体患病率为 667.2/10万,年龄标化患病率为 682.5/10万。同年,我国 AD 及相关痴呆总人数为1314 万, 大约占全球AD患者总人数的25.5%,我国AD及相关痴呆总体患病率为924.1/10万,年龄标化患病率为788.3/ 10万。
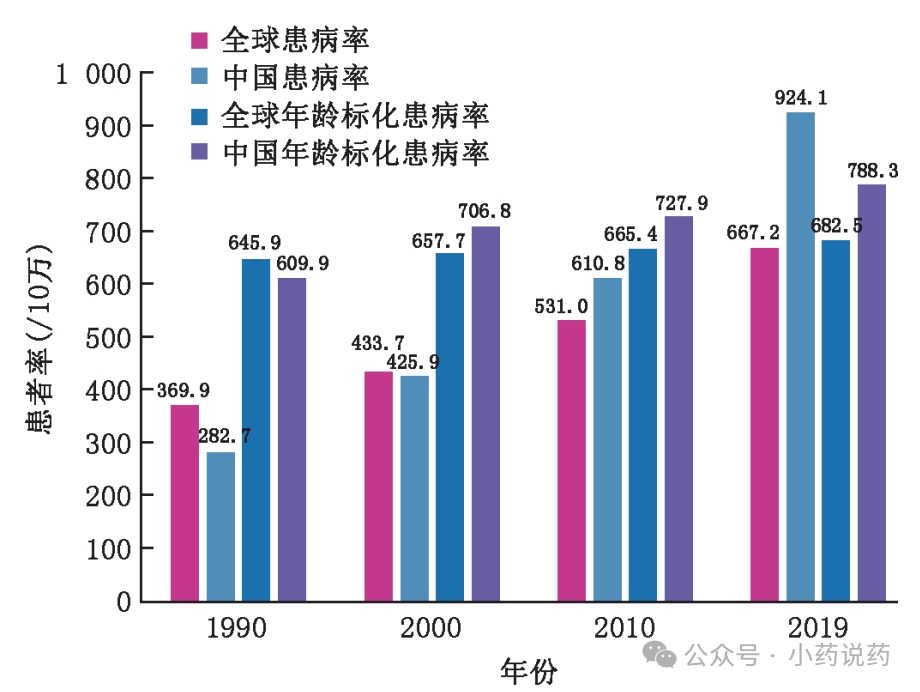
随着年龄的增长,AD及相关痴呆患病率呈指数增长。MCI和 SCD患病率也呈明显的上升趋势。
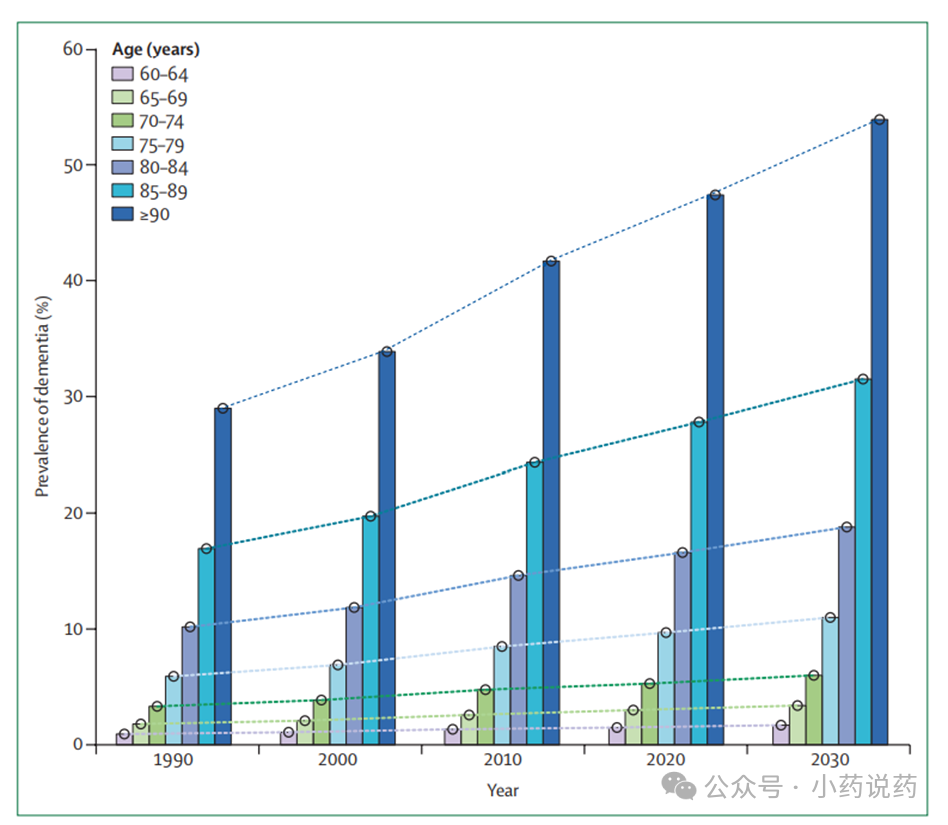
我国女性AD及相关痴呆、MCI、SCD患病率均高于男性。GBD数据显示,2019年我国女性AD及相关痴呆的年龄标化患病率为871.7/10万,男性为 663.9/10万。此外,我国农村地区人群 AD、MCI 和 SCD 患病率均高于城市地区。一项针对我国65岁及以上居民的全国性调查发现,我国农村地区人群AD患病率明显高于城市地区人群(农村:4.25% vs城市:2.44%,P<0.001)。我国不同省份AD及相关痴呆的患病率也呈现明显差异。2019 年我国 AD 及相关痴呆年龄标化后患病率较高的地区主要分布在华北、华中及东北地区,排名前五的省份是河北(928.5/10 万)、河南(889.3/10 万)、吉林(882.4/10 万)、广东(845.5/ 10万)及浙江(815.6/10万)。
二. 发病率和死亡率
根据GBD数据,2019年中国AD及相关痴呆的发病率达到126.6/10万,年龄标化发病率为 103.8/10万。男性年龄标化发病率为89.7/10万,女性为115.2/10万。该研究也发现,农村地区人群MCI发病率显著高于城市地区人群,农村地区人群MCI的 5年累积发病率为 14.6%,城市地区人群 MCI 的 5 年累积发病率为6.6%。
由于中国人口老龄化进展迅速,AD 死亡率稳步上升,死因顺位从 1990年第 19位跃升为 2019年第6位,已成为我国人群第六大死因。在我国,AD及相关痴呆的整体死亡率呈上升趋势。从1990年到2019年,我国AD及相关痴呆的死亡率从7.9/10万增加到22.6/10万。
经济负担
根据世界卫生组织的数据,2019年全球AD及相关痴呆的费用为每年1.3万亿美元,预计 2030年这一费用将增加到1.7万亿美元,考虑照料等间接费用,则相关总成本将高达2.8万 亿美元。一项系统综述报告,2019年全球122个中低收入国家中痴呆相关费用平均占国内生产总值的0.45%,其中间接成本占比58%,直接成本占 42%。在高收入国家中,痴呆相关费用在GDP中的占比更是达到了1.4%。在英国,痴呆相关的经济负担在2008年就已超出 癌症、冠心病和脑卒中的总和。
我国是AD及相关痴呆总成本最高的中低收入国家之一。一项全国多中心研究调查指出,中国 AD 患者的社会经济总成本在2019年已达到了1950亿美元,到2030年我国AD患者的社会经济总成本预计将达到5074.9 亿美元,并在2050年达到1.89万亿美元。此外,我国已出台一系列举措来减轻家庭和个人AD 的经济负担。从2019年至今,我国已有多个省 市陆续将 AD 纳入门诊慢性特殊疾病目录,患者可享受门诊慢性特殊疾病医保待遇,即在门诊也可以按照住院报销比例进行报销。2021 年,治疗 AD 新药甘露特钠胶囊首次被纳入医保目录,且价格降幅超60%。
影响因素
AD 等认知障碍疾病发病风险与多种因素有关,这些影响因素包括社会人口学因素、遗传因 素、生活方式、疾病或功能障碍、环境因素共五大类。
一、社会人口学因素
随着年龄增大,AD发病风险呈指数增长;女性患AD 和 MCI的风险较男性更高;受教育程度较低与 AD 发病风险较高相关;此外,生活在低社会经济地位区域且个体经济地位较低的 AD 患者死亡风险高于生活在高社会经济地位区域且高个体经济地位患者。
二、遗传因素
AD家族史是AD的危险因素。AD可分为家族性AD和散发性AD。其中家族性 AD 是一种罕见的AD类型,这类AD患者的发病年龄较早,通常在同一家族中有多例患者,其相关的基因突变主要为淀粉样蛋白前体(APP)基因,早老素1(PSEN1)基因和早老素2(PSEN2)基因等。已有多种基因被证明与散发性AD发病风险密切相关,其中最重要的是APOE基因。在我国散发性AD人群中,约有36.2%人携带APOE ε4等位基因。针对中国人群的一项 研究结果表明,携带APOEε4等位基因的人群患AD的风险是非携带者的2.85 倍。
三、生活方式
一项全国横断面研究发现,在我国年龄≥ 60岁的老年人群中,吸烟者发生AD及相关痴呆的风险是不吸烟者的1.85倍。另一项研究发现,每日饮酒者发生AD的风险是偶尔饮酒者 的1.72倍。经常进行锻炼是AD及相关痴呆的保护因素,2023 年的一项研究显示,经常锻炼者发生MCI风险比不经常锻炼者低一半。此外,CHARLS研究显示,社交活动也是AD及相关痴呆的保护因素,子女探望也可以降低约 1/5的MCI风险。
基于CLHLS的研究发现,在我国高龄老人(80 岁及以上)中,几乎每天参与认知活动的老年人,如打牌或打麻将、阅读书籍或报纸的人,出现认知障碍的风险较低。因此,认知活动也是AD的保护因素。此外,基于 CHARLS 研究显示,总睡眠时间和夜间睡眠时间与认知障碍风险呈U型关系,总睡眠时间为8 h和夜间睡眠时间为 6~7 h者患认知障碍的风险最低。相反,失眠与痴呆风险增高相关。
膳食中补充抗氧化剂、叶酸、维生素B、维生素C和维生素E、多酚和多不饱和脂肪酸对预防AD有益,食用鱼、水果、蔬菜和饮用咖啡或咖啡因饮料也可以降低AD风险。此外,一项关于AD可控危险因素的分析发现,与非健康饮食模式相比,健康饮食模式可使AD的风险降低57%。
四、疾病或功能障碍
基于CHARLS的研究发现,非糖尿病人群在情景记忆方面表现优于糖尿病患者(P<0.05);与非高血压人群相比,高血压患者发生认知障碍的风险增加;在我国开展的一项队列研究发现,抑郁症患者患痴呆、AD和血管性痴呆的风险增加,其中重度抑郁症患者患AD的风险是非抑郁症患者近9倍;此外,创伤性脑损伤与痴呆的风险增加相关;2021年的一项研究显示,在60~ 85岁人群中,冠心病以及脑卒中是AD患者的危险因素。脑血管疾病患者发生MCI的风险是健康人群的2.31倍,心血管疾病患者发生MCI的风险是健康人群的1.67倍。
研究显示,超重、肥胖人群患AD风险均显著上升;与非高脂血症人群相比,高脂血症人群患 MCI和痴呆的风险更高;贫血 增 加认知障碍患病风险;肾功能下降可增加认知障碍的患病风险;同时,肾功能下降也是全因痴呆、AD的危险因素;慢性阻塞性肺疾病(COPD)患者罹患AD及相关痴呆的风险是非COPD患者的1.32倍。
五、环境因素
我国的一项队列研究发现,随访期间大气 PM2.5暴露水平每升高4.34μg/m³,AD发生风险增加138%。基于CLHLS研究发现,PM2.5水平每升高20 μg/m³,与认知障碍风险增加10% 显著相关。
诊断现状
目前我国不同级别医院对AD及其他认知障碍疾病诊断存在一定的差异,影响了诊断的准确 性。由于费用昂贵和医疗资源有限,诊断认知障碍疾病一些先进的辅助检查手段(生物标志物检测、PET检查等)在区县级医院中尚未得到普及。有记忆门诊和没有记忆门诊的医院间认知障碍疾病的诊断数量差异很大。
诊断延迟是AD及其他认知障碍疾病的突出问题,既往研究表明患者从出现认知障碍症状到初次就医存在时间延迟,就诊时往往已有明显症状。一项纳入1993例AD患者的回顾性 研究发现,患者发病年龄为(69.8±9.5)岁,诊断年龄为(72.0±10.0)岁,65.1% 的患者在诊断时已有中重度症状。影响诊断延迟的因素较为复杂,包括患者、家庭和社会等各个方面。
诊断延迟是我国AD及其他认知障碍疾病患者诊断现状的痛点之一。目前,多部政策文件强调老年痴呆的防治工作,多地组织开展老年人失能(失智)预防干预试点,一定程度上改善了AD及相关痴呆的诊断延迟现状。
治疗现状
一、药物治疗
目前我国国家药品监督管理局批准用于治疗 AD的一线药物包括胆碱酯酶抑制剂,如多奈哌齐、 卡巴拉汀等 ,以及N‑甲 基‑D‑门冬氨酸(NMDA)受体拮抗剂美金刚。2019年国家药品监督管理局有条件批准了甘露特钠胶囊上市注册申请,用于治疗轻度至中度AD。2024 年 1 月仑卡奈单抗(lecanemab)注射液获国家药品监督管理局批准上市,用于治疗由 AD引起的 MCI和轻度痴呆,该药是靶向拮抗聚集的可溶性和不溶性 β‑淀粉样蛋白(Aβ)的一种人源化免疫球蛋白lgG1单克隆抗体,可减少Aβ斑块沉积。
在临床上其他辅助药物包括奥拉西坦、吡拉西坦、脑蛋白水解物、银杏叶提取物片等用于协同治疗多种原因导致的老年期痴呆,但缺乏高质量的循证医学证据。针对AD引起的精神和行为症状,可选择非典型抗精神病药(奥氮平、利培酮、喹硫平等)以及 5‑羟色胺类药(西酞普兰、丁螺环酮等)治疗。此外,中医药治疗AD痴呆符合AD进展期间的证候演变规律, 显示了一定的证候关联效应。根据中国阿尔茨海默病痴呆诊疗指南(2020年版),中医药治疗 AD提出了“早期补肾为主并贯穿全程,中期化痰活血泻火,晚期解毒固脱”的序贯疗法,联合常规西药治疗AD痴呆有协同增效作用。
近年来中国AD及其他认知障碍疾病治疗的药物临床试验数量有所增加。过去10年(2014 年-2023年)已经完成的 AD 及其他认知障碍疾病相关的药物临床试验共有 31 项,包括 23 项Ⅰ期试验、2项Ⅱ期试验、5项Ⅲ期试验、1项Ⅳ期试验。这些药物可分为 3 类:(1)化学药物,如盐酸多奈哌齐口溶膜和甘露特钠胶囊;(2)中药/天然药物,如复方银杏叶片、五加益智颗粒;(3)生物制品,如 donanemab 注射液和 gantenerumab 注射液。
《2023年中国阿尔茨海默病:事实与数字》显示,10.3%的认知障碍患者未接受任何治疗。受访患者最常使用的抗痴呆药物为多奈哌齐(52.4%)和 美金刚(34.6%)。在接受药物治疗的患者中,近一半的患者(48.9%)对现有药物治疗的效果表示不满,其次是药物价格贵(36.7%)。因此,亟须针对这些问题和痛点进一步改善我国AD患者的治疗现状。
二、非药物治疗
非药物治疗作为药物治疗的有效补充,在帮助患者保持认知功能和日常生活能力以及改善精神行为症状方面取得一定进展。目前AD的非药物治疗方法主要集中在认知干预、神经调控、运动疗法等。
展望
随着我国人口老龄化的加剧,AD及相关痴呆在我国的患病率和发病率均不断上升。目前,我国 已有1300余万AD及相关痴呆患者,给我国带来了巨大的社会和经济负担。面对这一挑战,未来需要进一步加强以下方面的建设:(1)强化AD早期防控措施,加大科普力度,提高公众对AD相关知识尤其是其预防手段的了解;(2)健全我国认知障碍疾病专科规范化诊疗体系;(3)鼓励AD诊治技术的创新和推广应用;(4)积极解决AD患者照护困境。
参考文献:
1.中国阿尔茨海默病蓝皮书(精简版).中华医学杂志 2024 年7 月30 日第 104 卷第 29 期
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#阿尔茨海默病# #认知障碍疾病#
8